刺激响应和靶向型介孔二氧化硅纳米颗粒递送抗肿瘤药物的研究进展
2021-08-26李姗姗贺冠迪梅其炳卢婷利武祥龙
郭 燕,刘 浩,李姗姗,贺冠迪,陈 强,梅其炳,卢婷利,武祥龙*
(1.西北工业大学生命学院 空间生物实验模拟技术重点实验室,陕西 西安 710072;2.西北工业大学伦敦玛丽女王大学工程学院,陕西 西安 710129;3.西北工业大学材料学院,陕西 西安 710072)
癌症的发病率与死亡率逐年上升,已成为全球致人死亡的主要原因。长期或大剂量服用化疗药物可诱导肿瘤细胞凋亡,但由于缺乏特异性,对正常组织也会产生毒副作用。近年来,科学家正在不断探索纳米材料作为药物载体,以克服此问题。介孔二氧化硅纳米颗粒(mesoporous silica nanoparticles,MSN)因比表面积大、孔径可调、良好的热稳定性和化学稳定性、优异的生物相容性以及易于表面修饰而受到人们的广泛关注[1-2]。由于MSN的介孔结构是开放的,科研人员将壳层、封堵剂或阻滞剂通过静电相互作用、氢键或共价接枝到MSN上,在内部或外部刺激作用下实现孔的开放和闭合,可控释放所负载的药物。内部刺激主要包括pH值、氧化还原和酶等,外部刺激包括光、磁场和超声波等。目前,开发智能介孔递药材料已成为研究热点[3]。刺激响应型MSN以治疗癌症为目的递送抗癌药物(如阿霉素、喜树碱、紫杉醇等),可以最大限度地减少循环过程中的高浓度化疗药物、避免其对正常细胞的毒副作用以及药物的分解和变性,在生物医学领域具有很好的应用前景[4]。MSN药物递送系统除了通过刺激响应递送药物外,还可以通过与靶向分子结合,实现在肿瘤部位定向积累,防止在循环过程中泄露,进而提高药物递送系统的靶向能力。
作者详细调研了2019~2021年关于MSN药物递送系统的刺激响应和靶向治疗的文献,对pH响应型、光响应型、超声响应型等MSN在抗肿瘤药物递送中的研究进展进行综述。
1 pH响应型MSN
纳米药物载体大多依赖于高通透性和滞留效应(enhanced permeability and retention effect,EPR),EPR能引导纳米药物颗粒到达肿瘤部位,增强其在肿瘤内的积聚。但EPR是一种被动靶模式,并不是对每个肿瘤细胞都有效。因此,需要更多的药物或更长的治疗周期来达到对肿瘤的有效反应。肿瘤细胞的生长和繁殖需要大量的能量,同时分泌大量的酸性分子,为了在酸性环境中清除肿瘤细胞,需要开发有效的具有pH响应能力的药物递送系统,该系统在低pH值环境下,可以实现药物快速释放,作用于肿瘤细胞。
Chen等[5]提出了一种可选择性和特异性释放药物的pH和氧化还原双重响应纳米药物递送平台,利用壳聚糖(chitosan,CS)将负载阿霉素(Doxorubicin,DOX)的MSN通过二硫键进行封口,再修饰透明质酸(hualuronic acid,HA) 提高亲水性和实现药物递送系统的靶向给药。在谷胱甘肽(glutathione,GSH)和酸性增加的情况下,CS与MSN之间的二硫键断裂,MSN的介孔开放,导致DOX经介孔孔道向外扩散。这表明MSN-CS-CDs@HA NPs具有较低的毒性和较高的载药效率(最高可达32.5%),对肿瘤细胞具有靶向性和高细胞毒性。有研究者[6]用二硫键对单分散MSN表面进行修饰,然后通过二硫键对其进行CS共价封口,以防止药物在循环过程中泄漏,并以水杨酸(salicylic acid,SA)作为模型药物,制备的MSN-S-S-CS利用pH响应性显著提高了药物递送系统的靶向能力,大大减少了药物递送过程中正常细胞的内化机会,是一种很有前途的抗肿瘤药物载体。
虽然CS已被广泛用作MSN的包覆材料,但是,CS分子量大(约1 000 kDa),不易溶于水和碱性介质,不适于实际生物应用。而由CS降解得到的壳聚糖寡糖(chitosan oligosaccharide,COS)则具有低分子量(约2 kDa)、完全溶于水、几乎完全吸收等优良的化学性质,被认为是一种独特的生物聚合物,适于生物和环境应用。文献[7]报道,采用金属配体络合配位法在MSN表面制备COS涂层,以DOX为模型抗癌药物,所制备的MSN@COS NPs可应用于pH响应控制药物递送,在酸性(pH值为6.5、5.0、4.0)条件下表现出较高的载药量(63%)和pH依赖性药物释放行为,且药物释放行为随释放介质pH值的降低而增强。
有研究者[8]利用CS和甲氧基聚乙二醇(methoxy polyethylene glycol,MPEG)的协同作用在MSN上实现pH响应。用CS和MPEG对MSN进行改性,分别提高了MSN的pH响应性和亲水性。改性MSN对正常细胞无毒,但能有效诱导肿瘤细胞凋亡,在酸性(pH值为4.0、6.0)磷酸盐缓冲溶液中的盐酸阿霉素释放量较在中性或碱性(pH值为7.3、8.0)磷酸盐缓冲溶液中的显著增加。表明该MSN药物递送系统具有控释作用,被认为是一种潜在的多种抗肿瘤药物递送平台。
Bao等[9]设计并合成了一种pH响应型MSN药物递送系统,具有明显的pH响应性和靶向性。以活性MSN为载体,将甲氧基聚乙二醇胺和L-谷氨酸偶联并接枝到MSN载体表面,提高了药物递送系统的稳定性;氮掺杂碳量子点(N-CQDs)和HA可以抑制药物的快速释放。体外释药研究表明,在pH值为5.0时释药率为55.7%,远高于pH值为7.4时的释药率;药物递送系统通过内吞作用进入肿瘤细胞,释放DOX作用于细胞核,对肿瘤具有靶向治疗作用。
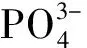
Taleghani等[11]设计了一种pH响应型MSN药物递送系统用于控制输送和肿瘤靶向地拉罗司(Deferasirox)。将pH响应的聚酰胺-胺(PAMAM)树突状分子链接在MSN上,葡萄糖醛酸作为靶向剂,偶联到纳米颗粒表面以增强对肿瘤细胞的亲和力。由于树突状结构在酸性环境下处于开放状态,在pH值为4.5(溶酶体pH值)时,所载抗肿瘤药物释放量最大。糖修饰载体改善肿瘤细胞的摄取,增强抗肿瘤药物对视网膜母细胞瘤细胞系Y79的细胞毒性。该药物递送系统在肿瘤治疗方面具有潜在的应用价值。
当环境pH值为7.0时,聚赖氨酸和聚谷氨酸分别带有正电荷和负电荷,修饰在MSN上的聚赖氨酸和聚谷氨酸通过静电相互作用自组装,形成颗粒聚集,堵住介孔。当pH值降低到目标值时,如pH值由7.0降至4.5,聚赖氨酸和聚谷氨酸会改变其平衡,改变带电性能,使聚集状态改变,导致部分药物释放,pH值变化不同会导致不同的药物释放速率。有研究者[12]通过在MSN表面进行N-羧酸开环聚合,制备了聚L-赖氨酸-单分散二氧化硅(PLL-MSN)和聚L-谷氨酸-单分散二氧化硅(PLG-MSN),调节PLL-MSN与PLG-MSN的比例,可以实现不同pH值下的药物控释。体外细胞毒性实验表明,负载DOX的混合纳米颗粒(PLL-MSN与PLG-MSN的比例为1∶1)可在HeLa细胞中释放药物,使HeLa细胞杀伤率达到88%。Hegazy等[13]制备了一种基于3-(甲基丙烯酰氧)丙基三甲氧基硅烷和N,N-二甲氨基甲基丙烯酸乙酯单体的pH响应型MSN,DOX负载于MSN介孔中,通过pH值变化进行开关控释。
叶酸(folic acid,FA)是一种稳定的、非免疫原性的水溶性B类维生素,选择性地与叶酸受体(folate receptor,FR)结合;由于FR通常在多种人类肿瘤细胞表面过表达,且与FA结合具有高亲和力,因此,许多抗肿瘤药物递送系统通过FA提高其靶向性,FA介导的活性靶向和pH响应的多功能单分散二氧化硅(MSN-COOH-Tet-HBP-FA)在药物靶向递送方面具有潜在的应用价值。端氨基超支化聚合物(hyperbranched polymer,HBP)具有大量的端氨基和分支,它们因独特的球形类腔拓扑结构、低溶液黏度和良好的溶解性而受到广泛关注。MSN经羧酸功能化后,将HBP和FA修饰在MSN表面,使抗肿瘤药物负载率达到26.86%,并增强了对HeLa和A549细胞的毒性[14]。
氧化铈(cerium oxide,COP)可以在Ce3+和Ce4+价态之间切换,具有依赖于pH值的抗氧化活性。Ce3+/Ce4+氧化态的循环使COP具有过氧化氢酶样活性和超氧化物歧化酶样活性,COP对肿瘤细胞具有细胞毒作用是因为它具有促氧化性,可显著提高活性氧(ROS)水平,从而导致肿瘤细胞凋亡。Singh等[15]制备了包覆COP的MSN药物递送系统(COP@MSN),利用pH响应机制控制药物释放,该药物递送系统在酸性介质中表现出典型的药物释放特征,而在中性介质中则没有。
2 光响应型MSN
光是一种特别有吸引力的外部刺激,因为它可以实现空间和时间控制。由于紫外光可能对生物样品和活体组织造成损伤,而可见光对生物样品和活体组织无损伤,因此,可见光常被广泛应用于临床药物递送系统的开发。
四邻甲氧基取代偶氮苯(tetra-ortho-methoxy-substituted azobenzene,mAzo)是一种新型的可见光响应性发色团,含mAzo的聚合物在绿光照射下由反式异构体变为顺式异构体,蓝光照射下则由顺式变为反式,因此,通过2种可见光照射可在热稳定的异构体之间进行双向光切换。mAzo对pH值也很敏感,因为偶氮基团可以质子化,产生偶氮原聚体。Bian等[16]成功制备了可见光触发的mAzo和β-环糊精(β-cyclodextrin,β-CD)修饰的MSN药物递送系统,以β-香豆酸(cumaric acid,CA)为模型药物,通过季铵化反应制备了聚甲基丙烯酸N,N-二甲氨基乙酯(PDMAEMA),并将其负载到MSN介孔中。利用可见光控制PDMAEMA与MSN表面β-CD的包合和排斥反应,可逆地控制MSN深部组织中CA的释放。在绿光照射之前,CA以自由扩散的方式被负载到MSN介孔中;在绿光照射下,mAzo从反式异构体转变为顺式异构体,顺式偶氮苯由于主客体对不匹配,β-CD不能识别偶氮苯,从而释放出CA。
有研究者[17]以金纳米星粒子(gold nanostars,AuNSts)为内核,以介孔硅(mSiO2)为壳制备了AuNSts@mSiO2载体,将DOX负载到载体的介孔壳层中,外表面功能化的聚乙二醇 (PEG)衍生物包含光活性的2-硝基苄基连接剂,通过多光子激发过程诱导2-硝基苯连接物在近红外低功率辐照下的光解离,随后PEG衍生物从纳米颗粒表面剥离,DOX从介孔壳层释放。
Chen等[18]设计了一种基于MSN的光和pH双重刺激响应的药物递送系统,用于递送盐酸阿霉素,通过表面引发原子转移自由基聚合(surface initiates-atom transfer radical polymerization,SI-ATRP)和化学水解,将引发基团修饰的MSN接枝到对光和pH敏感的随机共聚物P(SPMA-co-MAA)上,光敏SPMA基团在365 nm的紫外光照射下发生光异构化反应,从疏水螺吡喃形态转变为亲水性九型美罗欣形态。在中性或碱性条件下,分子链处于膨胀状态,相反,聚合物壁在酸性环境下会坍塌。
棕榈酸(PA)与中国林蛙抗菌肽chensinin-1b偶联得到的抗菌肽PA-C1b具有很强的抗肿瘤活性,体内给药后,由于缺乏有效的保护,PA-C1b可以被蛋白酶降解。因此,研究者将其负载到MSN中,以氧化石墨烯作为封堵剂、FA作为靶向分子靶向递送至肿瘤部位后,在近红外光照射下,氧化石墨烯包裹物脱落,从而达到光控释放抗菌肽的目的,进行精准化疗[19]。
3 超声响应型MSN
高频超声可以无创穿透到组织深处,并且能被人体很好地耐受。当超声波在体内活组织中传播时,会发生热和机械效应,包括压力变化、声波流体流动、空化和局部热疗,这些效应可用于不同的医疗应用。不同于光有时间和空间限制,超声波具有时空体外控制作用,可以作为一种无创、非电离的辐射刺激,具有深入侵入人体的能力,可以通过调节频率、超声时间等9个参数来调节穿透深度。
纳米机电谐振器产生的千兆赫(GHz)频率的超音波已成功地应用于诱导脂膜、囊泡和细胞膜上的瞬态纳米孔,超音波的主要工作机制是基于声流效应,可以在亚微米尺度上直接与细胞膜耦合。Lu等[20]将负载DOX的MSN在千兆赫频率的超音波的辅助下,通过直接穿透的方式进入细胞质,发现超音波触发的千兆赫声流诱导膜缺陷,使得负载DOX的100~200 nm大小的MSN直接穿透细胞膜,而不是通过传统的内吞作用,避免了核内体的形成,大大提高了药物递送效率。由于超音波穿孔是一种瞬态、可逆和功率依赖的过程,使得负载于MSN上的DOX的递送成为一种无毒和可调的过程,可以根据需要通过控制超音波频率或持续时间来完成药物的递送。这种通过超声波增强药物传递的新方法可以使药物载体克服细胞膜和核内体的生物屏障,且不受载体材料的限制,在生物医学应用领域具有诱人的前景。
有研究者[21]开发了DOX-SiO2纳米复合材料,用于降低超声波下DOX诱导的正常细胞毒性,并通过靶向给药和可控释放提高DOX的抗肿瘤活性;而且延长超声时间可增强DOX-SiO2纳米复合材料的抗肿瘤作用,并降低其毒性。超声导向MSCNs作为一种安全有效的抗肿瘤药物递送系统具有很大的潜力,可以提高治疗效果,减少副作用。
4 负载前药的MSN
使用化疗药物时,许多生物屏障会阻止药物到达肿瘤细胞,降低治疗效果,同时引发严重的副作用。而在MSN上负载前药可以使药物选择性地在肿瘤细胞中有效积累,从而达到治疗肿瘤的目的。前药是一种经过化学修饰的化合物,对特定的药理靶点具有可忽略或较低的活性,需要在体内代谢生成具有活性的药物。
在低氧肿瘤的治疗中,采用以缺氧为导向的治疗方法来提高治疗效果。替拉帕明(Tirapazamine,TPZ)是一种低氧激活前药,在低氧微环境(低pH值、低氧压力、高还原性)中还原性地产生瞬时氧化自由基,这种DNA毒性产物可以选择性地清除缺氧的肿瘤细胞而不损害正常细胞。因此,将放射光热治疗与TPZ介导的缺氧激活治疗相结合,有望获得高效、安全的治疗效果。Wang等[22]成功制备了多功能Janus结构的金三角MSN递送平台,以递送缺氧激活的前药TPZ,FA连接的聚乙二醇为Janus纳米平台提供了肝癌靶向特性。FA-GT-MSNs@TPZ多功能药物递送系统在肝癌微环境中内化后,具有辐射敏感性和光热毒性,协同抗肿瘤作用有效杀死肝癌细胞。此外,TPZ在酸性刺激下大量释放,并在缺氧肝癌细胞中产生DNA损伤自由基,以补充放射光热治疗,是一种潜在的肝癌治疗方法。
抗有丝分裂药物秋水仙碱(colchicine,COL)是一种天然生物碱前药,具有抑制程序性死亡受体1(programmed cell death protein 1,PD-1)在T细胞表面过表达的作用。有研究者[23]利用MSN开发了一种新型的COL药物递送系统MSNsPCOL/CG-FA,MSN负载COL,并包覆叶酸壳聚糖-甘氨酸复合物,FA作为主要的靶向配体,促进细胞内吞。该药物递送系统靶向递送COL,增强了抗肿瘤作用,降低了细胞毒性,是一种利用低成本小分子天然前药开发肿瘤免疫治疗的新方法。
Ren等[24]首先合成了DOX前药(pDOX),并将其与β-CD临时组装形成pDOX-CD复合物以减少其毒副作用;然后,通过在MSN的介孔内原位合成钯纳米颗粒,构建纳米反应器,将pDOX转化为活性抗肿瘤药物。葡萄糖氧化酶催化葡萄糖氧化形成葡萄糖酸和H2O2,生成的葡萄糖酸降低了pDOX-CD复合物的pH值,从而触发pDOX-CD复合物的分解,而H2O2的产生也可杀死肿瘤细胞,从而实现协同氧化治疗。释放的pDOX被纳米钯催化转化为活性抗肿瘤药物,对肿瘤实行协同氧化/饥饿治疗。该研究提供了一种利用级联化学反应实现协同氧化/饥饿治疗,协同杀伤肿瘤细胞和抑制肿瘤生长的新策略。
生物再生Ru(Ⅲ)配合物前药可用于在还原和缺氧的微环境中实现有效的肿瘤治疗,DNA与Ru(Ⅲ)配合物前药形成稳定的Ru(Ⅲ)配合物,根据Ru(Ⅲ)金属中心的氧化还原状态原位生成取代活性更强的Ru(Ⅱ),从而促进肿瘤细胞凋亡。有研究者[25]将负载Ru(Ⅲ)配合物前药RuDPNI的MSN(Ru-MSN)与融合蛋白合成脂质体(PLip)整合构建多功能纳米药物(Ru-MSN-PLip)用于治疗非小细胞肺癌。Ru(Ⅲ)配合物前药在细胞内高GSH水平下被还原为Ru(Ⅱ)配合物,通过协同嵌入阻断DNA复制和协调剪切核DNA,导致肺癌细胞凋亡。由于基于融合蛋白的肿瘤细胞识别能力和Ru(Ⅲ)配合物前药介导的核DNA靶向性,Ru-MSN-PLip实现了顺序传递和更高的抗肿瘤活性,具有长期的血液循环和选择性,可以在肿瘤细胞中积累,抑制体内肿瘤生长,降低对正常组织的毒副作用。
5 氧化还原响应型MSN
肿瘤细胞内、外环境中的GSH浓度差异显著,肿瘤细胞溶胶、线粒体、细胞核中的GSH浓度明显高于正常细胞中的。与pH值为7.4的正常细胞相比,在肿瘤细胞外环境(pH值6.5~7.2)、核内体(pH值5.0~6.5)和溶酶体(pH值4.5~5.0)中存在微酸性环境。GSH可以破坏二硫键,基于二硫键的氧化还原电位有望成为控制药物释放的理想刺激,目前已设计出多种对氧化还原电位敏感的纳米阀。Luo等[26]用明胶(GTn,一种MMP-2可裂解的天然聚合物)修饰MSN,GTn壳与含二硫化物的N,N-双(丙烯酰)胱胺原位反应,制备了氧化还原电位响应的药物递送系统;GTn大分子上氨基的质子化性质及MMP-2可裂解性为药物递送系统提供了pH/氧化还原电位/酶响应性刺激;纳米载体可被A549细胞(一种致癌的人类肺泡基底上皮细胞系)有效吸收,实现了DOX在A549细胞内的高积累,具有更高的抗肿瘤细胞毒性。
石墨烯量子点(graphene quantum dots,GQDs)作为一种新型荧光材料,因优异的生物相容性、低细胞毒性、强近红外吸收、高光热转换效率、优良导热性而被广泛应用于药物递送等生物医学领域。GQDs可作为MSN介孔开关,所制备的药物递送系统可在氧化还原电位刺激下实现靶向释放药物。有研究者[27]利用GQDs覆盖MSN,制备得到一种新型光热氧化还原响应型药物递送系统,其对GSH具有显著的氧化还原响应,可实现光热氧化还原可控释药。
牛血清白蛋白(bovine serum albumin,BSA)含有天然二硫键及丰富的氨基和羧基,可与其它材料结合构建具有氧化还原响应的新型药物载体。Zhang等[28]成功制备了一种BSA和FA有序修饰的单分散MSN靶向载体,用于靶向递送抗肿瘤药物表柔比星(Epirubicin,EPI)。在BSA涂层被GSH生物降解之前,可以防止EPI过早释放;抵达肿瘤部位后,在GSH作用下,分子内二硫键断裂,易生物降解的EPI/MSN-FA的氧化还原反应性使EPI释放显著加快;氧化还原触发释放实现了EPI在靶向肿瘤微环境中的快速扩散。MSN与具有刺激响应型生物降解性的蛋白质分子相结合的策略为肿瘤精准化疗的按需药物释放提供了新的方向。
人H链亚铁蛋白(human H subunit ferritin,HFn)已被证明与在许多肿瘤中过度表达的转铁蛋白受体1 (transferrin receptor 1,TfR1)结合后具有很强的靶向肿瘤的能力以及较高的敏感性和特异性。有研究者[29]设计并制备了具有氧化还原响应或pH响应纳米阀的MSN,用HFn作为介孔封堵剂和肿瘤细胞靶向基团,定向递送和控释DOX。HFn通过二硫键与单分散MSN结合,HFn在单硅微球上合成了基于二硫键的氧化还原响应纳米阀,纳米阀可以通过二硫键的还原自动激活,当暴露肿瘤细胞中GSH的浓度较高时,导致HFn分解和DOX释放。HFn靶向TfR1能力在杀伤肿瘤细胞过程中起着重要作用,当TfR1被其抗体阻断时,纳米颗粒的摄取和细胞杀伤效果则显著降低。体内抗肿瘤效果评价显示包覆HFn和负载DOX的MSN具有良好的靶向治疗效果。
在肿瘤细胞的线粒体中,高浓度的超氧化物歧化酶会导致细胞中H2O2过量。在化学动力疗法中,利用纳米材料精确催化H2O2与Fe2+的反应(Fenton反应),从而产生具有细胞毒性的羟基自由基(·OH)来杀死肿瘤细胞。Jia等[30]将具有合适尺寸和均匀性的纳米Fe3O4包覆在MSN和聚多巴胺上,聚多巴胺的还原性能使Fe3+还原为Fe2+,促进·OH的产生,从而杀死肿瘤细胞。独特的核壳结构不仅提高了磁性纳米材料的载药量,而且获得较高的光热转换效率,为未来肿瘤的化学动力治疗提供了新思路。
6 肿瘤靶向型MSN
在传统化疗中,大多数抗肿瘤药物只有部分通过循环到达肿瘤部位,导致药物的生物利用度较低,对肿瘤细胞的选择性较差,增加了发生严重不良反应和耐药性的风险。靶向型载药纳米颗粒能够成功跨越生理屏障到达靶点,最终通过可控释放,显著提高局部药物浓度,减轻对正常细胞的损伤。
适配体是一种单链DNA或RNA,作为化学抗体与靶标特异性紧密结合。适配体体积小,易于制备和修饰,能很好地穿透组织,具有较低的毒性和免疫原性,被广泛应用于肿瘤检测和靶向化疗。适配体Sgc8可以与人急性T淋巴细胞白血病细胞(human acute T lymphatic leukemia cells,CEM)特异性结合,识别CEM细胞膜上的蛋白酪氨酸激酶-7(protein tyrosine kinase-7,PTK-7),在化疗药物和纳米材料中引入Sgc8可以提高对白血病细胞的靶向性和杀伤能力。Yang等[31]设计了一种Sgc8适配体修饰的MSN(Sgc8-MSN),用于检测白血病细胞,具有较高的敏感性和特异性,不仅用于白血病的诊断,而且用于靶向递送抗白血病药物,为白血病靶向治疗提供了思路。
为了克服肿瘤细胞耐药性,BCL-2和MCL-1抗凋亡蛋白的抑制剂已被开发出来,例如ABT-263(即Navitoclax)抑制BCL-2、S63845特异性抑制MCL-1。跨膜糖蛋白1(mucin-1,MUC1)属于粘蛋白家族,在70%的乳腺癌细胞中异常过表达,是乳腺癌重要的分子靶点。Vivo-Llorca等[32]制备了载有Navitoclax和S63845的MSN,并用在三阴性乳腺癌(triple negative breast cancer,TNBC)中过表达的MUC1表面蛋白的适配体(apMUC1)覆盖,可以有效地靶向TNBC细胞并成功诱导凋亡,该药物递送系统提高了抗肿瘤活性和对TNBC细胞的有效靶向性。Siminzar等[33]以超顺磁性氧化铁纳米颗粒(superparamagnetic iron oxide nanoparticle,SPION)为核、MSN为载体负载DOX,修饰上MUC1适配体作为靶向识别功能团,制备了DOX-SPION@MSN-MUC1药物递送系统,可以靶向乳腺癌细胞。该药物递送系统大小为27 nm,带负电荷,在酸性环境下药物释放量明显增加,对MCF-7细胞具有更高的靶向性和细胞毒性。
有研究者[34]通过核酸适配体AS1411和腺苷三磷酸(adenosine triphosphate,ATP)组成的二价适配体分别靶向和门控一个双功能分子梯状结构的MSN,AS1411可以将MSN药物递送系统靶向到目标位置,ATP在药物渗透到细胞质后打开MSN介孔并释放药物,确保DOX进入肿瘤细胞。研究表明,该药物递送系统在肿瘤部位有明显聚集,并持续释放药物,对诱导肿瘤细胞凋亡和抑制肿瘤生长有显著作用,对正常细胞和组织则无明显副作用。
由于各向异性的特点,Janus纳米颗粒可以被修饰成多功能配体,并应用于细胞靶向、多重成像等生物医学领域。Liu等[35]分别用HA和2,3-二甲基马来酸酐(DMMA)修饰氨基化MSN的两侧,得到双功能化Janus纳米颗粒(HA-JMSN/DOX-DMMA)。Janus纳米颗粒进入肿瘤细胞后,在弱酸性微环境下,Zeta电位由负变为正;纳米颗粒由于电荷相互吸引靠近肿瘤细胞,纳米颗粒上的HA配体与肿瘤细胞上的CD44结合,导致纳米颗粒被肿瘤细胞吞噬;在肿瘤细胞内,由于pH响应,DOX从MSN中迅速释放,实现靶向治疗。该药物递送系统通过主动靶向和电荷逆转,提高了药物递送效率和肿瘤治疗效果。
Ding等[36]将水溶性羧甲基几丁质(carboxy methyl chitin,CMCH)用ROS可裂解的巯基缩酮(thiol ketal,TK)键合在MSN上,并进一步表面修饰葡萄糖调节蛋白78结合肽,制备了一种新的药物递送系统,靶向递送DOX和α-生育酚琥珀酸(α-TOS)。该药物递送系统具有pH/ROS双重响应,释放的α-TOS增加了细胞内ROS的浓度,从而诱导TK键断裂,加速DOX的释放;该药物递送系统可以靶向4T1细胞,在体内抑制4T1荷瘤BALB/c小鼠的肿瘤生长,且副作用较低,具有有效的抗肿瘤作用,是一种很有前景的化疗药物递送系统。
碳酸酐酶9(carbonic anhydrase Ⅸ,CAⅨ)作为膜相关碳酸酐酶家族的特殊成员,在实体肿瘤中高表达,可作为靶标。Chen等[37]以MSN为载体负载DOX,通过二硫键将CAⅨ接枝在MSN上,构建了一种新型靶向氧化还原响应型药物递送系统DOX@MSN-CAⅨ。在体外实验中,由于CAⅨ抗体的靶向性,MSN-CAⅨ能显著促进CAⅨ阳性肿瘤细胞的内化;在体内,DOX@MSN-CAⅨ可以递送特异性抗肿瘤药物,能更有效地抑制肿瘤生长,是一种很有前途的靶向肿瘤药物递送系统。
7 结语
基于MSN构建的药物递送系统在实验室已成功用于抗肿瘤药物的递送,在肿瘤临床治疗方面具有巨大的应用潜力。但这些研究仍处于早期开发阶段,许多药物递送系统也仅仅是开展了小动物试验,在尝试临床应用时,还会遇到很多困难。实现药物递送系统的可重复大规模生产是至关重要的一步,在更复杂的动物模型上进一步开展验证也是必经之路。在临床试验中,给药途径、药物代谢机理、病理和毒理等都需要进行更广泛的研究,实现药物递送系统临床应用任重道远。
