体外双分子荧光蛋白检测化学交联剂的研究
2021-08-26曹雪松
王 菲,滕 霄,曹雪松
(聊城大学生命科学学院,山东 聊城 252000)
蛋白质是生命活动最重要的功能分子,蛋白质之间特定的相互作用构成了细胞内生物化学反应网络的重要组成部分,研究蛋白质相互作用机理可以加深我们对生命科学的认识。目前对蛋白质相互作用的研究技术主要有酵母双杂技术、双分子荧光互补技术(BiFc)、免疫共沉淀技术(Co-IP)、噬菌体展示技术、荧光能量转移技术(FRET)、pull-down技术等[1-8]。蛋白质相互作用发生在有活性的蛋白质与蛋白质、蛋白质与蛋白质亚基之间,很多是瞬时作用,而且失活蛋白质或错误折叠蛋白质往往会失去原有的与特定蛋白质相互作用的能力,这是蛋白质相互作用研究面临的难题。
蛋白质交联技术可以通过化学物质修饰蛋白质使其对特定位点或特定类型的位点具有亲和力[9],从而建立牢固的蛋白质相互作用复合体,有效解决了上述难题[10]。蛋白质交联是指通过一定的化学试剂或催化剂,或将蛋白质与其它物质结合在一起,达到改善蛋白质功能性质的目的,交联过程中,共价键的形成可能伴随着消去部分基团,也可能伴随着附加部分基团[11]。目前常用的化学交联剂分为四类:第一类,与伯胺基团反应的交联剂(如N-羟基琥珀酰亚胺),被广泛用于与赖氨酸残基上的N端和ε-氨基形成稳定的共价键,具有较高的反应效率[12-13];第二类,巯基反应交联剂,可以通过烷基化(卤乙酰基)或二硫键交换(马来酰亚胺、吡啶二硫醇)修饰目标蛋白质上的巯基[14];第三类,可将蛋白质C端羧基与天冬氨酸、谷氨酸侧链羧基交联(如甲醛、戊二醛)[15-16];第四类,通过紫外光激活形成交联的光反应性交联剂(二叠氮类、芳基叠氮类),其优点在于可以通过控制光源的时间和强度来调节反应强弱[17-18]。
对于蛋白质交联反应中化学交联剂的选择一般通过交联效率进行筛选,而交联效率的评估方法目前主要采用SDS-PAGE法与HPLC-MS法。SDS-PAGE法耗时较长,而HPLC-MS法所需仪器设备非常昂贵。鉴于此,作者分别以戊二醛和甲醛为交联剂,以Ni NTA Beads为固体介质,将红色荧光蛋白(mCherry)和高可溶性绿色荧光蛋白(soluble GFP, sGFP)进行交联反应,通过激光共聚焦显微镜观察固体介质上双荧光强弱来判断交联效果并对交联效率进行评估,以期开发一种快速、简便、高通量的体外初步筛选化学交联剂的新方法[19-21]。
1 实验
1.1 试剂与仪器
pET29b(+)、3%戊二醛溶液,自行保存;Ni NTA Beads,北京博奥龙免疫技术公司;凝血酶(thrombin),北京百奥莱博科技有限公司;限制性内切酶SalⅠ、BamHⅠ,赛默飞世尔科技(中国)有限公司;LA Taq DNA聚合酶、T4 DNA连接酶,宝生物工程(大连)有限公司;37%甲醛,西陇科学有限公司;质粒小提试剂盒,天根生化(北京)有限公司;胶回收试剂盒,GenStar-康润公司;Bradford蛋白浓度测定试剂盒,碧云天生物技术有限公司。
SBH130D型恒温水浴锅,Stuart公司;3500R型凝胶成像仪,上海天能科技有限公司;AR2140型电子分析天平,奥豪斯国际贸易(上海)有限公司;Centrifuge 5810R型高速离心机,Eppendorf公司;JY92-2D型超声波细胞粉碎机,宁波新芝生物科技股份有限公司;杂交仪,Stovall Life Science;LB 985型植物活体影像仪,Berthold公司;FV1200型激光共聚焦显微镜,Olympus公司。
1.2 pET29b(+)-mCherry和pET29b(+)-sGFP重组质粒的构建
上游引物F:5′-TATAGGATCCGATGGTGAGCAAGGGCGAG-3′;下游引物R:5′-GCGCGTCGACCTGTACAGCTCGTCCAT-3′。在上游引物和下游引物中分别加上限制性内切酶BamHⅠ和SalⅠ酶切位点,mCherry片段扩增,BamHⅠ和SalⅠ酶切,然后连接至经BamHⅠ和SalⅠ酶切后的pET29b(+)载体上,得到重组质粒pET29b(+)-mCherry(在C端带有His6标签),将其转化至DH5α感受态细胞,提取得到大量重组质粒。
同法构建pET29b(+)-sGFP重组质粒。
1.3 pET29b(+)-mCherry和pET29b(+)-sGFP的原核表达与纯化
将pET29b(+)-mCherry、pET29b(+)-sGFP分别转化至BL21(DE3)菌株中,复苏扩培至OD600值为0.4~0.6,加入诱导剂IPTG至终浓度为100 μmol·L-1,18 ℃诱导16 h后,收集菌体,加入5 mL非变性裂解液,溶菌酶终浓度为1 mg·mL-1,200 W超声波破碎(工作40 s、间歇20 s)。
使用Ni NTA Beads对mCherry蛋白进行过柱纯化。
sGFP蛋白的去标签化:取破碎离心后的上清液,按4∶1的比例加入Ni NTA Beads进行孵育,待两者充分混合后,离心收集Ni NTA Beads;用Wash Buffer洗涤5次,加入1 mL PBS缓冲溶液(pH值7.4)重悬Ni NTA Beads;加入凝血酶至工作浓度为4 U·mL-1,于37 ℃酶切16 h,去除sGFP蛋白所携带的His6标签。
1.4 等比例双分子荧光蛋白的交联
戊二醛为交联剂:采用Bradford法测定mCherry蛋白溶液浓度和sGFP蛋白溶液浓度;按等比例(摩尔浓度比,下同)混合mCherry蛋白溶液与sGFP蛋白溶液,总体积80 μL,移入1.5 mL EP管中;加入适量3%戊二醛溶液,至交联浓度分别为0.1%、0.5%、1.0%、1.5%、2.0%,每个浓度做3个平行,37 ℃交联30 min;通过称取EP空管质量、混合均匀Ni NTA Beads的方式等量加入30 μL Ni NTA Beads,旋转孵育30 min。
甲醛为交联剂:按上述方法将2种蛋白溶液混合,加入适量37%甲醛溶液,至交联浓度分别为0.1%、0.5%、1.0%、1.5%、2.0%、2.5%,每个浓度做3个平行,室温交联30 min;通过称取EP空管质量、混合均匀Ni NTA Beads的方式等量加入30 μL Ni NTA Beads,旋转孵育30 min。
对照组:按上述方法将2种蛋白溶液混合,不加交联剂,加入等量Ni NTA Beads,其余条件均相同。
1.5 交联浓度的选择
交联结束后,5 000 r·min-1离心3 min,最大程度取出全部上清液,离心后的Ni NTA Beads加入30 μL PBS缓冲溶液保存。戊二醛交联样品,每个交联浓度取100 μL上清液加入96孔板中,不足100 μL的用1% NaCl补足;甲醛交联样品,每个交联浓度取60 μL上清液加入96孔板中。利用植物影像仪(参数设置为exposure time:1 s,read:low,gain:high)检测上清液中剩余sGFP的荧光强度,用Indigo软件(2.0.5.0版)对采集图片中显示均匀大小的区域进行平均荧光强度计算,最终确定最佳交联浓度。
1.6 荧光直观化检测交联效果
充分悬浮Ni NTA Beads,取5 μL置于载玻片上,用激光共聚焦显微镜(激发波长分别为 488 nm和594 nm,光电倍增管电压PMT(HV)420 V,激光器透过率(gain)5×,降噪调整offset为50%,其余参数默认)观察,利用Cellsens Standard软件进行荧光Ni NTA Beads数目统计及交联效率计算,每个结果重复统计3次,四舍五入保留整数值。
1.7 SDS-PAGE检测交联效果
配制12%分离胶10 mL(ddH2O 3.3 mL,30%聚丙烯酰胺储备胶4.0 mL,pH值8.8的1.5 mol·L-1Tris 2.5 mL,10%SDS 0.1 mL,10%过硫酸铵0.1 mL,TEMED 0.004 mL)、5%浓缩胶4 mL(ddH2O 2.7 mL,30%聚丙烯酰胺储备胶0.67 mL,pH值8.8的1.5 mol·L-1Tris 0.5 mL,10%SDS 0.04 mL,10%过硫酸铵0.04 mL,TEMED 0.004 mL)。按1.4方法制备交联样品,每个戊二醛交联样品取出32 μL,加入8 μL的5×loading buffer,漩涡振荡20 s,65 ℃煮样5 min,5 000 r·min-1离心1 min,上样量18 μL,120 V电泳1.5 h,考马斯亮蓝染色10 min,脱色3 h,检测戊二醛交联效果。
同法检测甲醛交联效果。
1.8 微量非等比例双分子荧光蛋白的交联
定量sGFP与不同浓度的mCherry经戊二醛交联:测定2种蛋白溶液浓度后,取sGFP蛋白溶液1 μL,分别按1∶3、1∶9、1∶15、1∶21、1∶27的比例加入2 μL、6 μL、10 μL、15 μL、18 μL的mCherry蛋白溶液,交联浓度为1.0%,37 ℃交联30 min,将交联样品与20 μL的Ni NTA Beads旋转孵育30 min,用激光共聚焦显微镜观察交联效果(参数设置为光电倍增管电压PMT(HV)560 V,激光器透过率(gain)5×,降噪调整offset为50%,其余参数默认),利用Cellsens Standard软件进行荧光Ni NTA Beads数目统计及交联效率计算。
定量mCherry与不同浓度的sGFP经戊二醛交联:取mCherry蛋白溶液1 μL,分别按1∶3、1∶9、1∶15、1∶21、1∶27的比例加入4 μL、13 μL、21 μL、30 μL、39 μL的sGFP蛋白溶液,按上述方法检测交联效果。
使用甲醛作为交联剂,交联浓度为1.5%,同法检测微量非等比例双分子荧光蛋白的交联效果。
2 结果与讨论
2.1 pET29b(+)-mCherry重组质粒的构建与鉴定
以p1305N-U6-2×Sap I-MG质粒为模板扩增目的基因mCherry,利用引物进行PCR扩增,获得带有BamHⅠ、SalⅠ的酶切位点片段,目的片段长度为715 bp,与目标条带大小一致(图1a)。利用BamHⅠ、SalⅠ酶切位点将mCherry片段克隆到pET29b(+)载体中,转化至DH5α感受态细胞,菌落PCR扩增结果显示存在阳性克隆(图1b)。菌落PCR扩增后,提取质粒,用BamHⅠ、SalⅠ双酶切进行鉴定(图1c),得到715 bp目的基因片段mCherry。
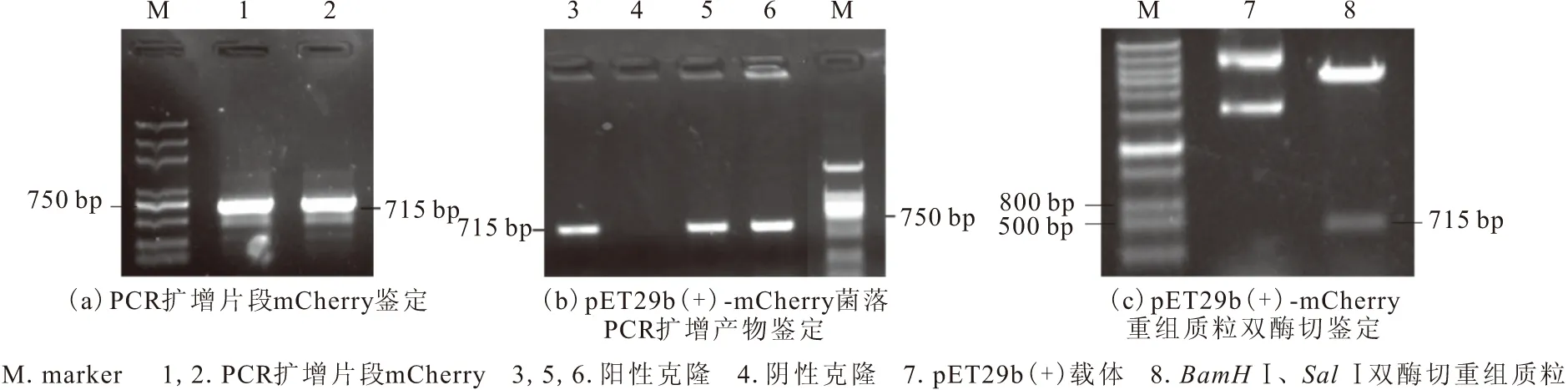
图1 pET29b(+)-mCherry重组质粒的构建与鉴定Fig.1 Construction and identification of pET29b(+)-mCherry recombinant plasmid
2.2 pET29b(+)-mCherry和pET29b(+)-sGFP的原核表达与纯化
分别将重组质粒pET29b(+)-mCherry和pET29b(+)-sGFP转化至BL21(DE3)中,加入IPTG诱导目的蛋白表达。经SDS-PAGE检测,与未诱导对照组相比,在30 kDa处出现mCherry(图2a)和sGFP(图2c)条带,与预期蛋白相对分子量(28 kDa)位置基本一致,表明诱导表达成功。采用Ni NTA Beads纯化2种荧光蛋白,进行SDS-PAGE检测,结果显示,在相对分子量30 kDa处出现明显目的条带mCherry(图2b)和sGFP(图2d),且基本无其它杂带。

图2 mCherry和sGFP荧光蛋白的诱导、表达与纯化Fig.2 Induction,expression,and purification of mCherry and sGFP
2.3 双分子荧光蛋白的交联
2.3.1 mCherry和sGFP蛋白的浓度测定
分别以戊二醛和甲醛为交联剂,对mCherry蛋白和sGFP蛋白进行交联。采用Bradford法,测定595 nm处吸光度,绘制BSA标准曲线(图3)。计算得到以戊二醛为交联剂时mCherry蛋白溶液浓度为1.537 mg·mL-1,sGFP蛋白溶液浓度为1.068 mg·mL-1;以甲醛为交联剂时mCherry蛋白溶液浓度为0.932 6 mg·mL-1,sGFP蛋白溶液浓度为0.935 8 mg·mL-1。
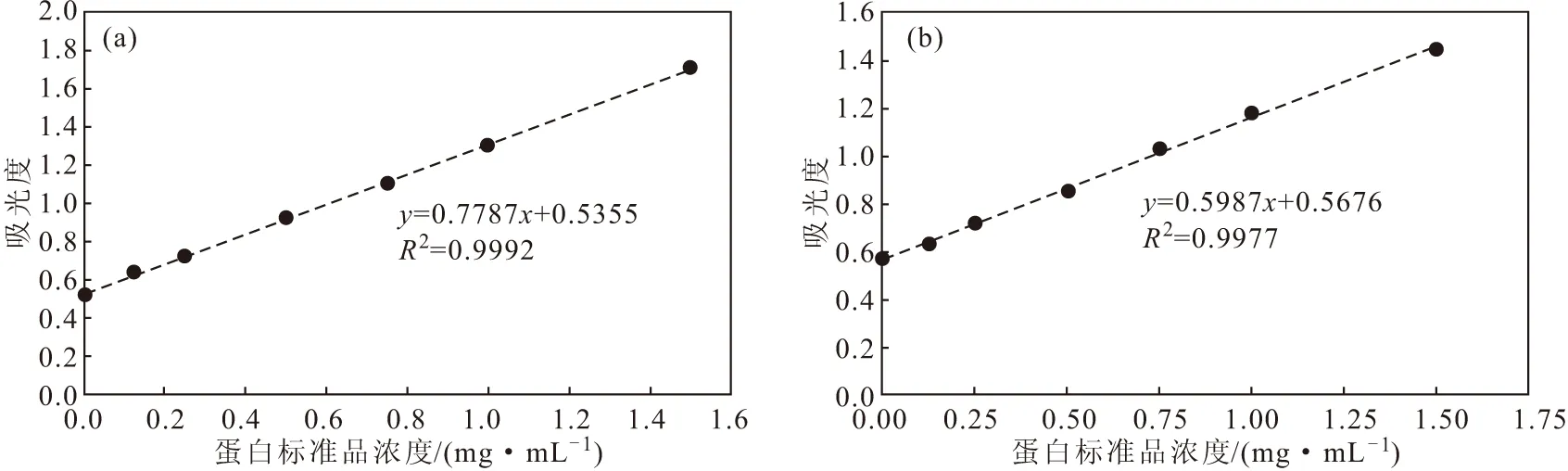
图3 以戊二醛(a)和甲醛(b)为交联剂时,测定蛋白浓度的BSA标准曲线Fig.3 BSA standard curves for detection of protein concentration in cross-linking experiments with glutaraldehyde(a) and formaldehyde(b) as cross-linking agents
2.3.2 最佳交联浓度的选择
在483 nm激发波长下,检测不同交联浓度的戊二醛交联样品溶液和甲醛交联样品溶液中剩余sGFP的荧光强度,结果如图4所示。
对于戊二醛交联样品溶液,植物影像检测结果(图4a)显示,交联浓度为1.0%、1.5%、2.0%的样品溶液中剩余sGFP的荧光强度低于交联浓度为0.1%、0.5%的(荧光强度由强到弱表现为赤橙黄绿青蓝紫);荧光强度彩色立体图(图4b)显示,交联浓度为1.0%的样品溶液中剩余sGFP的荧光强度低于交联浓度为0.1%、0.5%、1.5%、2.0%的;5种交联浓度的戊二醛交联样品溶液3次平均荧光强度统计结果(图4c)显示,交联浓度为1.0%的样品溶液与Ni NTA Beads 孵育吸附后,剩余sGFP的平均荧光强度处于最低值。

图4 不同交联浓度的戊二醛交联样品溶液(a~c)和甲醛交联样品溶液(d~f)中剩余sGFP的荧光强度Fig.4 Fluorescence intensity of residual sGFP in cross-linking sample solution with different cross-linking concentrations by using glutaraldehyde(a-c) and formaldehyde(d-f) as cross-linking agents
对于甲醛交联样品溶液,植物影像检测结果(图4d)显示,交联浓度为1.5%、2.0%的样品溶液中剩余sGFP的荧光强度低于交联浓度为0.1%、0.5%、1.0%、2.5%的;荧光强度彩色立体图(图4e)显示,交联浓度为1.5%、2.0%的样品溶液中剩余sGFP的荧光强度低于交联浓度为0.1%、0.5%、1.0%、2.5%的;6种交联浓度的甲醛交联样品溶液3次平均荧光强度统计结果(图4f)显示,交联浓度为1.5%的样品溶液与Ni NTA Beads孵育吸附后,剩余sGFP的平均荧光强度处于最低值。
2.3.3 荧光直观化检测交联效果
分别取5 μL全新Ni NTA Beads、5 μL未加入交联剂的阴性对照样品、5种交联浓度的戊二醛交联样品溶液、6种交联浓度的甲醛交联样品溶液,用激光共聚焦显微镜(激发波长分别为594 nm、488 nm)观察,结果如图5所示。
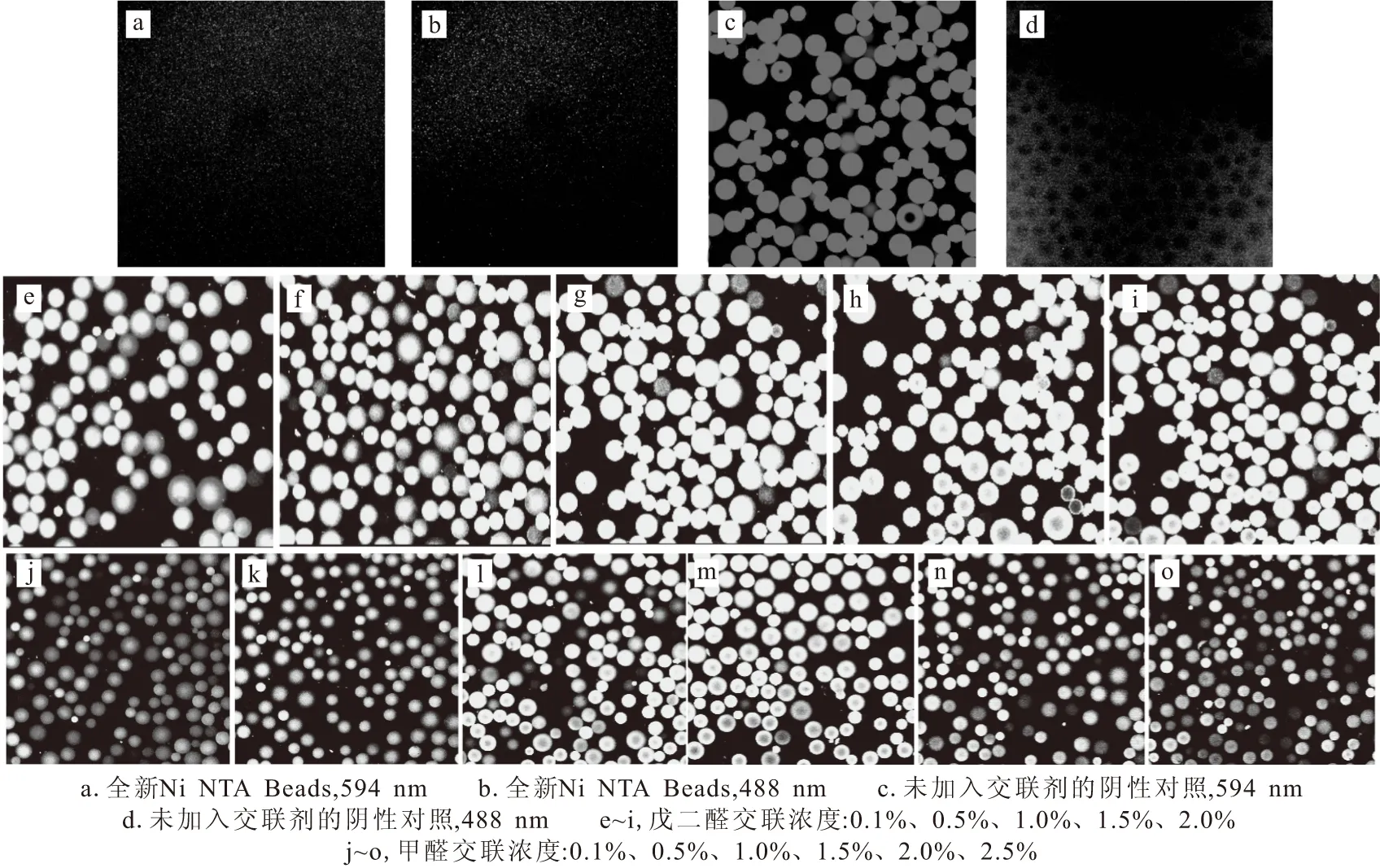
图5 激光共聚焦显微镜观察结果Fig.5 Results of visual observation by laser confocal microscope
由图5可以看出,全新的Ni NTA Beads不呈现荧光(图5a、5b)。而未加入交联剂的阴性对照样品在594 nm激发波长下,Ni NTA Beads呈现红色荧光(图5c),表明带有His6标签的mCherry已经与Ni NTA Beads结合;未加入交联剂的阴性对照样品在488 nm激发波长下,并未呈现绿色荧光(图5d),表明去除标签后的sGFP不再与Ni NTA Beads结合。5种交联浓度的戊二醛交联样品在594 nm、488 nm激发波长下,Ni NTA Beads均呈现双荧光(黄色)(图5e~i),表明5种戊二醛交联样品均发生mCherry和sGFP的交联反应;并且随着交联浓度的增加,呈现红色荧光的Ni NTA Beads数目减少,呈现双荧光的Ni NTA Beads数目增多。6种交联浓度的甲醛交联样品在594 nm、488 nm激发波长下,Ni NTA Beads均呈现双荧光(黄色)(图5j~o),且当交联浓度大于0.5%后,呈现双荧光Ni NTA Beads数目显著增多(图5k),表明交联浓度较高的甲醛交联样品的交联效果较好。在较低交联浓度下,戊二醛交联样品和甲醛交联样品Ni NTA Beads均可以呈现双荧光(黄色),表明,即使在较低交联浓度下,2种交联剂也可以使2种荧光蛋白发生交联。
利用Cellsens Standard软件对激光共聚焦显微镜观察结果进行分析,统计视野下Ni NTA Beads的总数以及呈现双荧光的数目,并计算双荧光Ni NTA Beads的占比,结果见表1。
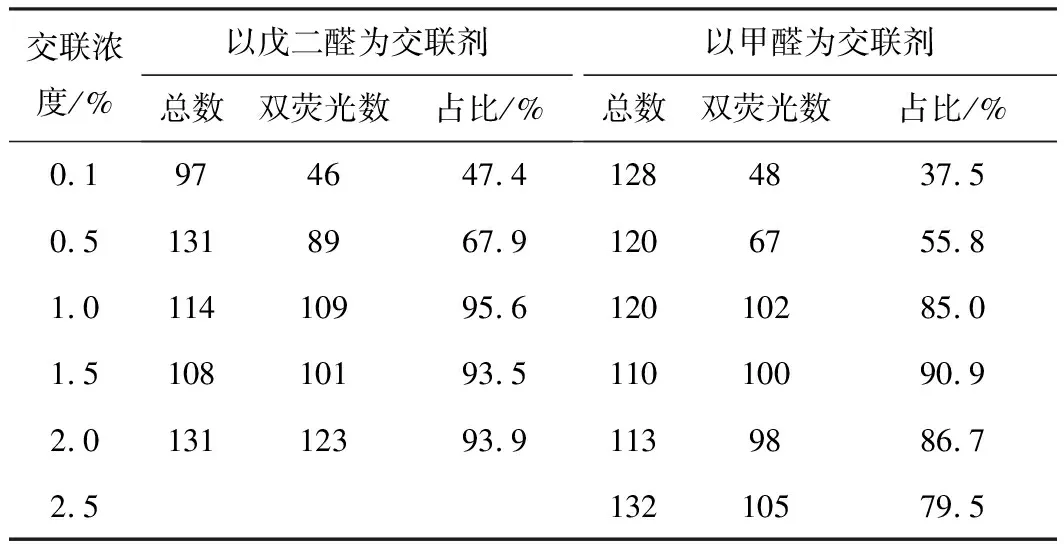
表1 不同交联浓度下,视野下Ni NTA Beads的总数、双荧光数以及双荧光Ni NTA Beads的占比
由表1可知,以戊二醛为交联剂时,0.1%、0.5%、1.0%、1.5%、2.0%交联浓度下戊二醛交联样品中呈现双荧光Ni NTA Beads的占比分别为47.4%、67.9%、95.6%、93.5%、93.9%;交联浓度为1.0%、1.5%、2.0%时的交联效果明显优于交联浓度为0.5%、0.1%时的,其中交联浓度为1.0%时的交联效果最好,交联效率最高。因此,后续实验以戊二醛为交联剂时,选择交联浓度为1.0%进行交联。以甲醛为交联剂时,0.1%、0.5%、1.0%、1.5%、2.0%、2.5%交联浓度下甲醛交联样品中呈现双荧光Ni NTA Beads的占比分别为37.5%、55.8%、85.0%、90.9%、86.7%、79.5%;交联浓度为1.5%时的交联效果最好,交联效率最高。因此,后续实验以甲醛为交联剂时,选择交联浓度为1.5%进行交联。
2.3.4 SDS-PAGE检测交联效果
采用SDS-PAGE检测不同交联浓度的戊二醛交联样品溶液和甲醛交联样品溶液的交联效果,结果如图6所示。
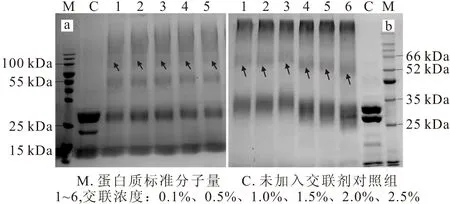
图6 SDS-PAGE检测不同交联浓度的戊二醛交联样品溶液(a)和甲醛交联样品溶液(b)Fig.6 SDS-PAGE of cross-linking sample solution with different cross-linking concentrations by using glutaraldehyde(a) and formaldehyde(b) as cross-linking agents
由图6a可以看出,与对照组相比,5种不同交联浓度的戊二醛交联样品溶液均在55 kDa处显示明显特异条带,证明戊二醛已经促使溶液中的2种荧光蛋白发生交联;此外,在100 kDa处存在特异条带(图6a中箭头处),这可能是因为戊二醛引起多个荧光蛋白发生交联而产生的。由图6b可以看出,与对照组相比,6种不同交联浓度的甲醛交联样品溶液均在52 kDa处附近出现特异条带(图6b中箭头处),证明甲醛已经促使溶液中的2种荧光蛋白发生交联。以上结果表明,即使在较低交联浓度下,2种交联剂也可以使荧光蛋白发生交联,与激光共聚焦显微镜观察结果一致。
2.3.5 微量非等比例双分子荧光蛋白交联效果检测
为了研究荧光蛋白溶液在微量非等比例下的交联,并进一步通过激光共聚焦显微镜观察、交联效率统计、Cellsens Standard软件分析、Ni NTA Beads数目统计以及双荧光Ni NTA Beads占比计算手段检测交联剂是否发挥作用的灵敏性,将一种荧光蛋白溶液加入量设计为1 μL,另一种荧光蛋白溶液加入量按照一定比例加入,分别以戊二醛和甲醛为交联剂进行交联,其激光共聚焦显微镜观察结果如图7所示。
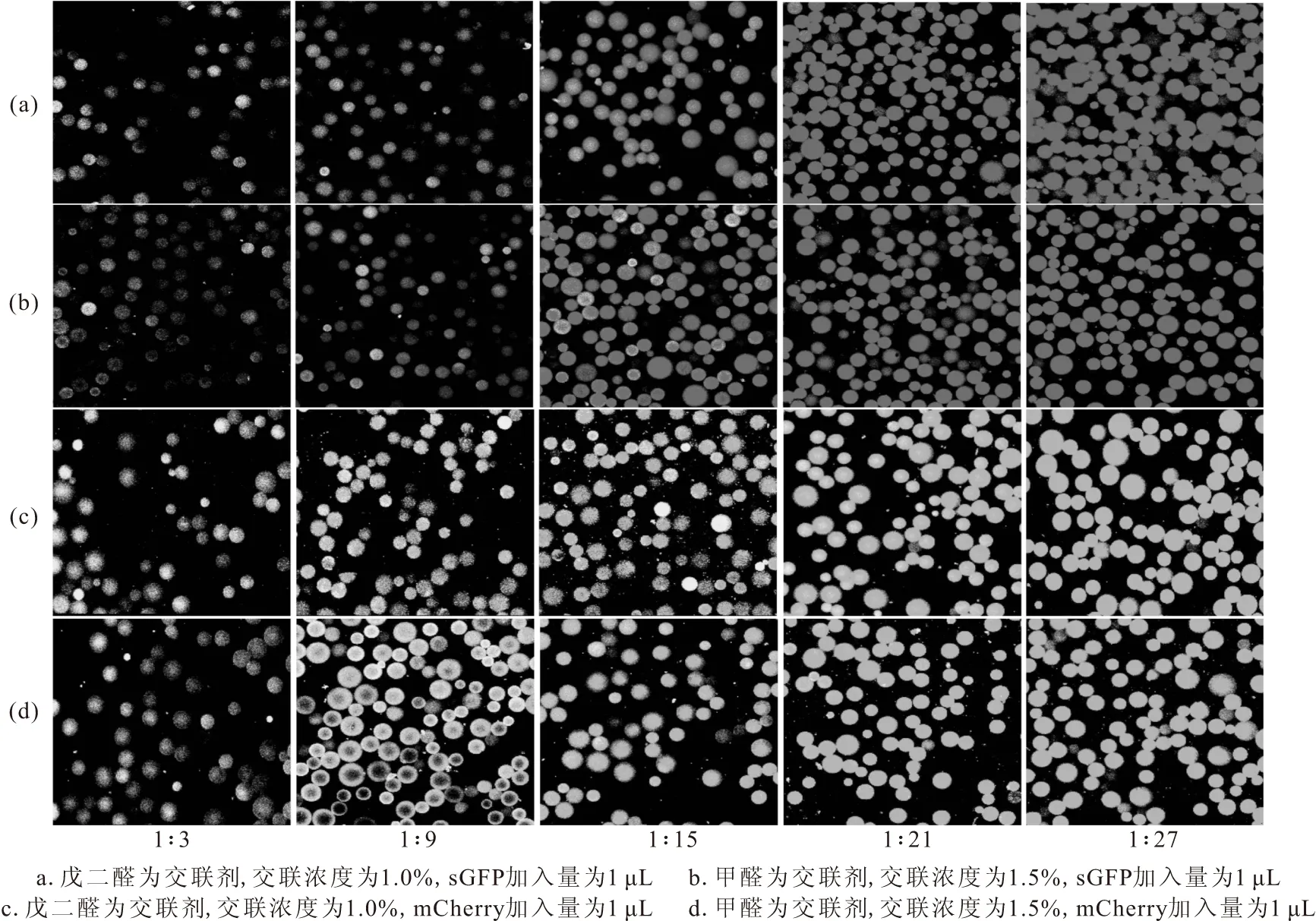
图7 激光共聚焦显微镜观察微量非等比例双分子荧光蛋白交联效果Fig.7 Visual observation of cross-linking effect of trace bimolecular fluorescent protein with non proportional concentrations by laser confocal microscope
由图7a可以看出,以戊二醛为交联剂,在sGFP蛋白溶液和mCherry蛋白溶液的比例为1∶3、总体积为4 μL的情况下,检测到呈现双荧光(黄色)的Ni NTA Beads,证明交联已经发生;随着mCherry蛋白溶液浓度的增加,呈现红色荧光的Ni NTA Beads数目不断增多,并逐渐覆盖被交联的sGFP所发出的绿色荧光。
由图7b可以看出,以甲醛为交联剂时的荧光变化趋势与以戊二醛为交联剂时(图7a)相似,在sGFP蛋白溶液和mCherry蛋白溶液的比例为1∶3、1∶9、1∶15的情况下,检测到呈现双荧光(黄色)的Ni NTA Beads,证明交联已经发生;但随着mCherry蛋白溶液浓度的继续增加,无法检测到呈现双荧光(黄色)的Ni NTA Beads。
由图7c可以看出,以戊二醛为交联剂,mCherry蛋白溶液加入量为1 μL,随着sGFP蛋白溶液浓度的增加,呈现双荧光(黄色)的Ni NTA Beads数目逐渐减少,Ni NTA Beads上激发发出的绿色荧光显著增强。
由图7d可以看出,以甲醛为交联剂时的荧光变化趋势与以戊二醛为交联剂时(图7c)相似,随着sGFP蛋白溶液浓度的增加,呈现双荧光(黄色)的Ni NTA Beads数目逐渐减少,Ni NTA Beads上激发发出的绿色荧光显著增强。
利用Cellsens Standard软件对激光共聚焦显微镜观察结果进行分析,统计视野下Ni NTA Beads的总数以及呈现双荧光的数目,并计算双荧光Ni NTA Beads的占比,结果见表2。
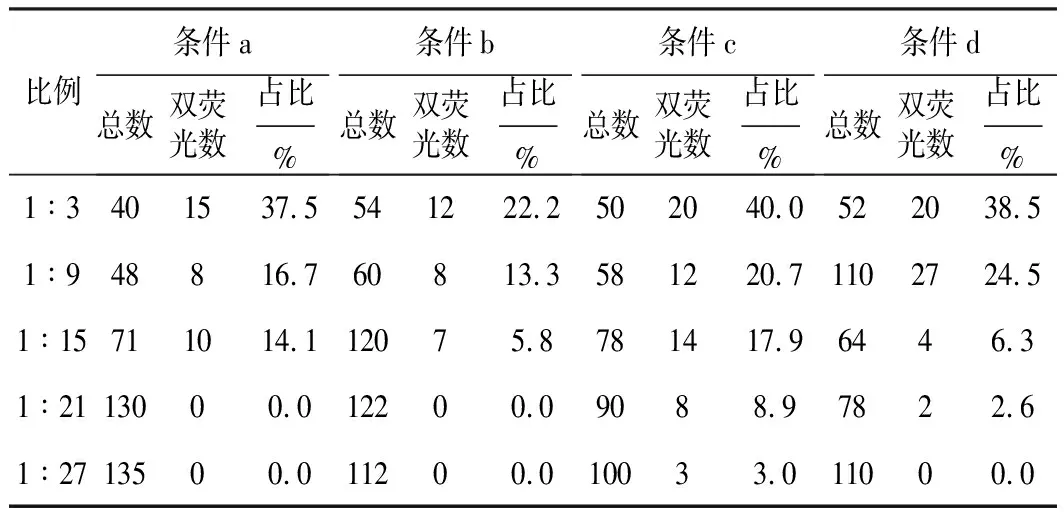
表2 微量非等比例条件下,视野下Ni NTA Beads的总数、双荧光数以及双荧光Ni NTA Beads的占比
由表2可知,在条件a下,呈现双荧光(黄色)的Ni NTA Beads占比从最高的37.5%逐渐降低,到1∶21时已经无法检测出sGFP发出的绿色荧光,整体表现为双荧光的Ni NTA Beads占比随mCherry浓度的增加而降低。在条件c下,呈现双荧光(黄色)的Ni NTA Beads占比由1∶3时的40.0%降至1∶27时的3.0%。表明,采用本技术检测交联剂在荧光蛋白质交联中的作用具有较好的灵敏性与稳定性,为利用该技术筛选其它化学交联剂提供了证据支持。
2.4 讨论
本研究利用红色荧光蛋白mCherry和高可溶性绿色荧光蛋白sGFP,通过His6标签与Ni NTA Beads吸附结合,基于mCherry和sGFP荧光蛋白交联样品在594 nm和488 nm激发波长下,固体介质Ni NTA Beads会呈现双荧光即黄色荧光的特性,设计开发了激光共聚焦显微镜观察、交联效率评估技术体外检测蛋白质交联反应中的化学交联剂。相较于SDS-PAGE传统检测手段,可实现简便、快速、高效地在体外筛选化学交联剂。
本研究成功克隆带有His6的mCherry基因原核表达重组质粒,并对mCherry和sGFP两种荧光蛋白进行诱导表达纯化,以获取纯化后的mCherry与无任何蛋白标签的sGFP。在最佳交联浓度优化和交联效果直观化检测中,由于sGFP蛋白不含有His6标签,故其能够吸附于Ni NTA Beads,依赖于交联剂的交联作用。而随着交联作用的增强,离心后收集到的交联溶液中sGFP含量会随之减少,植物影像仪所检测到的荧光强度也随之降低。以戊二醛作为交联剂时,sGFP荧光强度出现最低值是在交联浓度为1.0%时;用激光共聚焦显微镜也能观察到每组样品均存在呈现双荧光(黄色)的Ni NTA Beads,证明每一组交联浓度均已发生交联反应,且交联浓度为1.0%时交联效果非常明显,交联效率最高。以甲醛作为交联剂时,sGFP荧光强度出现最低值是在交联浓度为1.5%时;同样用激光共聚焦显微镜也能观察到交联浓度为1.5%时交联效果显著且交联效率较高。这证明,激光共聚焦显微镜观察、交联效率评估技术在直观快速检测蛋白质交联反应中的化学交联剂可能具有一定的普遍适用性。
传统检测手段SDS-PAGE法的检测结果也表明,戊二醛和甲醛可促使mCherry和sGFP荧光蛋白发生交联,进一步验证激光共聚焦显微镜观察、交联效率评估技术的真实准确性。SDS-PAGE法是检测蛋白质交联反应中化学交联剂的主要手段,该方法需要经过制胶、煮样、电泳、染色、脱色等步骤,过程较为繁琐复杂。而本研究开发的激光共聚焦显微镜观察、交联效率评估技术可以在制备交联样品后利用激光共聚焦显微镜对交联结果进行直观化观察,具有简便、快速、高效的特点,在体外高通量初步筛选化学交联剂方面具有潜在的应用前景。
3 结论
分别以戊二醛和甲醛为交联剂,以Ni NTA Beads为固体介质,利用mCherry和sGFP进行交联反应,通过激光共聚焦显微镜观察检测固体介质上双荧光强弱来判断交联效果并对交联效率进行评估,开发了一种快速、简便、高通量的体外初步筛选化学交联剂的荧光直观化检测新方法。结果表明:以戊二醛为交联剂时,最佳交联浓度为1.0%,交联效果显著,交联效率为95.6%;以甲醛为交联剂时,最佳交联浓度为1.5%,交联效果明显,交联效率为90.9%。通过激光共聚焦显微镜观察及交联效率评估,可以直观地检测到戊二醛、甲醛均使等比例mCherry和sGFP发生交联反应,与传统检测技术SDS-PAGE法的检测结果一致;并且对于戊二醛、甲醛作为交联剂的微量非等比例荧光蛋白的交联反应,同样可以直观地检测到交联效果。该研究为体外检测荧光蛋白质交联反应中的化学交联剂的研究提供了一个简便、高效的直观化技术手段,同时也为体外初步大量快速筛选蛋白质交联反应化学交联剂提供了技术可行性。
