StyS激酶自磷酸化对Pseudomonas putida B3中靛蓝生物合成的调节作用
2021-08-26任明婧陶德江王成涛
任明婧,陶德江,程 雷,梁 杉,王成涛
(北京工商大学 北京食品营养与人类健康高精尖创新中心/北京市食品添加剂工程技术研究中心,北京 100048)
靛蓝是一种重要的颜料,广泛用于食品生产[1]。但天然靛蓝色素相对稀少,来源有限,主要是通过化学合成制造[2],而化学合成靛蓝色素由于原料和中间产物会对环境造成污染[3-4]。因此,靛蓝的生物合成受到了广泛的关注。
在实验室前期的研究中,我们发现PseudomonasputidaB3中靛蓝生物合成关键酶基因styAB上游存在一个二元调控系统StyS-StyR。将styAB基因进行诱导型表达后发现,其表达水平与二元调控系统StyS-StyR的调控密切相关[5]。表1展示了styS和styR基因及其表达的蛋白质序列与其他报道的styS和styR基因的差异比较。表1表明,苯乙烯降解基因簇的转录调控因子基因序列是保守的,并且与甲苯降解细菌中常见的todS和todT二元调控系统具有高度同源性[6]。
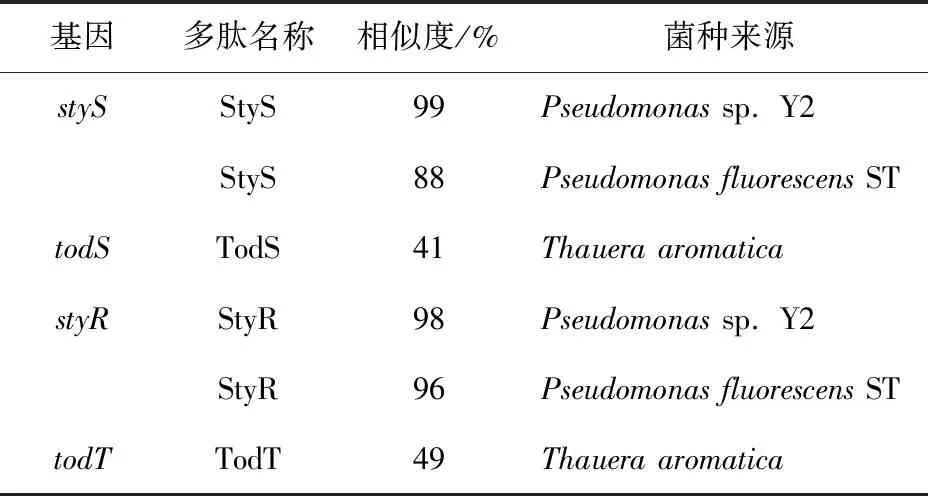
表1 Pseudomonas putida B3 中styS和styR基因及其产物与其他已知来源菌种对比Tab.1 Comparison of Pseudomonas putida B3 styS and styR genes and their products with other known bacteria
由于表达产物的结构相似性,styS和styR基因可能以二元调节系统的形式调节整个苯乙烯降解基因簇的转录,类似于经典的二元调节系统todS和todT[7]。StyS激酶的信号转导由组氨酸激酶结构域外部的感应外部刺激的区域引发,从而导致自磷酸化,然后将磷酸基团转移至下游调节蛋白的天冬氨酸残基,磷酸化的反应调节蛋白与DNA或其他调节相关基因表达的配体结合[8-12]。
但激酶蛋白StyS的自磷酸化的位点和传导机制尚未探明,此磷酸信号传导过程对靛蓝色素生物代谢途径的调节效应及其作用机理尚不明确,这可能限制了这种重要的天然色素的深入开发和应用[13]。
本研究以具备合成靛蓝色素能力的PseudomonasputidaB3为研究对象,解析StyS自磷酸化对靛蓝合成的影响,以确认其磷酸化位点在相关信号转导途径中的作用。
1 材料与方法
1.1 试剂与材料
PseudomonasputidaB3、P.putidaB3-ΔstyS、P.putidaB3-ΔstyS-0,实验室保存;pBBR1MCS-2,武汉淼灵生物有限公司;Escherichia coli DH5α,北京天根生化科技有限公司;靛蓝(色谱纯)、吲哚(分析纯),考马斯亮蓝、卡那霉素、N,N-二甲基甲酰胺,LB肉汤培养基,北京半夏生物科技有限公司;PrimeSTAR Max Premix(2×)DNA聚合酶、6×蛋白质Maker、核酸限制性内切酶、10000DL DNA Marker、Supercoiled DNA Ladder Maker、T4 DNA 连接酶,宝生物工程(大连)有限公司;细菌基因组DNA提取试剂盒等试剂盒、高纯质粒小量制备试剂盒和多功能 DNA 纯化回收试剂盒,北京天根生化科技有限公司;离心管,美国BioRad公司;Ziptip C18萃取柱,美国Milipore公司;Kinase-GloTM激酶测定试剂盒,美国Promega公司。
1.2 仪器与设备
C1000 Touch型PCR仪、PowerPac Basic型电泳仪(水平电泳槽),美国BIO-RAD公司;3K15型高速离心机,美国Sigma公司;SPX-150B型生化培养箱,上海博讯医疗生物仪器股份有限公司;LC-20AT型高效液相色谱,日本Shimadzu公司;BioLector®Ⅰ型微生物反应器,德国M2P Labs公司;BioSpectrum 凝胶成像仪,美国 UVP 公司;小型高速离心机,美国Sigma公司;涡旋振荡器,德国 IKA 公司;超净工作台、水浴摇床、空气浴摇床,上海博讯医疗生物仪器股份有限公司;BSA224S型数字电子天平,Sartorius公司;移液器,Eppendorf 公司;SpectraMaxi3型连续波长多功能酶标仪,美国MD公司。
1.3 实验方法
1.3.1摇瓶发酵
将PseudomonasputidaB3单菌落接种到液体LB培养基中[13],30 ℃、200 r/min培养10 h,此时培养物的OD600值约为0.6,然后将新鲜培养物以1%的接种量接种到苯乙烯终浓度为10 mg/L的50 mL发酵培养基[5]中,发酵12 h后进行后续实验[14]。
1.3.2蛋白质提取
收集发酵液并以12 000 r/min离心20 min,弃去上清液,将细胞重悬于3 mL裂解缓冲液中。随后,将重悬的细菌放置在冰上进行超声破碎,用25 kHz、500 W超声处理10 min,超声条件为工作5 s,间歇5 s。最后,将细菌裂解液以12 000 r/min离心10 min,取100 μL上清液用于检测[13,15]。
1.3.3StyS激酶蛋白磷酸化位点鉴定
激酶蛋白StyS的磷酸化修饰鉴定由北京青莲百奥生物科技有限公司完成[16]。
1.3.4styS基因扩增及质粒构建
使用细菌基因组DNA提取试剂盒提取PseudomonasputidaB3基因组DNA。基于来自其他细菌的同源基因序列,使用引物对styS-F(5′-TGTAAAACGACGGCCAG-3′)和styS-R(5′-CAGGAAACAGCTATGACC-3′),从PseudomonasputidaB3中扩增了styS基因。利用纯化回收试剂盒分离扩增的基因并进行凝胶纯化。随后,用QuickCutBamHI和HindIII限制酶在37 ℃将styS基因和pBBR1MCS-2质粒双酶切30 min。
酶切后,将基因片段与载体片段连接,并将重组载体导入大肠杆菌EscherichiacoliDH5α感受态细胞,选择阳性转化体,提取重组质粒进行验证。验证无误后,使用预冷的电击杯,电极间隙为2 mm,将成功验证的质粒电击入PseudomonasputidaB3-ΔstyS中。电击转化条件为1.5 kV,400 Ω和25 μF[5,17]。
1.3.5激酶StyS磷酸化位点突变及质粒构建
磷酸化位点的定点诱变(苏氨酸突变为丙氨酸,天冬氨酸突变为谷氨酸)由北京华大基因研究中心提供支持。成功突变后,将基因突变序列连接到pBBR1MCS-2质粒中。
1.3.6野生型及突变体生长曲线测定
使用BioLector®Ⅰ型微生物反应器实时监测在LB培养基中的种子液体生长曲线。由于菌株在发酵液中产生靛蓝色素,会对细菌生长不同周期的吸光值产生影响,因此选择细胞平板计数法测定发酵液中细菌的生长情况[17]。
1.3.7靛蓝产量测定
将每个菌株的单个菌落接种入液体LB肉汤培养基中(由于质粒pBBR1MCS-2带有卡那霉素抗性,因此必要时添加0.1 mmol/L卡那霉素),在200 r/min、30 ℃条件下培养12 h后,以体积比为1%的接种量接种入50 mL发酵培养基中,200 r/min、30 ℃培养48 h。将发酵液转移至50 mL离心管中,以10 000 r/min离心20 min,弃去上清液。加入20 mLN,N-二甲基甲酰胺,超声30 min,将提取液通过0.22 μm过滤器过滤。使用Agilent Eclipse Plus C18色谱柱(2.1 mm×50 mm×1.8 μm)通过高效液相色谱分析靛蓝含量。检测条件V(水)∶V(甲醇)=70∶30混合物用作流动相、0.2 mL/min的流速,检测波长610 nm[14],重复测定3次取平均值。
1.3.8激酶活性检测
使用Kinase-GloTM激酶测定试剂盒测定StyS激酶活性。取10 μg目的蛋白,加入35 μL反应缓冲液和5 μL终浓度5 μmol/L的ATP(腺嘌呤核苷三磷酸、adenosine triphosphate)。该反应在37 ℃下进行10 min,然后添加50 μL发光剂,在37 ℃下继续反应10 min。最后,使用酶标仪在560 nm的波长处测量发光值[18-19],重复测定3次取平均值。
1.3.9验证定点突变体中的磷酸化修饰
为了确定突变蛋白是否被磷酸化,如1.3.3节所述,通过质谱分析突变蛋白。
2 结果与分析
2.1 StyS蛋白及StyS突变蛋白磷酸化位点鉴定
磷酸化修饰是蛋白质翻译后修饰中的一种共价修饰形式,同时也是最重要的调控修饰形式。蛋白质发生磷酸化修饰后不仅影响蛋白质的化学性质,还影响其亚细胞地位以及与其他物质之间的相互作用,从而改变蛋白质的活性和功能。激酶蛋白发生磷酸化修饰的过程是感应外界刺激后结合ATP,发生自磷酸化,然后将ATP的磷酸基转移到下游蛋白质特定的结合位点的过程[20-21]。结合国内外部分研究结果及激酶蛋白StyS的结构预测可知,StyS蛋白在感应外界刺激后可发生自磷酸化,进而促进styR基因的表达及StyR蛋白的磷酸化[6],因此我们将在发酵条件下提取的蛋白质样品进行质谱分析,明确肽段并获得其第二个片段离子的分子质量。然后,根据获得的肽段序列和蛋白质信息,推测在苯乙烯诱导培养后提取得到的StyS蛋白结构中存在两个磷酸化位点,分别为苏氨酸和天冬氨酸(图1)。
为了进一步明确磷酸化位点对靛蓝生物合成的影响,如1.3.5节所述,本研究将582位的苏氨酸突变为丙氨酸(ACC-GCC),将679位的天冬氨酸突变为谷氨酸(GAT-GAA),并且对突变蛋白进行了磷酸化质谱鉴定,发现突变蛋白未发生磷酸化,因而没有检测到磷酸化结合位点。质谱鉴定结果表明,前期预测的582位苏氨酸和679位天冬氨酸确为该蛋白的磷酸化位点。这一结果有助于开展进一步研究,阐释StyS蛋白的自磷酸化对靛蓝生物合成的影响。
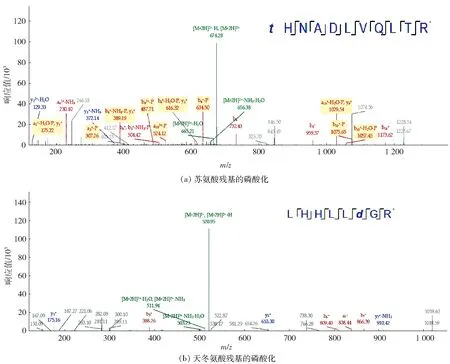
*:t代表发生磷酸化修饰的苏氨酸位点,d代表发生磷酸化修饰的天冬氨酸位点,T代表苏氨酸(Thr),H代表组氨酸(His),N代表天冬酰胺(Asn),A代表丙氨酸(Ala),D代表天冬氨酸(Asp),L代表亮氨酸(Leu),V代表缬氨酸(Val),Q代表谷氨酰胺(Gln),R代表精氨酸(Arg),G代表甘氨酸(Gly)。图1 激酶蛋白质谱分析鉴定磷酸化位点Fig.1 Identification of phosphorylation sites based on mass spectrometry analysis of kinase protein
2.2 重组质粒和菌株的构建
以PseudomonasputidaB3基因组作为模板,PCR扩增得到2 952 bp的styS基因,扩增产物凝胶电泳见图2。经测序,克隆产物基因序列与GenBank中的styS基因序列一致,说明成功得到styS序列。进而将扩增产物通过HindIII和BamHI酶切后插入到表达载体pBBR1MCS-2中,构建得到8 105 bp的styS基因过表达重组质粒pBBR1MCS-2-styS,该重组质粒及其双酶切电泳见图3。进一步,利用同源重组的方法构建582位的苏氨酸和679位的天冬氨酸磷酸化位点突变质粒,并将突变后的序列插入到pBBR1MCS-2质粒中,构建8 099 bp的磷酸化位点突变质粒pBBR1MCS-2-styS-1。由图3(b)可知,pBBR1MCS-2-styS-1经HindIII和BamHI双酶切后,可得大小约为5 144 bp和2 960 bp的2个条带,分别与载体pBBR1MCS-2和突变styS基因大小一致。最后,将pBBR1MCS-2-styS,pBBR1MCS-2-styS-1和空载体(pBBR1MCS-2)分别转化到styS基因缺失菌株PseudomonasputidaB3-ΔstyS中,成功构建styS基因回补菌株B3-ΔstyS-8、磷酸化位点突变菌株 B3-ΔstyS-1和对照菌株B3-ΔstyS-0。
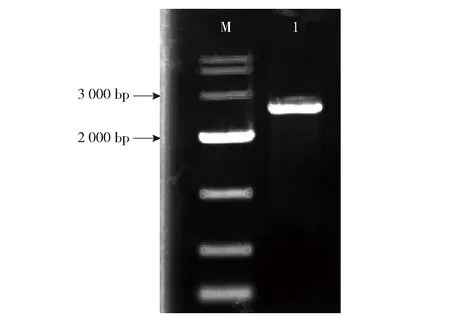
M为DL10000 DNA Marker;泳道1为styS基因PCR扩增产物。图2 styS基因PCR扩增产物电泳Fig.2 Electrophoresis of styS gene PCR product
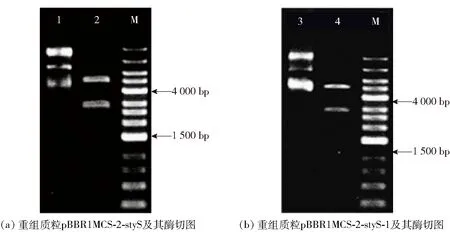
M为DL12,000 DNA Marker;泳道1为重组质粒pBBR1MCS-2-styS;泳道2为重组质粒pBBR1MCS-2-styS双酶切产物;泳道3为重组质粒pBBR1MCS-2-styS-1双酶切产物;泳道4为重组质粒pBBR1MCS-2-styS-1。图3 重组质粒的酶切验证电泳Fig.3 Electrophoresis of double restriction enzyme digestion products of recombinant plasmid
为确保在靛蓝发酵过程中观察到的表型变化并非因为受到菌体生长差异的影响,对每个菌株在不同阶段的生长速率进行了测定,结果见图4。从图4可看出,对照菌和突变菌株种子液的生长情况与野生菌株PseudomonasputidaB3基本一致,无显著差异,可知载体的转化及基因的突变对菌体在种子液中的生长未见明显的影响。
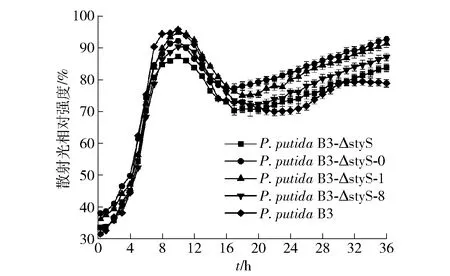
图4 LB培养基中野生菌和突变菌株生长曲线Fig.4 Growth curves of wild-type and mutant strains in Luria-Bertani medium
在此基础上,通过细胞平板计数的方法测定了发酵液中各菌株的生长曲线,结果见图5。各菌株前期增值迅速,快速进入对数期,在发酵液中发酵12 h后各菌株进入稳定期。同时,各菌株处于稳定时期的时间较短,是因为氮源碳源种类单一且浓度低,其生长曲线与种子液生长曲线一致,各菌株的生长情况无明显差异。该结果亦说明在靛蓝发酵体系中,styS基因的缺失和磷酸化位点的突变不会显著影响细胞生长,也不会杀死细胞或降低其生长速率。因此,各菌株在发酵系统中的表型变化差异可能是由于代谢途径中的相关变化所引起,与载体的转化和磷酸化位点的突变无关。
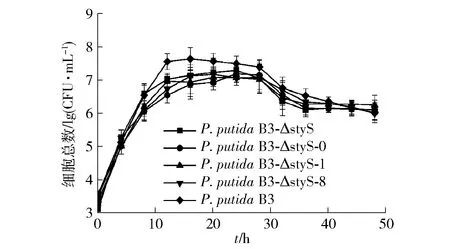
图5 发酵培养基中野生菌株和突变菌株生长曲线Fig.5 Growth curves of wild-type and mutant strains in fermentation medium
2.3 激酶蛋白StyS自磷酸化对靛蓝产量的影响
为明确磷酸化位点对靛蓝生物合成的影响,首先将菌株B3,B3-ΔstyS,B3-ΔstyS-0,B3-ΔstyS-1和B3-ΔstyS-8接种到发酵培养基中并培养48 h,靛蓝产量测定结果见图6。实验结果表明,发酵48 h后,菌株B3和菌株B3-ΔstyS-8均产生了靛蓝。野生型B3菌株的靛蓝产率为10.14 mg/L,而B3-ΔstyS-8菌株的靛蓝产率为3.63 mg/L。相反,菌株B3-ΔstyS,B3-ΔstyS-0和B3-ΔstyS-1在发酵过程中不产生靛蓝。
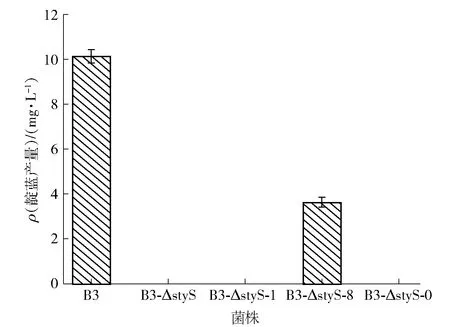
图6 野生型及突变菌株的靛蓝产量分析Fig.6 Analysis of indigo production of wild type and mutant strains
因此可知,在PseudomonasputidaB3中styS基因的缺失和磷酸化位点的突变均使突变菌株丧失了合成靛蓝色素的能力。styS基因作为靛蓝色素生物合成关键酶基因的表达调控因子,是靛蓝色素合成调节基因磷酸信号传导的起点,亦是整个靛蓝色素生物合成的开始,其磷酸化在整个信号转导过程中起着重要作用,其基因功能的缺失会造成合成酶基因表达的停止,进而影响突变菌株合成靛蓝色素的能力。进而可知激酶蛋白StyS磷酸化位点的突变使其无法进行自身磷酸化,阻断了整个磷酸化信号传导过程。因此,激酶蛋白StyS上的磷酸化位点通过调节自磷酸化作用参与整个靛蓝生物合成途径,磷酸化位点的突变会影响靛蓝的产生,其在PseudomonasputidaB3靛蓝生物合成途径中起重要调控作用。
2.4 激酶酶活水平分析
为进一步验证磷酸化位点突变对靛蓝产生的影响可能是由于激酶活性的丧失,我们研究了磷酸化位点突变对PseudomonasputidaB3中激酶活性的影响。发酵12 h后,从细菌细胞裂解物中提取蛋白质,并测定了该蛋白激酶活性。以PseudomonasputidaB3的激酶活性为基础,对比各菌株中激酶酶活水平发现,在缺失styS基因的B3-ΔstyS和B3-ΔstyS-0菌株中均未检测到激酶活性,见图7。同时,在缺少styS基因并带有表达StyS磷酸化位点突变载体的B3-ΔstyS-1菌株中也未检测到激酶活性。相反,由于styS基因可通过pBBR1MCS-2-styS载体表达,styS基因回补菌株B3-ΔstyS-8具有激酶活性,但其活性显著低于野生菌株B3。研究结果表明,突变磷酸化位点在PseudomonasputidaB3中改变了StyS蛋白的激酶活性,磷酸化位点的突变使激酶蛋白StyS丧失了酶活,使其无法自磷酸化,也无法将磷酸基团传递给调节蛋白,进而使调节蛋白无法与下游靛蓝合成关键基因styAB的启动子结合。StyS激酶活性的丧失可能导致PseudomonasputidaB3中产生靛蓝的关键基因styAB表达的失败,最终影响了靛蓝的产生,控制了靛蓝生物合成代谢途径。

图7 野生型及突变菌株的StyS激酶蛋白活性分析Fig.7 Analysis of StyS kinase protein activity in wild-type and mutant strains
3 结 论
StyS-StyR作为一种重要的二元调控系统,对靛蓝生物合成过程发挥着重要作用。但是激酶蛋白StyS磷酸化位点不明,其自磷酸化机制仍未研究清楚。为了确定质谱数据中所检测到的磷酸化位点是否对靛蓝生物合成的代谢调控具有作用,本研究利用同源重组方法成功构建得到磷酸化位点突变质粒,将质粒转化入styS基因缺失菌株中成功构建磷酸化位点突变菌株。对野生株、回补菌株、styS基因缺失菌株、磷酸化位点突变株和阴性对照菌株之间的靛蓝产量和激酶活性差异的比较分析表明,野生菌株和styS基因回补菌株具有合成靛蓝的能力,而styS基因缺失菌株和磷酸化位点突变株均丧失了产生靛蓝的能力。
研究结果说明,磷酸化位点的突变使激酶蛋白StyS失活并阻止其进行自身磷酸化。由于磷酸基团在靛蓝生物合成调控系统中的传递受阻,使得下游调节蛋白无法与靛蓝合成关键基因styAB的启动子结合,无法启动下游相关基因的表达,从而使菌株丧失了生物合成靛蓝色素的能力。可见,磷酸化位点在靛蓝生物合成途径中的作用是通过影响整个磷酸化信号转导过程来控制关键基因styAB的表达,从而调节整个靛蓝生物合成代谢途径。激酶蛋白StyS中的磷酸结合位点在整个靛蓝合成途径中起着重要的作用,其与下游的调节蛋白之间的相互作用以及下游蛋白磷酸化后的功能变化还待进一步研究,希望此结果可为今后的靛蓝色素生物合成研究提供新的思路。
