南极磷虾油对小鼠肠黏膜屏障的保护作用及机制
2021-08-26郝仪铭杨玉红刘小芳王保珍
郝仪铭,杨玉红,刘小芳,吴 昊,王保珍,杜 磊,*
(1.山东大学 齐鲁医学院 公共卫生学院 营养与食品卫生学系,山东 济南 250012;2.齐鲁工业大学(山东省科学院) 食品科学与工程学院,山东 济南 250353;3.中国水产科学研究院黄海水产研究所/农业农村部极地渔业开发重点实验室,山东 青岛 266071)
肠道不仅是负责食物消化和营养物质吸收的器官,也是阻止肠道内致病菌和内毒素如脂多糖(lipopolysaccharide,LPS)侵入体内的屏障[1]。肠黏膜屏障包括机械屏障、生物屏障、化学屏障和免疫屏障,完整的肠黏膜屏障可将肠腔与机体内环境隔开,防止肠腔内的病原体或有害物质向肠腔外组织和器官移位[2]。研究发现[3-5],肠黏膜屏障损伤与炎症性肠病、肥胖、胰岛素抵抗及糖尿病等多种疾病相关,因此,寻求有效维持肠黏膜屏障完整性的营养干预措施将有助于预防上述疾病的发生。
南极磷虾油(krill oil,KO)以南极磷虾(Euphausiasuperba)为原料提取精制而成,因富含二十碳五烯酸(eicosapentaenoic acid,EPA)和二十二碳六烯酸(docosapentenoic acid,DHA)等ω-3系多不饱和脂肪酸、磷脂以及虾青素等多种生物活性成分,具有抗氧化、抗炎等多种生理活性[6-8]。有文献报道[9-10],富含DHA和EPA的鱼油(fish oil,FO)可保护肠黏膜屏障。与传统鱼油不同,KO中EPA和DHA主要结合在磷脂上,具有更高的生物利用率[11]。近期研究发现[12-13],KO能有效改善溃疡性结肠炎,然而,KO对肠黏膜屏障损伤的预防作用及其机制鲜见报道。肠道中富含革兰阴性菌,LPS是其细胞壁的主要成分,肠道易受膳食或病理性应激等因素影响促使LPS大量释放,导致肠道炎症发生,造成肠黏膜屏障功能受损,破坏肠黏膜屏障的完整性[14-18],因此,LPS被广泛用于肠黏膜屏障损伤模型的建立[19-20]。本研究拟以改善肠道炎症反应为切入点,并以富含甘油三酯型EPA和DHA的FO为对照,探讨KO预防性干预对LPS所致肠黏膜屏障损伤的预防作用及其分子机制。
1 材料与方法
1.1 实验动物
SPF级雄性6周龄C57BL/6J小鼠,购自北京维通利华实验动物技术有限公司。生产许可证号:SCXK(京)2016-0006。动物实验将严格遵照山东大学公共卫生伦理委员会相关规定执行。
1.2 主要试剂
KO和FO,分别由青岛南极维康生物科技有限公司和山东禹王制药有限公司提供。组分分析结果显示:KO和FO中EPA和DHA含量大致相同,EPA和DHA分别占KO总脂肪酸质量的22.89%和13.83%,而FO则为23.61%和13.84%,此外,KO中磷脂占比55.06%,虾青素质量分数为232.15mg/kg;LPS购自美国Sigma-Aldrich公司;二胺氧化酶(diamine oxidase,DAO)试剂盒和髓过氧化物酶(myeloperoxidase,MPO)试剂盒,购自南京建成生物工程有限公司;一氧化氮试剂盒、BCA蛋白浓度测定试剂盒(增强型)和动物组织RNA提取试剂盒,购自上海碧云天生物技术有限公司;逆转录试剂盒和实时荧光定量PCR试剂盒,购自日本TaKaRa公司;兔抗Claudin-1、Occludin和Zonula occludens-1(ZO-1),购自武汉Proteintech公司;兔抗诱导型一氧化氮合酶(inducible nitric oxide synthase,iNOS)、Toll-样受体4(Toll-like receptor 4,TLR4)、核因子κB抑制蛋白α(inhibitor of nuclear factor kappa-B alpha,IκBα)、phosphorylated-IκBα、核因子κB (NF-κB)p65、phosphorylated-NF-κB p65、GAPDH以及山羊抗兔IgG辣根过氧化物酶标记二抗,均购自美国Cell Signaling Technology公司。本研究所用引物由生工生物工程(上海)股份有限公司合成(表1)。

表1 qRT-PCR引物序列Tab.1 Primer sequences for qRT-PCR
1.3 仪器与设备
M200 PRO型多功能酶标仪,瑞士Tecan公司;Centrifuge 5430R型台式高速冷冻离心机,德国Eppendorf公司;Microm EC 350-1型石蜡包埋机、HM325型石蜡切片机,美国Thermo Fisher Scientific公司;Light Cycler 480型实时荧光定量PCR系统,瑞士Roche公司;光学显微镜,日本Olympus公司;5200 Multi型全自动化学发光图像处理系统,上海天能科技有限公司。
1.4 实验方法
1.4.1实验动物分组与处理
小鼠适应性饲养1周后,随机分为4组,每组8只:正常组、模型组(LPS)、南极磷虾油组(KO)和鱼油组(FO)。以橄榄油作为溶剂稀释KO和FO,参考《中国居民膳食营养素参考摄入量(2013版)》中关于成人对DHA+EPA的推荐摄入量,以400 mg/kg(以体重计)的剂量灌胃小鼠[21],灌胃体积为0.1 mL/20 g(以体重计),每日1次,持续4周。正常组和模型组小鼠灌胃橄榄油,末次灌胃24 h后,给予正常组小鼠注射生理盐水,其余小鼠腹腔注射剂量为10 mg/kg(以体重计)的LPS。6 h后取血并脱颈处死小鼠,取肠道组织用预冷生理盐水冲洗,取小肠末端固定于10%的中性福尔马林溶液中,用于苏木精-伊红(hematoxylin-eosin,HE)染色,其余部分于-80 ℃冻存待用。
1.4.2肠道病理学观察
将固定于10%的中性福尔马林溶液的小肠经梯度乙醇脱水、透明、浸蜡、包埋,常规切片(厚度5 μm),65 ℃烘烤2 h,脱蜡至水。HE染色后,光学显微镜下观察肠道病理学改变情况,使用Image Pro Plus 6.0软件测量肠绒毛长度与隐窝深度。
1.4.3血清中DAO活性的测定
取血后在4 ℃条件下以3 000 r/min的转速离心15 min,分离血清,冻存于-80 ℃待用。根据试剂盒说明书要求检测血清中DAO浓度。
1.4.4肠道生化指标的测定
根据试剂盒说明书要求进行小肠组织匀浆,用BCA蛋白浓度测定试剂盒测定匀浆中蛋白浓度,检测DAO和MPO活性以及一氧化氮含量。
1.4.5蛋白免疫印迹检测
提取小肠蛋白,用BCA试剂盒测定蛋白浓度,取适量蛋白样品电泳、转膜、封闭;加入一抗,4 ℃孵育过夜;洗膜,加入二抗,室温孵育1h;洗膜、显色、曝光。利用图像分析软件Image J对蛋白条带进行灰度分析。
1.4.6PCR检测
利用试剂盒提取小肠组织总RNA,取1 μg RNA逆转录合成cDNA,进行PCR反应。以GAPDH为内参,计算目的基因mRNA相对表达水平。
1.5 数据处理
采用SPSS 20.0软件对数据进行统计分析,结果以平均值±标准偏差表示。采用单因素方差分析比较各组间差异,若P<0.05则认为结果具有显著性差异。
2 结果与分析
2.1 KO对小鼠肠道组织病理学变化的影响
利用HE染色观察小鼠小肠组织病理学变化情况,实验结果见图1。由图1可知:正常组小鼠肠黏膜形态结构完整,肠绒毛排列整齐,隐窝浅且界限明显;LPS组小鼠肠绒毛排列紊乱且有顶端缺失情况,隐窝深且界限不明显,部分肠上皮层与固有层分离。由图1(a)和(b)可知:与FO组相比,KO预防性干预可显著改善肠道损伤状况,并能显著抑制LPS所致肠绒毛长度与隐窝深度比值的降低(P<0.01)。小肠绒毛长度与隐窝深度的比值是评价肠黏膜结构完整性的重要指标。本研究发现,LPS的刺激可显著降低小肠绒毛长度与隐窝深度的比值;KO和FO预防性干预能有效抑制LPS所致小肠绒毛长度与隐窝深度比值的降低,且KO效果较FO更为显著。这与已有研究结果一致[22-23]。
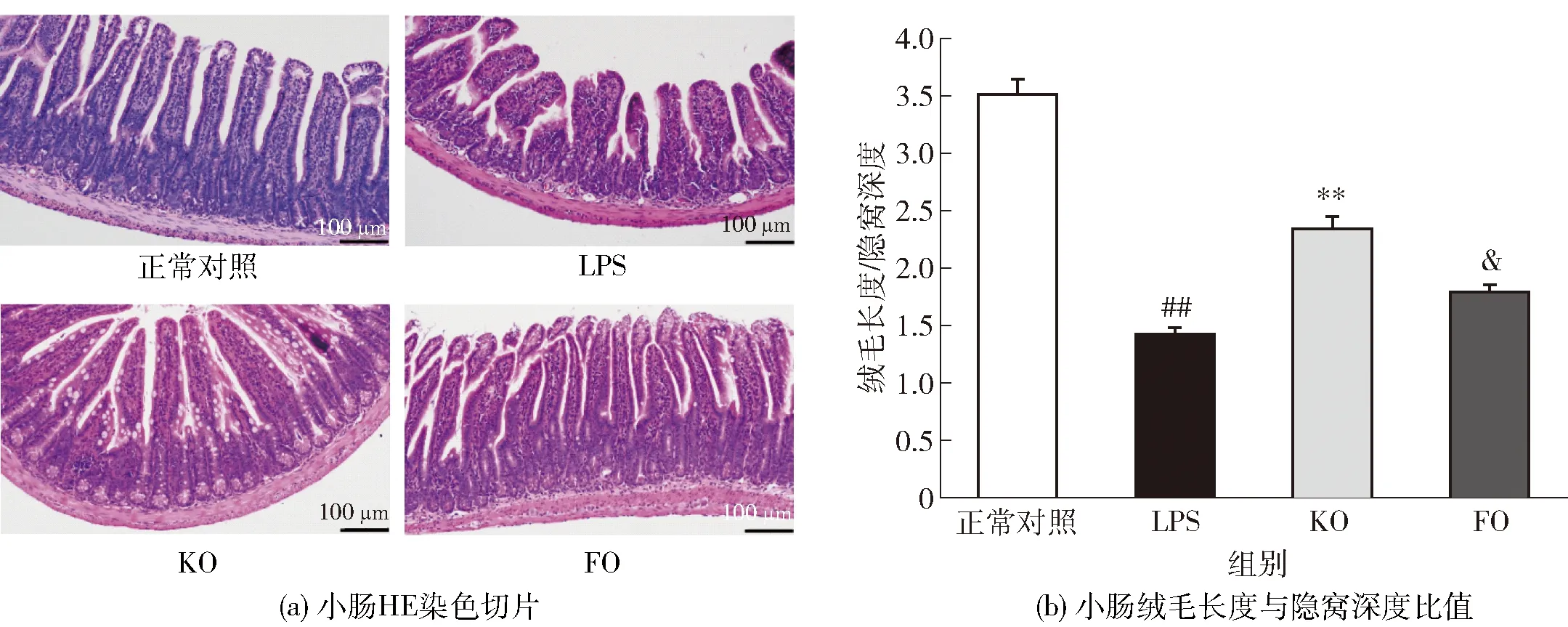
小肠HE染色切片放大倍数为200倍。#表示与正常组相比差异显著(P<0.05),##表示差异极显著(P<0.01);*表示与LPS组相比差异显著(P<0.05),**表示差异极显著(P<0.01);&表示与KO组相比差异显著(P<0.05),&&表示差异极显著(P<0.01)。图1 KO对经LPS处理后小鼠肠道形态的影响Fig.1 Effect of KO on intestinal morphology in LPS-treated mice
2.2 KO对小鼠血清和肠道DAO活性以及紧密连接蛋白表达的影响
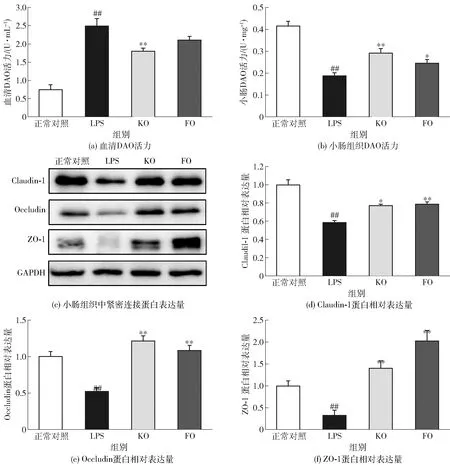
小肠DAO活力以蛋白含量计。#表示与正常组相比差异显著(P<0.05),##表示差异极显著(P<0.01);*表示与LPS组相比差异显著(P<0.05),**表示差异极显著(P<0.01)。图2 KO对经LPS处理后小鼠肠黏膜屏障功能的影响Fig.2 Effect of KO on intestinal barrier function in LPS-treated mice
本研究通过考察血清和小肠组织DAO活性以及肠上皮细胞紧密连接蛋白表达情况,探讨KO对LPS所致小鼠肠黏膜屏障通透性的影响,实验结果见图2。DAO作为肠上皮细胞中具有高度活性的细胞内酶,在肠黏膜屏障受损时会释放入血,使肠道中DAO含量减少,因此可作为检测肠黏膜屏障功能的重要指标[24]。由图2(a)和(b)可知:LPS的刺激可明显提高小鼠血清中DAO活性(P<0.01)并降低小肠组织中DAO活性(P<0.01);KO和FO预防性干预则可显著抑制血清DAO活性的升高并增强小肠组织中DAO活性。该实验结果表明,KO和FO能显著降低血清中DAO活性并维持小肠DAO活性,减轻LPS所致肠黏膜屏障损伤。
肠黏膜屏障以机械屏障最为重要。肠上皮细胞间紧密连接是构成肠黏膜机械屏障最重要的部分,主要由跨膜蛋白Claudin、Occludin家族以及胞浆蛋白ZO等紧密连接蛋白组成,对维持肠黏膜上皮细胞极性及调节肠黏膜屏障的通透性发挥着关键作用[25]。由图2(c)、(d)、(e)和(f)可知:与正常组小鼠相比,LPS的刺激可显著降低肠上皮细胞间紧密连接蛋白Claudin-1、Occludin和ZO-1的表达水平,破坏肠黏膜屏障的完整性;KO和FO预防性干预可显著阻止LPS所致Claudin-1、Occludin以及ZO-1蛋白表达的降低。本实验结果提示,KO能有效维持肠黏膜屏障功能。
2.3 KO对小鼠肠道炎症反应的影响
LPS通过诱导小鼠肠道炎症反应破坏肠黏膜屏障的完整性。本研究考察了KO对LPS所致小鼠肠道炎症反应的影响,实验结果如图3。MPO是一种主要由中性粒细胞产生的酶,反映中性粒细胞浸润程度,而中性粒细胞募集是重要的炎症标志物,因此MPO活性可间接反映炎症损伤程度[26]。由图3(a)可知:与正常组小鼠相比,LPS组小鼠小肠中MPO活性显著升高(P<0.01);KO和FO预防性干预可显著抑制MPO活性升高,减轻肠道炎症损伤程度。
浸润的中性粒细胞和受LPS刺激的肠上皮细胞会表达iNOS蛋白,进而催化产生大量一氧化氮,造成肠黏膜屏障功能损伤[27]。由图3(b)、(c)和(d)可知:与正常小鼠相比,LPS组小鼠小肠中iNOS蛋白表达以及一氧化氮含量显著增加;KO和FO预防性干预可显著降低iNOS蛋白表达以及一氧化氮含量,从而减轻肠道炎症损伤程度。
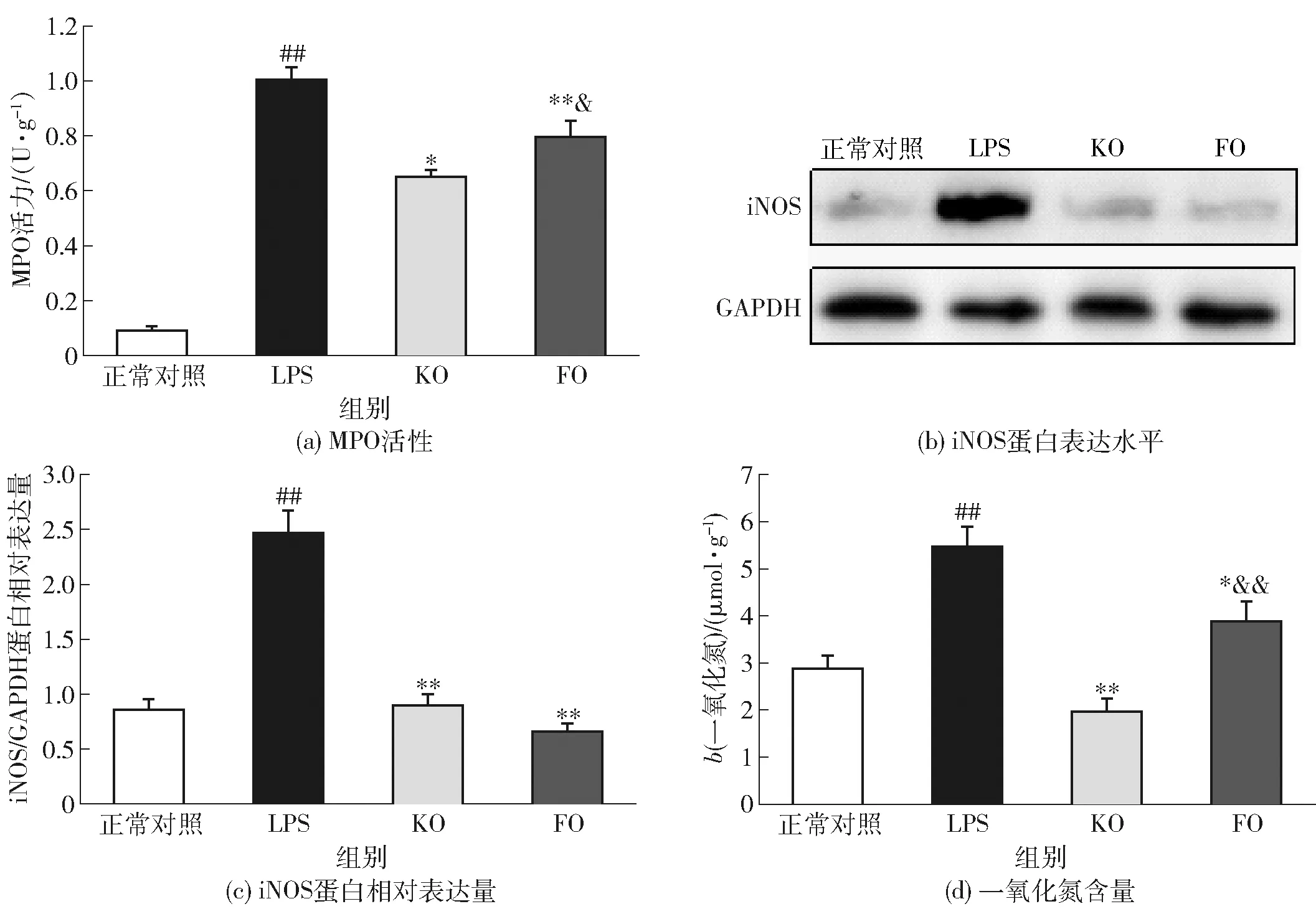
一氧化氮含量以蛋白质量计。#表示与正常组相比差异显著(P<0.05),##表示差异极显著(P<0.01);*表示与LPS组相比差异显著(P<0.05),**表示差异极显著(P<0.01);&表示与KO组相比差异显著(P<0.05),&&表示差异极显著(P<0.01)。图3 KO对经LPS处理后小鼠肠道炎性介质表达的影响Fig.3 Effect of KO on expression of intestinal inflammatory mediators in LPS-treated mice
此外,LPS促使肠道组织释放大量的促炎细胞因子,如TNF-α、IL-1β和IL-6等,进而加重肠道损伤程度。KO对经LPS处理后小鼠小肠组织中促炎细胞因子mRNA表达的影响,实验结果见图4。图4结果表明:与正常组相比,LPS组小鼠小肠组织中TNF-α、IL-1β和IL-6的mRNA表达显著升高;KO和FO预防性干预可显著降低促炎细胞因子mRNA表达水平,表明KO可显著改善肠道炎症反应。
2.4 KO对TLR4/NF-κB信号通路关键因子蛋白表达水平的影响

#表示与正常组相比差异显著(P<0.05),##表示差异极显著(P<0.01);*表示与LPS组相比差异显著(P<0.05),**表示差异极显著(P<0.01)。图4 KO对经LPS处理后的小鼠小肠组织中促炎细胞因子mRNA表达的影响Fig.4 Effect of KO on small intestinal mRNA expression of inflammatory cytokines in LPS-treated mice
TLR4/NF-κB信号通路由TLR4、p-IκBα、IκBα、NF-κB p65以及p-NF-κB p65等关键因子构成,调控下游TNF-α、IL-1β和IL-6等促炎细胞因子表达。研究表明[28-29],LPS可通过激活肠道组织TLR4信号通路,启动下游信号级联引起IκBα的磷酸化和降解,致使NF-κB的两个亚基p65和p50入核,通过与靶基因特定区域相结合启动炎症因子基因转录,进而促使TNF-α、IL-1β和IL-6等促炎细胞因子和炎性介质的表达与释放,造成肠黏膜损伤。为了阐明KO改善LPS所致肠黏膜屏障损伤的分子机制,本研究考察了KO对小肠组织中TLR4/NF-κB信号通路关键因子蛋白表达水平的影响,实验结果如图5。图5显示:LPS的刺激可显著增加小鼠小肠组织中TLR4的蛋白表达以及IκBα和NF-κB p65的磷酸化水平;KO和FO预防性干预能有效抑制LPS所致TLR4、p-IκBα和p-NF-κB p65蛋白表达的增加。结果表明,KO可通过调控TLR4/NF-κB信号通路发挥抗炎作用。
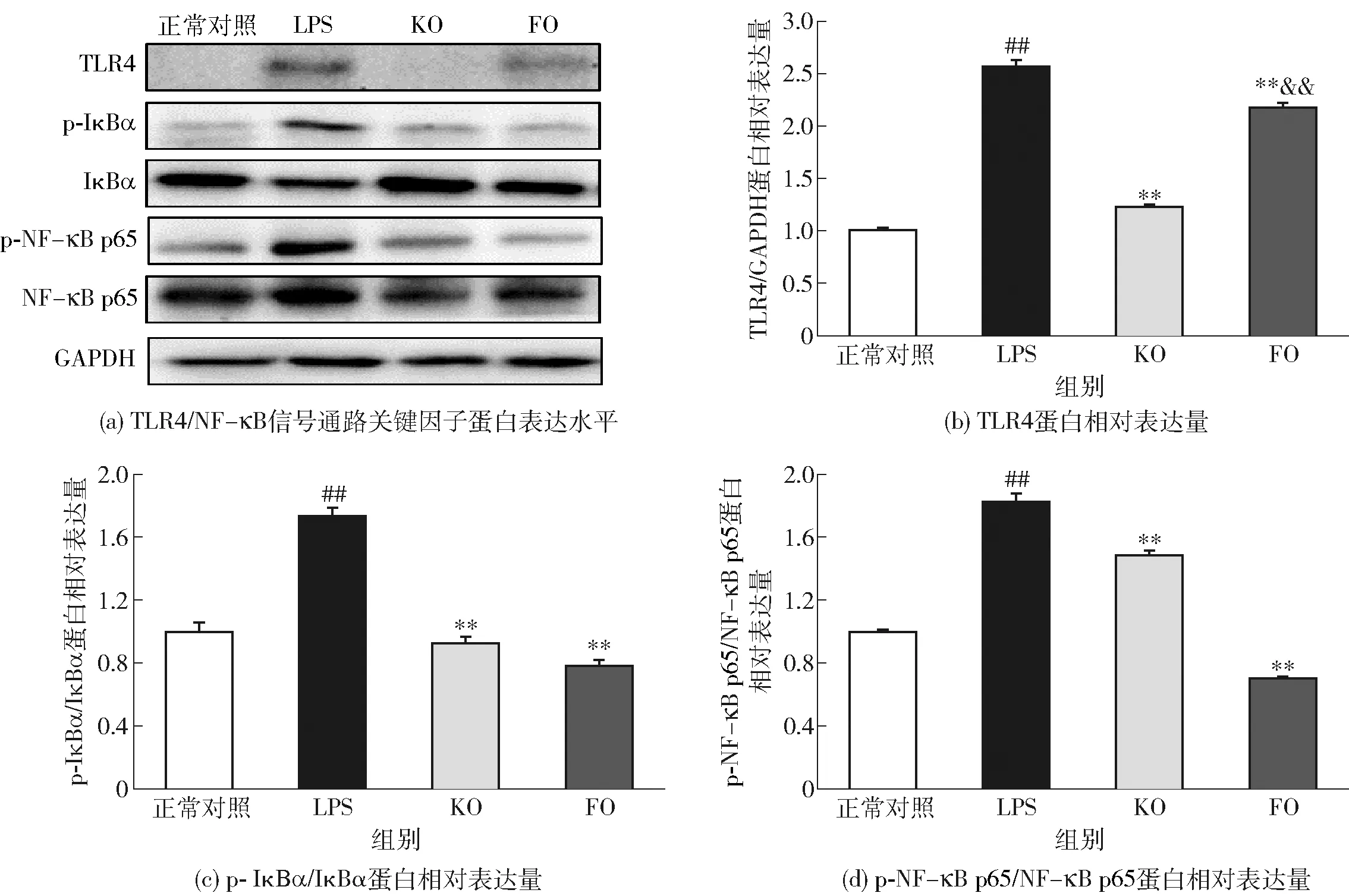
#表示与正常组相比差异显著(P<0.05),##表示差异极显著(P<0.01);*表示与LPS组相比差异显著(P<0.05),**表示差异极显著(P<0.01);&表示与KO组相比差异显著(P<0.05),&&表示差异极显著(P<0.01)。图5 KO对经LPS处理后小鼠小肠组织中TLR4/NF-κB信号通路关键因子表达的影响Fig.5 Effect of KO on small intestinal protein expression of key factors involved in TLR4/NF-κB signaling pathway in LPS-treated mice
3 结 论
本研究通过建立LPS诱导的肠黏膜屏障损伤小鼠模型,系统考察了KO对LPS所致小鼠肠黏膜屏障损伤的预防作用及机制。研究结果表明:KO预防性干预能显著抑制LPS所致小鼠小肠肠绒毛长度与隐窝深度比值的降低;下调血清DAO水平,提高小肠DAO活性,增加肠道紧密连接蛋白Claudin-1、Occludin和ZO-1表达水平;抑制过氧化物酶活性、iNOS蛋白表达和NO含量的升高,降低TNF-α、IL-1β和IL-6的mRNA表达以及TLR4/NF-κB信号通路相关蛋白表达水平。KO可通过调控TLR4/NF-κB信号通路发挥其抗炎活性,进而有效预防LPS所致肠黏膜屏障损伤,且其作用效果优于DHA和EPA含量大致相同的FO。KO是一种新型海洋功能型脂质,市场潜力巨大,希望本研究结果可为因肠黏膜屏障损伤引起的相关疾病的预防以及KO的深度开发与利用提供科学依据。
