血清维生素A和25(OH)D水平与儿童过敏性紫癜的相关性
2021-08-26唐雨珊李喜莲柏金秀王博玉
唐雨珊 李喜莲 柏金秀 王博玉
过敏性紫癜(henoch-schonlein purpura,HSP)又称亨-舒综合征,是儿童期最常发生的以自身免疫复合物介导的小血管炎,临床以皮疹、关节症状、胃肠道症状和肾脏损害等为主要特征。在典型的皮肤紫癜形成前,临床上易误诊为关节炎、小儿外科急腹症、急性肾炎,甚至当累及生殖系统时,也会误诊为睾丸扭转,因此错过最佳治疗时机,从而导致病情延误甚至加重,影响患儿预后[1]。在HSP病程6个月内,出现血尿和(或)蛋白尿,诊断为紫癜性肾炎(henoch-schonlein purpura,HSPN)。临床上大约有20%~60%的HSP患儿在6个月内会出现肾脏受累情况,轻者仅有镜下血尿,严重的可进展成急性肾衰竭;因此肾组织损害严重程度决定病情的严重性及远期预后[2,3]。维生素A、D均是儿童生长发育必不可少的微量元素,维生素A可参与固有免疫及适应性免疫,现已发现维生素A与许多儿童常见的感染性疾病的免疫方面有关[4]。近年来国内外研究表明维生素D除有在骨代谢中调节钙磷水平的功能外,还参与调控机体免疫、炎症、损伤修复,与系统性红斑狼疮(SLE)、类风湿关节炎、多发性硬化[5]、哮喘、1型糖尿病、甲状腺炎、自身免疫胃炎[6]等自身免疫性疾病的发生发展有密切关系。笔者发现HSP作为一种自身免疫性疾病,维生素A、D在其中的表达情况如何国内外目前研究甚少,因此本研究检测HSP患儿的维生素A、D的表达情况,并分析其与体液免疫之间的相关性。报告如下。
1 资料与方法
1.1 一般资料 选取2018年10月至2019年12月在河北大学附属医院住院的85例HSP患儿作为研究对象(HSP组),其中男45例,女34例;平均年龄(8.48±2.96)岁。根据是否合并HSPN分为HSPN组(n=13)和NHSPN(n=72)。85例HSP患儿根据临床表现分为单纯皮肤型组17例、关节型组20例、腹型组12例、混合型组(表现为皮肤紫癜合并关节症状和消化道症状)23例。选取同期门诊体检的80例儿童作为健康对照组,其中男46例,女34例;平均年龄(8.03±2.96)岁。HSP组与健康对照组儿童年龄、性别比等一般资料比较差异无统计学意义(P>0.05),具有可比性。
1.2 诊断标准及排除标准 HSP诊断标准参照2013年中华医学会制定的标准建议[3]:可触性(必要条件)皮疹伴如下任何1条:(1)弥漫性腹痛;(2)任何部位活检IgA沉积;(3)关节炎/关节痛;(4)肾脏受损表现[血尿和(或)蛋白尿]。对于典型皮疹、急性发作的患儿排除相关疾病可以临床诊断HSP,对于皮疹不典型或未见急性期发作性皮疹者,需严格按标准诊断,必要时行皮肤活检。HSPN诊断标准采用2016年中华医学会专家组制定的诊断标准[7]:有典型皮肤紫癜病史,不同程度的血尿和/或蛋白尿,排除乙肝病毒相关性肾炎、狼疮性肾炎、ANCA相关性小血管炎等续发性肾损害。排除标准:(1)既往3个月内使用任何形式的维生素D治疗或补充者;(2)既往伴有遗传、代谢、免疫缺陷性疾病,慢性肝肾和消化道疾病,以及活动性佝偻病史。
1.3 方法 (1)通过查阅门诊及住院期间病案,摘录2组儿童的年龄和性别等一般人口学信息,以及HSP临床分型,血清维生素A、血清25(OH)D、Ig(IgG、IgA、IgM、IgE)和补体(C3、C4)水平。(2)维生素A采用高效液相色谱法,25(OH)D采用免液质联用色谱法检测,Ig(IgG、IgA、IgM、IgE)和补体(C3、C4)采用酶联免疫吸附法检测。
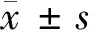
2 结果
2.1 3组儿童血清维生素A水平比较 分析HSP组患儿与健康对照组儿童血清维生素A水平的正态性,结果2组均属于正态分布(P>0.05);HSP组患儿血清维生素A水平为0.13~0.63 mg/L;健康对照组儿童血清维生素A水平为0.17~0.47 mg/L。组间比较,HSP组患儿血清维生素A水平明显低于健康对照组,差异有统计学意义(t=-6.364,P<0.05)。HSPN组患儿血清维生素A与NHSPN和健康对照组儿童血清维生素A相比,差异无统计学意义(t分别为-1.140、1.123,P>0.05)。见表1。
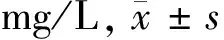
表1 2组儿童血清维生素A水平比较
2.2 2组儿童血清25-(OH)D水平比较 分析HSP组患儿与健康对照组儿童的血清25-(OH)D水平的正态性,结果2组均属于正态分布组(P>0.05);HSP组患儿血清25-(OH)D水平为5.7~47.7 ng/ml;健康对照组儿童血清25-(OH)D水平为10~43 ng/ml。组间比较,HSP组患儿血清25-(OH)D水平明显低于健康对照组,差异有统计学意义(t=-7.372,P<0.05)。HSPN组患儿血清25-(OH)D水平分别低于NHSPN组和健康对照组,差异均有统计学意义(t值分别为1.998、6.302,P<0.05)。见表2。

表2 3组儿童血清25-(OH)D水平比较
2.3 血清25(OH)D与各免疫指标间的相关性 将HSP组患儿的IgA、IgG、IgM、IgE、C3、C4与25(OH)D进行相关性分析,Pearson相关性分析示25(OH)D与IgA之间存在显著负相关关系(r=0.232,P<0.05)。见表3。
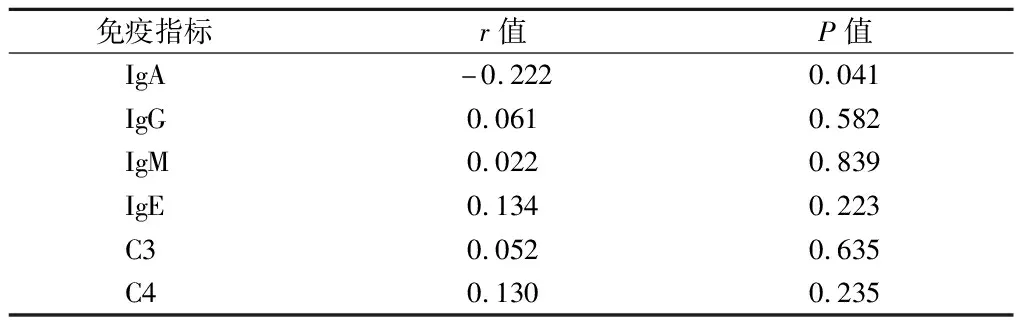
表3 血清25(OH)D与各免疫指标间的相关性
3 讨论
HSP是一种全身小血管变态反应所导致的系统性血管炎,病因及发病机制迄今尚未完全清楚,目前大多数学者认为其主要是由环境因素和特定类型的感染引起的一种免疫介导疾病,导致机体体液免疫紊乱、细胞免疫失衡、内皮细胞损伤、大量炎性因子表达异常、免疫球蛋白异常沉积有关[8]。
维生素D是一种脂溶性类固醇衍生物,人体内的维生素D仅有少量来源于食物,主要是人体皮肤中的7-脱氢胆固醇(维生素D3原)经日光中紫外线辐射光化学反应转化为维生素D类固醇激素前体的活性形式胆骨化醇(维生素D3),这是体内维生素D的主要来源;因此维生素D的水平受季节、经纬度、海拔、生长发育状况、生活差异、皮肤暴露等影响。无活性的维生素D经过肝脏羟化为25-(OH)D,再经过肾脏的羟化成为有活性的1,25-(OH)2D3。骨化三醇通过结合介导多个靶基因转录的核维生素D受体(VDR)起作用。虽然25-(OH)D和1,25-(OH)2D3均为维生素D在血液中的存在形式,但25-(OH)D半衰期长,约2~3周,受内环境影响小,在血液中浓度稳定,所以25-(OH)D是反映体内维生素D储存和状态的最佳指标[9]。我国儿童维生素D不足或缺乏状态广泛存在[10],尤其经济欠发达地区,维生素D缺乏比例高达60%~75%[11],因此适当补充外源性维生素D也是日常儿童保健的需要。
CD4+T细胞分化为不同的T淋巴细胞亚群,包括Th1、Th2、Th17、及Treg细胞,它们的细胞因子产生及模式不同,因此发挥不同的生物学效应。近年来相关研究表明,HSP患儿的免疫调节异常主要包括Th1/Th2细胞失衡、Treg/Th17细胞失衡、Th2和Th17的异常激活[12]和Tfh/Tfr失衡[13]。维生素D可以直接作用于T淋巴细胞,间接作用于抗原提提呈细胞促进适应性免疫,调控Th1/Th2的平衡,抑制Th17细胞反应以及IL-17水平[14]。维生素D也可以直接作用于B细胞,抑制体液免疫,抑制免疫球蛋白的合成和释放[15]。
本研究通过对85名HSP患儿血清25(OH)D水平测定发现,HSP组患儿血清25(OH)D水平明显低于健康对照组,HSPN组患儿的血清25(OH)D水平也低于健康对照组和NHSPN,与郑荣浩等[16,17]研究结果相一致,这都提示维生素D参与了HSP的发生与发展,并与肾脏受累有一定关系,血清25(OH)D有可能成为监测[18]HSP患儿是否合并肾脏损害的预测指标。另外何国华的相关研究表明1,25(OH)2D3与VDR结合,借此可以通过保护足细胞;调节肾小球固有细胞的增殖和凋亡,抑制肾小管间质纤维化;抑制炎性细胞活化,减少炎性因子;负性调节血管紧张素系统等多种途径对肾脏起保护作用。Eltablawy等[19]通过对糖尿病肾病模型的实验研究表明,缺乏维生素D受体的小鼠更容易受到高血糖引起的肾损伤,维生素D可以抑制肾素-血管紧张素醛固酮系统,保护肾脏功能。当维生素D缺乏时,适应性免疫被抑制,炎性因子和趋化因子高表达,炎性介质释放,引起血管炎性病变。张向勇[20]的研究发现常规治疗中加入维生素D滴剂的试验组较单纯常规治疗的对照组出现肾脏受累的概率下降了10%,提示补充维生素D治疗对HSP患儿的肾脏具有一定保护作用。因此我们推测HSP患儿尤其是伴有肾脏损害的患儿,是否可以通过提高血清中25(OH)D的水平,从而降低肾脏受累风险,与此同时补充维生素D的最佳剂量和疗程的选择,也有待我们进一步探索。
维生素A也是正常生长和发育所必须的微量营养素之一,它具有多重生理功能,维生素A缺乏可造成夜盲症、免疫功能低下,增加感染性疾病罹患几率[21]。维生素A还可以提高机体的非特异性免疫功能,同时还参与机体特异性免疫[22]。当维生素A缺乏时,单核细胞分泌的白细胞介素-2(IL-2)、干扰素-α(INF-α)均会受到抑制,IL-2减少,T细胞的活化、细胞免疫功均会因此下降[23]。维生素A的主要产物视黄酸在T辅助细胞的分化、功能、归巢及淋巴细胞的发育等方面均有作用。在稳定状态下视黄酸可以调节T细胞的分化,以及Th1和Th17细胞应答;还可通过增强调节性T细胞,平衡Th1和Th2的功能,维持免疫稳态[24]。维生素A也可以通过细胞因子的作用,影响免疫球蛋白的合成,对IgA、IgG、IgM均有促进作用[25]。本研究结果显示HSP组患儿维生素A水平明显低于对照组,表明HSP患儿存在维生素A缺乏,感染也常常是HSP发生的触发因素,维生素A缺乏,患感染性疾病的易感性增高,感染性疾病又会影响机体对维生素A的的吸收利用,临床中是否可以使用维生素A辅助治疗HSP,还需进一步大量临床研究。
本研究结果还显示,HSP患儿血清25(OH)D水平与免疫球蛋白IgA水平呈负相关,与谢桃李[26]研究结果相一致;患儿IgA水平增高,IgA或IgA免疫复合物沉积于小血管壁,造成皮肤等血管内皮损伤[27];因此欧洲抗风湿病联盟会议已将活检示皮肤或肾小球基底膜上IgA[28]类免疫复合物沉积作为HSP的主要诊断标准之一。既往研究也表明,IgA可作为疾病活动期的临床观测指标,在发病期间明显升高,治疗后将至正常水平[29]。邹敏书[30]的研究显示HSP患儿体内存在高表达的滤泡辅助细胞T细胞(Tfh),维生素D通过调节Tfh细胞,间接作用于B细胞,抑制B淋巴细胞分化增殖,诱导凋亡,抑制浆细胞的成熟,也可以直接抑制B细胞产生免疫球蛋白[31]。而本研究显示25(OH)D与IgA呈负相关,可能是25(OH)D不可以直接或间接降低Tfh细胞来抑制免疫球蛋白的产生。
有学者认为补充维生素D可以降低无肾脏损害HSP患儿的HSPN发病率,增加维生素D的摄入也已经在治疗类风湿关节炎和系统性红斑狼疮取得了较好疗效[32,33]。
综上所述,血清25(OH)D水平、维生素A水平与HSP息息相关,25(OH)D水平下降可能作为HSP是否合并肾损害的预测指标,补充维生素AD可能为HSP治疗提供新思路,此类研究较少,尚需大数据前瞻性设计研究进行进一步验证。
