蜘蛛抱蛋(Aspidistra elatior)炭疽病病原菌的分离与鉴定
2021-08-26黄钰婷张慧娟
黄钰婷, 孙 洁, 张慧娟, 朱 晏, 蒋 明
(台州学院 生命科学学院,浙江 台州 318000)
蜘蛛抱蛋(Aspidistraelatior)又名一叶兰、土蜈蚣、苞米兰和箬叶等,为百合科(Liliaceae)铃兰族(Convallarieae)蜘蛛抱蛋属多年生常绿宿根草本[1]。蜘蛛抱蛋叶片硕大、姿态优美、花形奇特,具有较好的观赏价值,常用于盆栽和公园地植[2];蜘蛛抱蛋在光照不良的环境中有较好的固碳释氧和增湿降温能力,且其自然挥发物对金黄色葡萄球菌(Staphylococcusaureus)和黑曲霉菌(Aspergillusniger)等有显著的抑制作用,该植物在室内美化方面具独特的优势[3]。蜘蛛抱蛋的根茎可药用,提取物中富含抗氧化剂和抗菌成分,具有活血化瘀、清热解毒、抗菌消炎等功效[4-5]。笔者调查发现,蜘蛛抱蛋炭疽病的发生十分严重,发病时叶面产生褐色病斑,后逐渐扩大蔓延至整张叶片,影响植株的生长和发育,也影响观赏价值。
植物炭疽病是世界性病害之一,危害多种野生植物和栽培植物,该病主要由炭疽菌属(Colletotrichum)真菌引起,可侵染植物的所有部位,尤其是地上部分[6-8]。近年来,有关蜘蛛抱蛋的研究主要集中在栽培管理、药理作用和化学成分等方面[2,5,9],而与炭疽病相关的研究未见报道。本研究以蜘蛛抱蛋炭疽病病叶为材料,在病原菌的分离、纯化、致病性测定、形态学特征观察的基础上,克隆核糖体转录间隔区(ribosomal DNA internal transcribed spacer,ITS)、肌动蛋白基因(actin,ACT)、3-磷酸甘油醛脱氢酶基因(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)、钙调蛋白基因(calmodulin,CAL),进行多基因联合鉴定,以明确炭疽病病原真菌的种类,为后续开展病害有效防治和致病机理研究提供参考。
1 材料与方法
1.1 样本的采集、病原菌的分离与纯化
蜘蛛抱蛋病叶采自不同的公园和中学校园,共采集到6份样品,带回实验室后置于4 ℃冰箱备用。采用组织分离法分离病原菌,将蜘蛛抱蛋病叶洗净后切成小块,依次用蒸馏水漂洗8 min、1%次氯酸钠漂洗8 min、无菌水清洗2次,置于马铃薯葡萄糖琼脂(PDA)培养基上。28 ℃恒温培养3~5 d后挑取新鲜菌丝,接种于新的PDA培养基中纯化培养。
1.2 形态学鉴定
纯化后的菌丝置于Soptop倒置生物显微镜ICX 41下,观察形态、分生孢子的形状和大小。蜘蛛抱蛋病叶与纯化后的菌丝经干燥处理,用导电胶将菌丝和病叶粘在样品托上,用日立E-1010型离子溅射仪喷金处理,然后置于日立S-4800型扫描电镜中,观察病原菌菌丝形态、孢子特征,以及病叶上菌丝的分布情况。
1.3 致病性测定
采用回接法研究致病性,选取健康的蜘蛛抱蛋叶片,用大量的无菌水清洗,自然晾干后用无菌剪刀剪成大小相同的离体小块;利用无菌接种针刺伤表皮,用无菌打孔器(直径5 mm)切取菌饼,菌丝面朝下,接种于刺伤部位,重复3次,空白对照为无菌PDA圆块,接种后置于28 ℃恒温培养箱中保湿培养。
1.4 病原菌的分子鉴定
1.4.1 基因组DNA的提取
收集培养皿中蜘蛛抱蛋炭疽病病原菌的菌丝,经液氮冷冻后,采用生工生物工程(上海)股份有限公司的真菌基因组DNA快速抽提试剂盒提取DNA,经电泳检测和浓度测定后,将DNA溶液置于-20 ℃冰箱保存备用。
1.4.2 基因片段的克隆
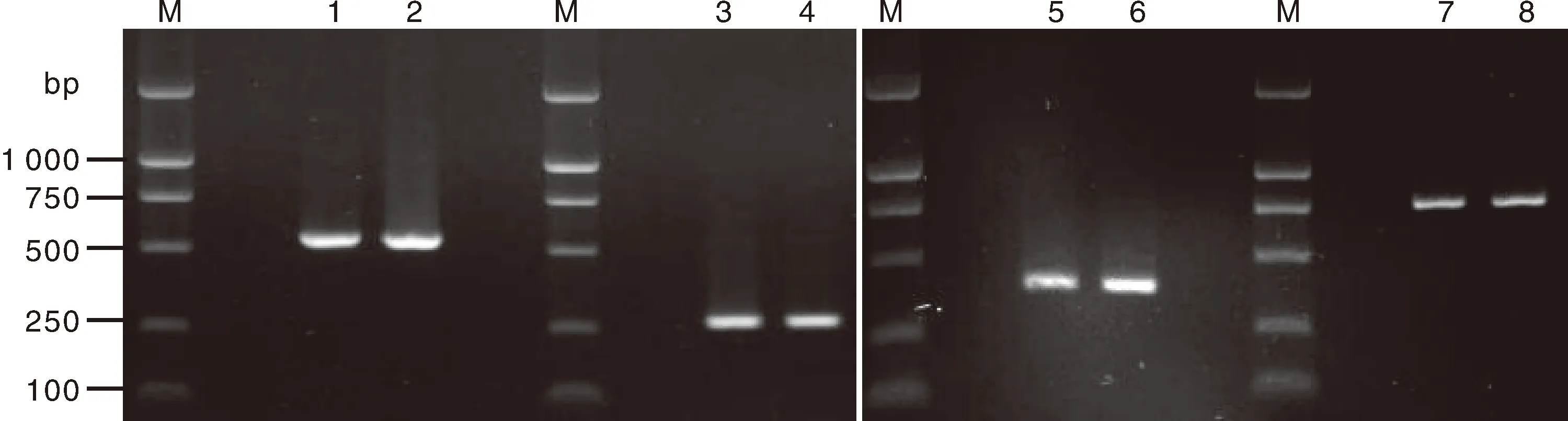
以DNA为模板,采用表1的通用引物[10-11],对ITS、ACT、GAPDH、CAL序列进行PCR条件优化,并获得最适退火温度(表1)。PCR采用20 μL反应体系:16.1 μL ddH2O,2.0 μL 10×buffer,0.5 μL dNTPs(20 mmol·L-1),0.2 μL上、下游引物(20 μmol·L-1),0.5 μL DNA模板(40 ng·μL-1)和0.5 μLTaqDNA聚合酶。PCR扩增程序为:95℃预变性5 min;94℃变性30 s,56.3℃或62.1℃退火45 s,72℃延伸90 s,32个循环;72℃延伸10 min。
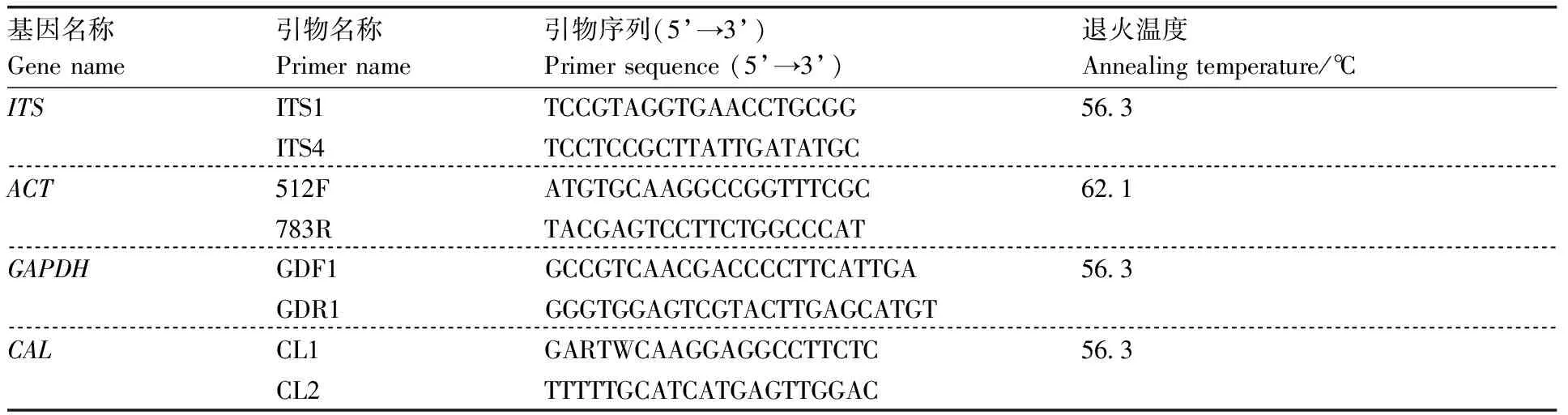
表1 PCR引物和最佳退火温度Table 1 PCR Primers and their optimum annealing temperatures
1.4.3 基因片段的回收、连接和转化
PCR产物经1%凝胶电泳检测后,采用北京鼎国昌盛生物技术有限责任公司的DNA快速回收试剂盒回收各引物对扩增的PCR产物。取3 μL回收产物与pGEM-T Easy载体置于4 ℃冰箱连接过夜,采用热激法将连接产物导入DH5α感受态细胞;涂布培养后,挑选白色单菌落振荡培养12 h,经质粒提取、酶切、菌液PCR检测后,挑选阳性克隆送生工生物工程(上海)股份有限公司测序。
1.4.4 序列分析与系统发育树的构建
根据测序结果,在NCBI数据库(https://www.ncbi.nlm.nih.gov/)中进行同源性搜索并下载序列,利用ClustalX软件进行多重比对,采用默认参数;通过GeneDoc软件生成比对图;用MEGA 3.1软件构建系统发育树,建树方法采用邻接法(neighbour-joining),自举检测(bootstrap)1 000次。
2 结果与分析
2.1 病害症状
在自然条件下,蜘蛛抱蛋叶片患病初期病斑褐色,后逐渐扩大蔓延,形状不规则,病斑中部逐渐发白,但四周仍为褐色,病健交界处可见淡黄色晕圈,最后病斑处出现穿孔,发病严重时导致整个叶片干枯死亡(图1-A、图1-B)。在扫描电子显微镜下,可观察到菌丝通过叶片气孔侵入叶片内部(图1-C)。
A,患病植株;B,病斑特写;C,菌丝通过气孔侵入叶片内部,2 500×。A, Infected plants; B, Leaf lesion; C, Penetration by fungal hyphae through a stomatal pore, 2 500×.图1 蜘蛛抱蛋炭疽病病叶特征Fig.1 Anthracnose symptoms on leaves of Aspidistra elatior
2.2 形态学鉴定
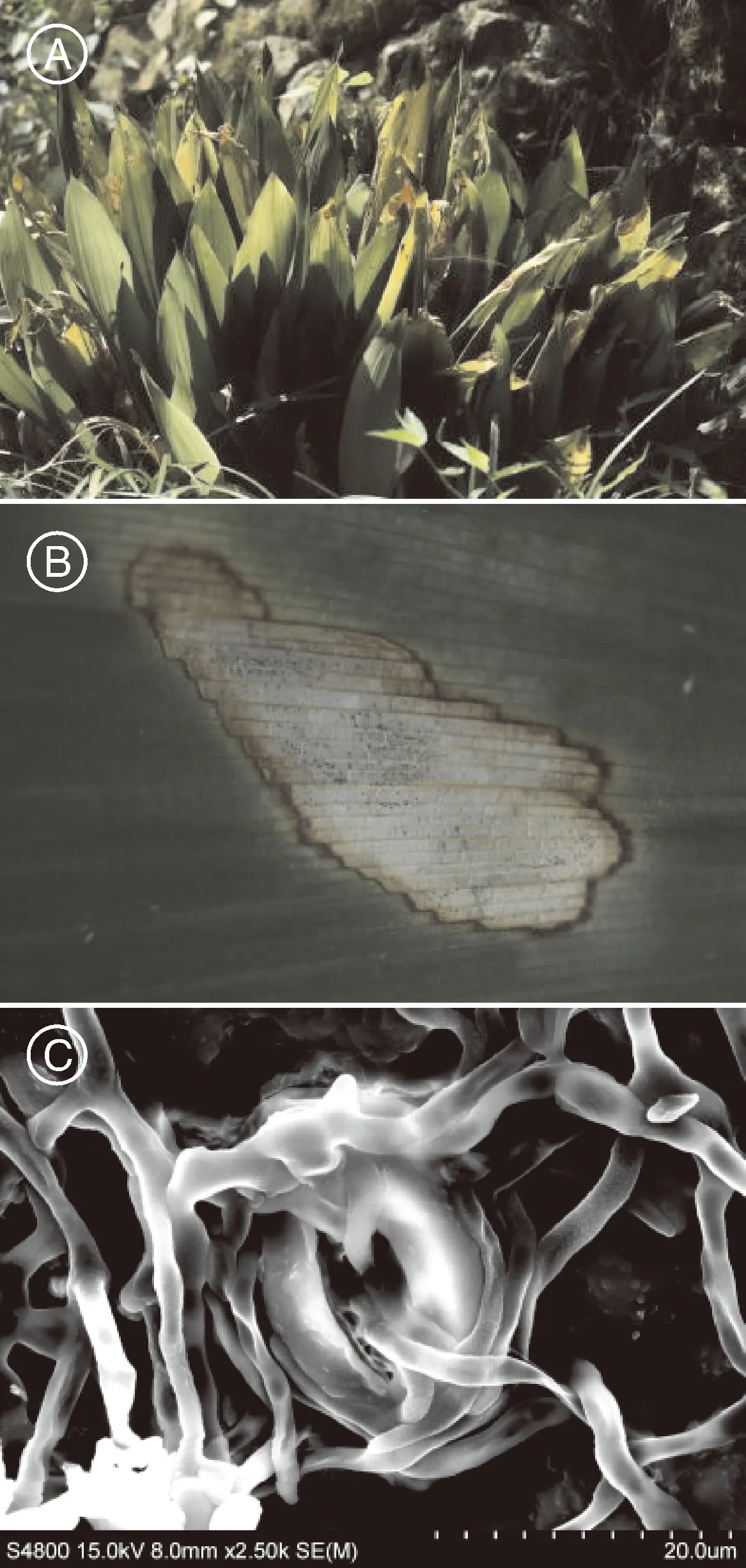
通过对蜘蛛抱蛋炭疽病病原菌的分离和纯化,得到1个真菌菌株,命名为YYL。病原真菌在PDA培养基上培养,菌丝呈放射状,营养菌丝产生色素使培养基中央颜色加深,气生菌丝呈白色绒毛状,菌丝生长速率平均为0.85 cm·d-1(图2-A)。在倒置生物显微镜ICX 41和日立S-4800扫描电子显微镜下可观察到细长菌丝,菌丝表面光滑、弯曲幅度较小,有隔膜;菌丝分支较多且常呈锐角;分生孢子梗顶端有较多分生孢子着生,大分生孢子呈新月形,中央有4~6个油球;小分生孢子近椭圆形,边缘平滑,平均大小约为72 μm × 28 μm(图2-B、图2-C、图2-D)。
A,菌落形态;B,菌丝形态;C,分生孢子形态;D,扫描电子显微镜下菌丝与孢子形态。A, Colonial morphology; B, Hypha morphology; C, Conidia morphology; D, Morphology of hypha and spores under a scanning electron microscope.图2 病原菌YYL的形态特征Fig.2 Morphological characteristics of pathogenic fungus YYL
2.3 致病性
病原菌回接实验结果显示,叶片接种后的发病率为100%。接种培养5 d,叶片伤口处出现直径5~6 mm的褐色病斑,培养11 d时叶片变软,中央部分呈褐色,其余部分变成黄褐色,发病情况与自然条件下一致;对照组叶片没有观察到病斑,叶色无显著变化(图3)。

A,对照;B,接种病原菌的叶片。A, Control; B, Leaf inoculated with pathogenic fungus.图3 致病性检测Fig.3 Pathogenicity detection
2.4 分子鉴定
2.4.1 基因片段的克隆
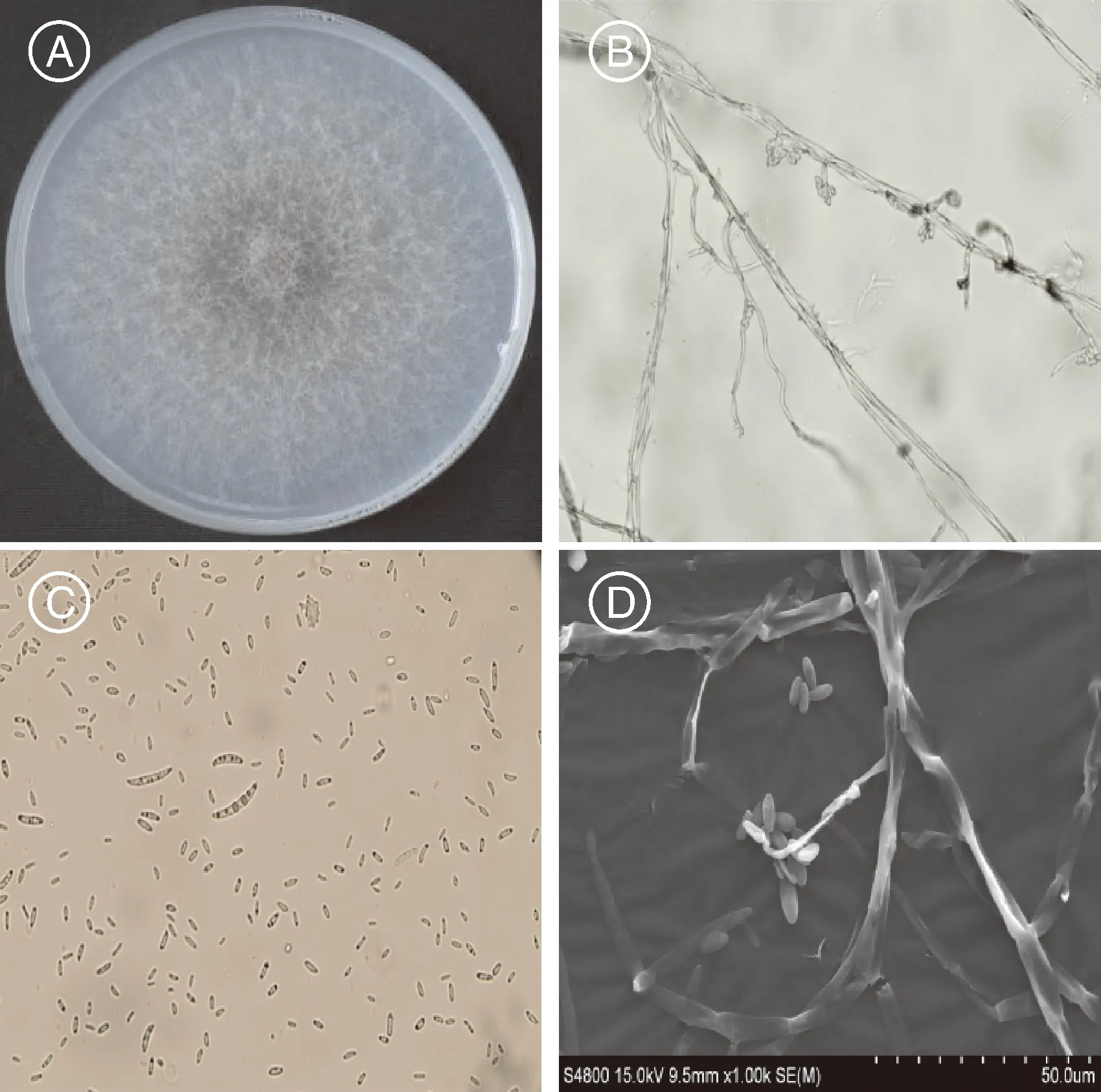
采用ITS、ACT、GAPDH、CAL的通用引物进行PCR扩增,产物经1%凝胶电泳检测均得到单一明亮的特异性条带(图4)。PCR产物经回收、连接、转化和测序,得到各自的DNA序列。结果表明,ITS、ACT、GAPDH和CAL序列长度分别为488、237、259、760 bp。
M, DL 2000 DNA标准分子量;1~2,核糖体内转录间隔区;3~4,肌动蛋白基因;5~6,3-磷酸甘油醛脱氢酶基因;7~8,钙调蛋白基因。M, DL 2000 DNA marker; 1-2, ITS; 3-4, ACT; 5-6, GAPDH; 7-8, CAL。图4 不同基因片段PCR扩增产物凝胶电泳Fig.4 Agarose gel electrophoresis of PCR products about different gene fragments
2.4.2 序列多重比对
将测序结果在NCBI网站中进行BLAST比对,结果显示,病原菌ITS序列与百合炭疽菌(C.lilii)(GU227810)及其近缘种黑线刺盘孢(C.dematium)的序列相似性达100%;ACT序列与百合炭疽菌(GU227908)相似度达99.16%;ClustalX等软件多重比对结果显示,仅在第144、173个碱基位点发生颠换(图5);GAPDH序列与百合炭疽菌(GU228202)相似度达100%;NCBI没有百合炭疽菌的CAL序列,但其近缘物种黑线刺盘孢(GQ849455)与蜘蛛抱蛋YYL的CAL序列相似性高达99.71%。
2.4.3 系统发育树的构建
从NCBI数据库中分别下载ITS、ACT、GAPDH和CAL的同源序列,采用邻接法构建系统发育树。YYL-ITS及其同源序列的系统发育树中,10种病原菌可分为7支,其中,YYL、百合炭疽菌和黑线刺盘孢在同一分支,支持率为89%(图6-A);YYL-ACT及其同源序列在系统发育树上可分为5支,YYL和百合炭疽菌聚于一支(图6-B);基于GAPDH构建的系统发育树上,YYL也与百合炭疽菌聚为一组,支持率达92%(图6-C);YYL-CAL及其同源序列的系统发育分析结果显示,10种病原菌可分为6组,YYL和黑线刺盘孢处于同一分支,亲缘关系最近(图6-D)。
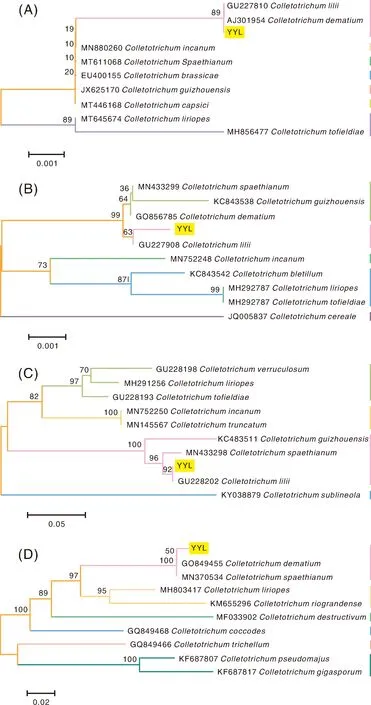
A,核糖体内转录间隔区;B,肌动蛋白基因;C,3-磷酸甘油醛脱氢酶基因;D,钙调蛋白基因。MH292787,Colletotrichum liriopes;MH292784,C. tofieldiae;KC843542,C. bletillum;MN752248,C. incanum;GU227908,百合炭疽菌;MN433299,白蜡树刺盘孢;GQ856785,黑线刺盘孢;KC843538,贵州刺盘孢;JQ005837,C. cereale。A, ITS; B, ACT; C, GAPDH; D, CAL. MH292787, Colletotrichum liriopes; MH292784, C. tofieldiae; KC843542, C. bletillum; MN752248, C. incanum; GU227908, C. lilii; MN433299, C. spaethianum; GQ856785, C. dematium; KC843538, C. guizhouensis; JQ005837, C. cereale.图6 基于基因片段及其同源序列构建的系统发育树Fig.6 Phylogenetic tree based on gene fragments and their homologous sequences
3 结论与讨论
炭疽菌属真菌分布广泛,危害多种栽培植物,如西瓜(Citrulluslanatus)、火龙果(Hylocereusundulatus)、核桃(Juglansregia)和油茶(Camelliaoleifera)等[11-14]。菌落、菌丝、分生孢子梗、分生孢子等的形态特征可用于炭疽病病原菌的鉴定,连金番等[15]根据危害症状、菌落特征和病原菌形态特点,明确了大豆平头炭疽菌(C.truncatum)为宁夏引黄灌区春大豆(Glycinemax)炭疽病的病原菌;炭疽菌的形态特征易随培养条件改变,三角梅(Bougainvilleaglabra)和火龙果炭疽病的病原菌均为胶孢炭疽菌(C.gloeosporioides),两者分离得到的菌株在PDA培养基上的菌落、气生菌丝和分生孢子的形态、颜色均不相同,因此需要其他手段辅助鉴定[16-17]。真菌ITS区保守性较高,利用ITS序列生成的系统发育树可以对大多数物种进行正确分组,但对部分物种的鉴定存在分辨率不高的现象[18]。炭疽菌属真菌种类繁多,对它们进行正确识别有助于病害防治和机理研究,但单纯使用ITS序列无法对所有物种进行正确鉴别[19]。本研究中,YYL-ITS与黑线刺盘孢和百合炭疽菌的相似性达100%,仅用ITS序列无法确定该菌株的归属。
形态学特征结合多基因序列的方法被广泛应用于炭疽菌的分类识别,近年来有大量的炭疽病病原菌得以鉴定[20]。帅小春等[21]采用ITS、CAL、GAPDH、ACT和TUB基因片段结合形态学特征,将油茶炭疽病植株中分离的菌株鉴定为3种炭疽菌,它们是哈瓦炭疽菌(C.kahawae)、果生炭疽菌(C.fructicola)和山茶炭疽菌(C.camelliae)。樊改丽[22]利用显微结构、菌落特征和多基因比对,认为大叶棕竹(Rhapisexcelsa)炭疽病的病原菌为暹罗刺盘孢菌(C.siamense)。徐婧等[23]结合形态和多基因分子数据,确定引起高粱(Sorghumbicolor)炭疽病的致病菌为亚线孢炭疽菌(C.sublineolum)。本研究中,YYL的菌落、菌丝和分子孢子等符合百合炭疽菌特征,YYL的ITS、ACT和GAPDH与百合炭疽菌在发育树上均聚于一组,虽然NCBI没有百合炭疽菌CAL序列,但YYL-CAL与其近缘种黑线刺盘孢聚于一组。
本研究分离纯化了蜘蛛抱蛋炭疽病病原菌,并开展了致病性、形态特征与多基因联合鉴定,初步确定该病原菌为百合炭疽菌,为后续开展病害有效防治和致病机理研究奠定了基础。
