柳树病叶的傅里叶变换红外光谱研究
2016-04-19刘艳司民真李伦张德清
刘艳,司民真,李伦,张德清
(1.云南师范大学物理与电子信息学院,昆明 650500;2.楚雄师范学院云南省高校分子光谱重点实验室,楚雄 675000;
3.楚雄师范学院光谱应用技术研究所,楚雄 675000)
柳树病叶的傅里叶变换红外光谱研究
刘艳1,司民真2,3*,李伦2,3,张德清2,3
(1.云南师范大学物理与电子信息学院,昆明650500;2.楚雄师范学院云南省高校分子光谱重点实验室,楚雄675000;
3.楚雄师范学院光谱应用技术研究所,楚雄675000)
摘要:利用傅里叶变换红外(FTIR)光谱技术对三种柳树正常叶和病叶,同一枝条的幼叶、成叶、黄叶、病叶进行光谱测试,旨在分析柳树病叶发生的一些生理变化,并探讨柳树病变对系统聚类的影响。谱图显示不同阶段的叶片光谱变化主要在1800~800 cm-1。对此波段进行二阶导数处理,清晰可看到蛋白质和木质素的叠加区域1700~1500 cm-1,草酸钙特征峰1621、1318 cm-1,糖类特征峰1075 cm-1附近峰强有明显变化,用吸光度比A1621/A3390、A1318/A3390、A1075/A3390来比较草酸钙和糖类相对含量变化,用1700~1500 cm-1波段的拟合峰面积比S酰胺I/S木质素、S酰胺Ⅱ/S木质素和S酰胺Ⅱ/S酰胺I来比较蛋白质相对含量变化。结果显示,病叶的草酸钙相对含量增加、多糖和蛋白质相对含量在减少。将叶片1800~800 cm-1范围的二阶导数进行系统聚类,发现病叶化学成分的改变没有影响聚类效果,聚类正确率达100%。
关键词:傅里叶变换红外光谱; 聚类分析; 吸光度; 病叶
1引言
柳树是杨柳科( Salicaceae)柳属( Salix )植物的通称,为木本植物。柳属植物具有繁殖易、用途广、生长快等特点,是重要的园林绿化植物,也是优良的防护、蜜源、造纸、建筑树种,如旱柳、白柳和垂柳等。从目前关于柳树的利用来看,已从以前的木材生产转变为景观植物的种植和药用产品的生产[1]。傣医学里用柳属植物主治腹痛腹泻、疥癣、皮肤瘙痒、 湿疹、斑疹[2];中医药学里用柳属植物主治急慢性肝胆炎、结石、痔疮、烫伤、梅毒、跌打损伤[3]。阿斯匹林的解热镇痛神效广泛应用于医学,而它的发明起源于随处可见的柳树。据报道,柳树中广泛存在解热镇痛的水杨苷及其衍生物活性物质,其中在垂柳叶片中,含量可高达3%~4%[4]。其次,柳叶具有丰富的鞣质和碘,清热解毒,是治疗地方性甲状腺肿大的良药。民间医药学中,人们将常见的垂柳叶捣碎外敷,来治疗足跟疼痛,然而,柳叶在成长过程中会发生一些病变,病变过程中化学成分就会相应受到影响,从而发生一些复杂的生理变化,这些病变直接影响到植物的观赏价值,但不知是否会影响到药效?能否利用红外光谱来找出病变叶发生的一些变化?本文基于FTIR对柳叶的病变做一个基础研究,选用最常见、观赏及药用价值极高的垂柳、白柳、旱柳来测试红外光谱,对其化学成分如蛋白质、草酸钙、多糖的变化做一个对比,以期为柳属植物的采集及疾病控制提供参考。
2实验部分
2.1实验仪器
红外光谱仪为PerkinElmer公司的Frontier傅里叶变换红外光谱仪,扫描范围4000~400 cm-1,分辨率4 cm-1,扫描次数16次。
2.2样品制备、检测及数据处理
垂柳正常叶、白柳正常叶、旱柳正常叶、垂柳病叶、白柳病叶、旱柳病叶,三个不同品种柳树共36个样本;垂柳同一时期同一枝条上的幼叶、成叶、黄叶、病叶,共40个样本。76个样品均采自于云南师范大学。样品清洗后晾干,取相同部位进行研磨成粉末,加入溴化钾搅磨均匀,压片测红外光谱。光谱均扣除溴化钾背景,光谱数据用Omnic 8.0软件处理,经过基线校正、9点平滑、归一化处理。用软件Origin 8.5画光谱图及进行曲线拟合处理,用SPSS Statistics 20软件进行聚类分析。
3结果与分析
3.1柳叶的光谱峰归属
图1是三种柳树的正常叶和病叶的红外光谱图。3390 cm-1附近为O-H、N-H伸缩振动,来自于多糖和蛋白质[5];2921 cm-1、2852 cm-1主要来自C-H反对称伸缩振动、对称伸缩振动吸收[6]。在1700~1200 cm-1范围内以及在780 cm-1附近有多个峰存在,表明柳叶中有黄酮类化合物[7]。其中1730 cm-1附近为C=O伸缩振动;1621 cm-1附近的吸收峰来自草酸钙中的芳香环骨架振动吸收;1425 cm-1的吸收峰可能包含C-H弯曲振动吸收以及C-O伸缩振动吸收[8]。根据文献[9],在2927、2854、1626、1045 cm-1附近有吸收峰出现,表明有β-谷甾醇。1300~950 cm-1范围主要为各类C-O伸缩振动吸收峰,说明有萜类物质[8]。其中1318 cm-1附近是草酸钙中C-O键的对称伸缩振动;1253 cm-1附近的弱峰为C-O-C骨架振动以及酰胺Ⅲ的贡献[10];1075 cm-1附近为糖类C-O振动吸收区;782 cm-1为草酸钙中C-O键的弯曲振动。在3390、1318、1253、1075 cm-1附近有吸收峰出现,表明有羟基、甲氧基苯环的存在[8],推断出是水杨苷的特征峰。对照李伦等[11]的草酸钙图谱,柳叶在1621、1318、782 cm-1附近均有吸收峰出现。由以上红外谱峰的结构特征得知,柳叶中含有黄酮类、萜类、水杨苷、β-谷甾醇、草酸钙等化合物,这和赵红娟等[12]的结论相吻合。
3.2柳树正常叶和病叶的光谱差异
从图1可看出图谱峰位、峰形大体相似,但在1800~800 cm-1范围三种柳树的正常叶和病叶的光谱峰强有区别,为了进一步观察正常叶和病叶间的差异,将1800~800 cm-1范围进行二阶导数处理(见图2),以增加图谱的分辨率。图1中,对比草酸钙的特征峰1621、1318 cm-1和糖类特征峰1075 cm-1处的峰强,6种叶片差异明显。用吸光度比值法A1621/A3390、A1318/A3390、A1075/A3390来定义草酸钙、糖相对含量的变化[11]。垂柳正常叶A1621/A3390、A1318/A3390、A1075/A3390为0.07、0.08、0.17,垂柳病叶0.14、0.55、0.04,白柳正常叶0.118、0.092、0.75,白柳病叶1.355、1.164、0.64,旱柳正常叶0.434、0.069、1.12,旱柳病叶0.872、0.10、0.96。正常叶的吸光度比值A1621/A3390、A1318/A3390均低于病叶,而A1075/A3390比值均高于病叶。相对强度的差异说明,病叶的草酸钙含量多于正常叶,糖类相对含量少于正常叶。

Fig.1FTIR spectra of different salix leaf. a: weeping willow leaf normol,b: Bailiu normol leaf,c: normal leaf plants,d: weeping willows disease leaves, g: Bailiu disease leaves, f: plants disease leaves
图2中,二阶导增大了图谱间的差异,可清晰地看出,在1620 cm-1、1318 cm-1附近垂柳病叶比垂柳正常叶、白柳正常叶、白柳病叶、旱柳正常叶和旱柳病叶峰值强,说明不同品种的柳叶草酸钙含量不一样,其中,垂柳病叶的草酸钙含量最高。叶片在1604 cm-1、1514 cm-1、1454 cm-1等处峰强较强,结合1740 cm-1、1660 cm-1附近的羰基吸收峰,说明其中黄酮类物质较多[8]。1700~1500 cm-1波段(虚线框出的区域)为酰胺I带和木质素叠加区域,差异明显,因此采用曲线拟合技术对6种叶片在1700~1500 cm-1波段进行分峰拟合,见图3(选取具有典型性光谱特征垂柳正常叶(a)和病叶(b)作为光谱代表),用子峰的相对面积来考察蛋白质的含量差异。
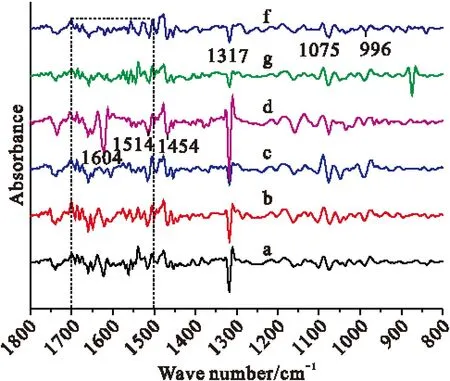
Fig.2Different salix leaf of the second derivative spectra(1800~800 cm-1). a: weeping willow leaf normol,b: Bailiu normol leaf,c: normal leaf plants,d: weeping willows disease leaves,g: Bailiu disease leaves,f: plants disease leaves

Fig.3 Curve fitting figure(1700~1500 cm-1). (A)weeping willow leaf normol,(B) weeping willows disease leaves
利用origin8.5软件进行分峰拟合得到四个子峰:1556、1595、1618、1655 cm-1,1655 cm-1附近的峰主要是蛋白质酰胺I带,1556 cm-1附近的峰主要是蛋白质酰胺Ⅱ带,1595 cm-1附近是木质素的吸收峰,1618 cm-1是草酸钙的吸收峰。定义用吸收峰面积比S酰胺I/S木质素、 S酰胺Ⅱ/S木质素和S酰胺Ⅱ/S酰胺I来判断叶片中蛋白质相对含量的变化[11],列于表1。
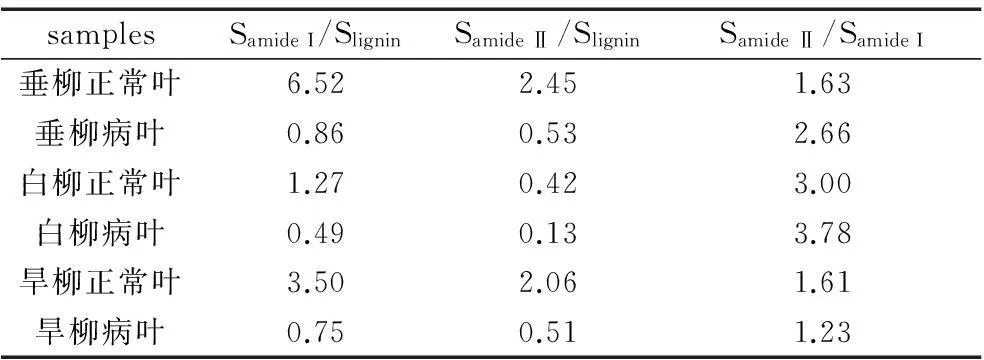
Table.1 Sub peak area ratio for disease leaves and normal
从表1中可以得出,三种柳树正常叶的Samide I/Slignin、Samide Ⅱ/Slignin的比值均高于病叶,且正常叶的比值均大于1,病叶的比值均小于1,说明正常叶的蛋白质相对含量多于病叶,且正常叶中蛋白质相对含量多于木质素,病叶中木质素相对含量多于蛋白质。其次,垂柳的正常叶和病叶Samide I/Slignin、Samide Ⅱ/Slignin均高于白柳和旱柳的正常叶和病叶,且6种叶片Samide Ⅱ/SamideI的比值均大于1。由以上的分析表明:(1)病叶的蛋白质含量很少,木质素较多。(2)三种柳树中,垂柳的蛋白质相对含量是最多的。(3)柳树叶片中蛋白质酰胺Ⅱ带的相对含量多于酰胺I 带。
通过以上的分析,由三种柳树正常和病变叶的对比得出:相对于健康叶片,柳树病叶草酸钙和木质素相对含量较多,糖类和蛋白质相对含量较少。
3.3同种柳叶成长及病变的光谱变化
三种柳树的红外谱图及化合物相对含量大体相似,因此选用观赏价值极高、分布广泛的垂柳作为研究对象,取同一时期、同一枝条上的幼叶、成叶、老叶、病叶来采集光谱。随着叶片成长到病变,叶片会发生一些生理变化,如蛋白质、草酸钙、多糖会被消耗、降解和转移[11],因此,这些变化将会引起红外谱图的变化,见图4。图4是垂柳幼叶、成叶、老叶、病叶的红外光谱,不同生长期的谱峰位置大体相似,但有一些特征峰的强度和峰位有变化。在1620 cm-1附近,幼叶、黄叶的峰出现在1609 cm-1,移了11个波数;在1075 cm-1附近,幼叶出现了两尖峰;不同生长时期,1318 cm-1附近的峰强明显不同。从幼叶到病叶,吸光度比A1621/A3390、A1318/A3390、A1075/A3390为:幼叶(0.036、0.04、0.34),成叶(0.84、0.77、0.15),老叶(0.053、0.027、0.06),病叶(0.224、0.167、0.02),从比值的变化看出,叶片在成长过程中,草酸钙含量先增加后减少,糖类一直在减少;发生病变时,草酸钙含量很高,糖类始终在减少,这可能是以多糖的消耗转化来满足旺盛部位的营养需求而导致的[11]。
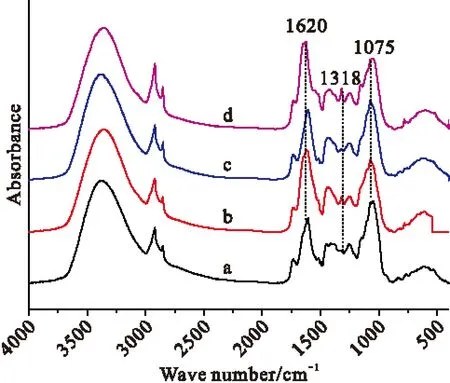
Fig.4IR spectra of the different stages of willow. a:young b:mature c:old d: disease leaves
选取特征区域1800~800 cm-1波段进行二阶导数处理,见图5,发现成叶(图5b)、病叶(图5d)的1318 cm-1强度明显高于幼叶和老黄叶。1075 cm-1在成长过程中强度逐渐降低,和吸光度比值结论相一致。对图5虚线框出的区域,1700~1500 cm-1进行曲线拟合,拟合曲线见图6。

Fig.5Different stages of the second derivative spectra willow(1800~800 cm-1).a: young,b: mature,c: old,d: disease leaves
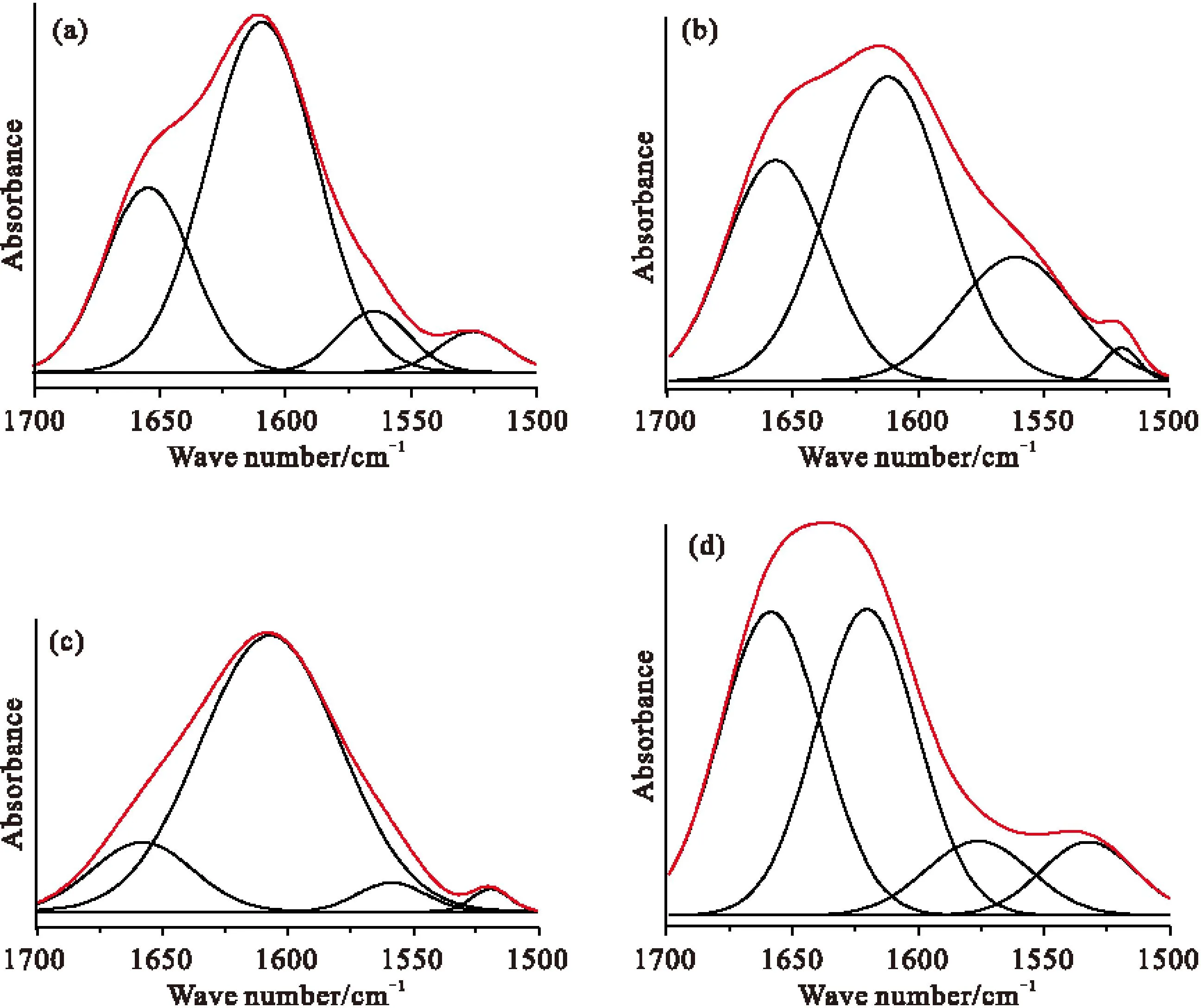
Fig.6 Curve fitting figure(1700~1500 cm-1).(a)young,(b)mature,(c)old,(d)disease leaves
幼叶、成叶、黄叶、病叶的曲线拟合得到1654、1609、1564、1519 cm-1附近四个子峰,相对面积见表2。从表2中可以得出,相对子峰面积之比均大于1,且幼叶、成叶、老叶的Samide I/Slignin、Samide Ⅱ/Slignin、Samide Ⅱ/Samide I的比值一直在增大,到了病叶,比值急剧减小。由此说明:(1)垂柳叶片在成长过程中,蛋白质相对含量逐渐在增多,说明蛋白质在老黄叶中有积累,且酰胺Ⅱ的相对含量多于酰胺 I的相对含量。(2)当叶片发生病变后,蛋白质相对含量在减少,说明蛋白质可能发生了转移。(3)叶片成长过程和发生病变过程,蛋白质相对含量始终大于木质素相对含量。

Table.2 Sub peak area ratio for young,mature,old,and disease leaves
通过以上的分析,由垂柳幼叶、成叶、老叶、病叶的对比得出:处于不同阶段的柳叶,草酸钙含量先增加后减少再增加,糖类含量一直在减少,蛋白质含量增加后再减少。
3.4聚类分析
柳叶病变引起了一些化学成分的变化,致红外谱峰有所差异,现将样品进行聚类分析,来研究病变叶是否影响聚类效果。聚类时将三种柳树的成叶和病叶放在一起聚类,再将一种柳树的幼叶、成叶、黄叶和病叶放在一起聚类。选取样本二阶导数光谱在1800~800 cm-1范围的吸光度值,使用系统聚类(HCA)法,采用余弦距离进行聚类分析。聚类结果如图7、8所示。
图7中,在距离7左右,垂柳正常叶、垂柳病叶、白柳正常叶、白柳病叶、旱柳正常叶、旱柳病叶聚为六类,36个样品均被区分,每种柳树的6个样品均聚在一块,聚类正确率达100%。说明发生病变的叶片并没有影响到不同种柳树的聚类,且系统聚类分析对六种柳叶样本有很好的聚类作用。
图8中,在距离4左右,幼叶、成叶、黄叶、病叶全部被区分开,成叶、黄叶、病叶的10个样本都聚在一起,幼叶有两个样本被混聚在成叶中,两个样本混聚在黄叶中,一个样本单独聚类。相比之下,幼叶聚类效果不太好,原因可能是幼叶生长比较快,生长过程中蛋白质、多糖等化合物变化较快,不稳定,从而影响了聚类,而病叶聚类正确率达100%。
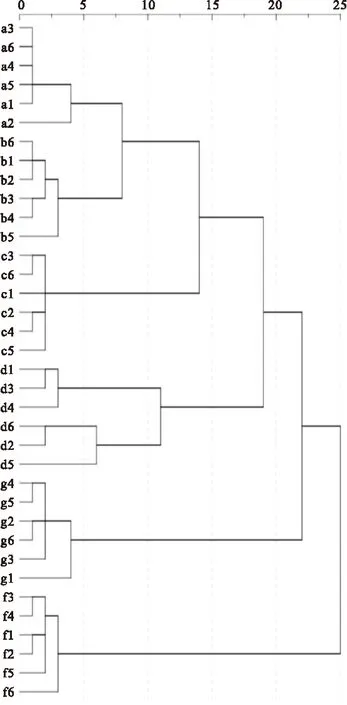
Fig.7Normal leaf and second derivative spectra of diseased leaves in 1800~800 cm-1range of cluster diagram
4结论
本文利用傅里叶变换红外光谱(FTIR)法对柳叶共76个样品进行了光谱测试,结果显示,柳叶发生病变以后,红外光谱的变化主要在蛋白质的吸收区1700~1500 cm-1、草酸钙特征峰和糖类特征峰。正常叶和病叶、不同阶段的柳叶峰位、峰强及吸光度比值、曲线拟合相对面积比的变化及差异,反映了病叶的蛋白质、糖类、草酸钙等化合物发生了一些消耗、降解等复杂的生理变化,而使相应化合物的相对含量发生变化。对1800~800 cm-1波段的二阶导数进行系统聚类,发现病叶没有因为化合物的变化而影响聚类效果,但是否会影响到药效,这有必要进行下一步的研究。
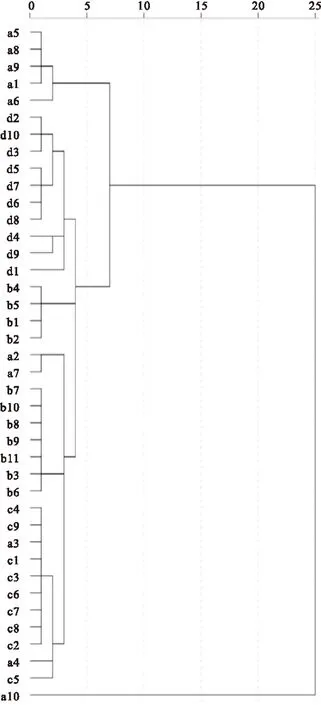
Fig.8Different stages of the second derivative spectra willow(1800~800 cm-1)of cluster diagram
参考文献
[1]赵能,龚固堂,刘军. 杨柳科植物的分类与分布[J]. 四川林业科技,1998,19(4): 9-20.(Zhao Neng,Gong Gutang,Liu Jun. On the classification and distribution of the family salicaceae[J]. J Sichuan Fores Sci Tech,1998,19(4): 9-20.)
[2]宋娜丽,包照日格图,却翎等. 傣医药学与中医药学对水杨柳比较研究[J]. 中国民族医药杂志,2008 (2): 44-45.(Song Lina,Bao Zhao Rigetu,Que Ling,etal. A comparative study of Dai medicine and traditional Chinese medicine on Homonoia riparia Lour[J]. J Med Pharm Chin Minor,2008 (2): 44-45.)
[3]国家中医药管理局《中华本草》编委会. 中华本草: 第十二卷[M]. 上海: 上海科学技术出版社,2005: 824~825.(The State Administration of traditional Chinese medicine "Chinese Materia Medica" editorial board. Chinese herbal medicine: 12 volume[M]. Shanghai: Shanghai science and technology press,2005: 824- 825.)
[4]Pearl IA,Darling SF. Barks of the familySelicaceae.XXVIII.leaves of the family Salicaceae.XV. Stuctures of salicortin and tremulacin[J]. Phytochemistry,1971,10(12): 3163-3166.
[5]Yang H,Irudayaraj J,Paradkar M M. Discrinant analysis of edible oils and fats by FTIR,FT-NIR and FT-Raman spectroscopy [J]. Food Chem,2005,93(1): 25-32.
[6]Jeta V K,Chelsey L C,Andrew P. Measurement of Conjugated Linoleic Acid(CLA) in CLA-rich potato chips by ATR-FTIR spectroscopy[J]. J Agric Food Chem. 2011,59: 2190-2196.
[7]金向军,李晓萍,刘志强,等. 傅里叶变换红外光谱用于朝鲜淫羊藿的品质分析[ J]. 光谱学与光谱分析,2006,26( 4): 614- 616. (Jin Xiangjun,Li Xiaoping,Liu Zhiqiang,etal. Identification of Epimedium oreanum Nakaiby Fourier transfer infrared spectroscopy[ J].Spectrosc Spect Anal,2006,26( 4): 614- 616.)
[8]孙素琴,周群,陈建波. 中药红外光谱分析与鉴定[M]. 北京:化学工业出版社,2010. (Sun Suqing,Zhou Qun,Chen Jianbo. Analysis and identification of infrared spectra of Chinese traditional medicine[M]. Beijing: Chemical Industry Press,2010.)
[9]钱俊红,许文林. 混合甾醇中β-谷甾醇和豆甾醇的红外光谱法分析测定[J].光谱学与光谱分析,2003,4 (23): 692-696. (Qian Junhong,Xu Wenlin. Determination of the Content of J-sitosterol and Stigmasterol in Phytosterol by IR Spectra Method[J]. Spectrosc Spect Anal,2003,4 (23): 692-696.)
[10]Gorjulu S T,Dogan M,Severcan F. The characterization and differentiation of higher plants by Fourier transform infrared spectroscopy[J]. Appl Spectros,2007,61( 3): 300-308.
[11]李伦,周湘萍,刘刚,等. 常绿树叶自然衰老的红外光谱研究[J]. 光谱学与光谱分析,2013,33(2): 340-343. (Li Lun,Zhou Xiangping,Liu Gang,etal. Infrared spectroscopic study 0n leaf senescence of evergreen tree[J]. Spectrosc Spect Anal,2013,33(2): 340-343.)
[12]赵红娟,韩立芹,张晶等. 柳属植物化学成分研究概况[J]. 中国野生植物资源,2010,29(3): 10-14. (Zhao Hongjuan,Han Liqin,Zhang Jing,etal. Study on the chemical constituents of salix[J]. Chinese Wild Plant Resources,2010,29(3): 10-14.)
Study of Willow Diseased Leaves by Fourier Transform Infrared Spectroscopy
LIU Yan1,SI Min-zhen2,3*,LI Lun2,3,ZHANG De-qing2,3
(1.SchoolofPhysicsandElectronicInformation,YunnanNormalUniversity,Kunming650500,Yunnan,China;2.YunnanKeyLaboratoryofuniversitiesforMolecularSpectrum;3.Instituteofspectralappliedtechnology,ChuxiongNormalUniversity,Chuxiong675000,China)
Abstract:Using Fourier transform infrared (FTIR) spectroscopy of three willow leaf and leaf disease,the young leaves of the same branch and leaves,yellow leaves,leaf disease spectrum testing,aims to analyze the willow leaf disease of some physiological changes,to explore the effect of disease leaves on the clustering of the system. Infrared spectroscopy blade at different stages of major change in 1800~800 cm-1,this bands second derivative processing,you can clearly see the superimposed region of the protein and lignin 1700~1500 cm-1,characteristic peaks of calcium oxalate 1621,1318 cm-1,characteristic peaks carbohydrate peak near 1075 cm-1strong there are significant changes,with absorbance ratio A1621/A3390,A1318/A3390,A1075/A3390to compare the relative content of calcium oxalate and sugar,with 1700~1500 cm-1band fitting peak area ratio Samide I/Slignin,SamideⅡ/Sligninand SamideⅡ/Samide Iused to compare the relative amounts of the protein. The results showed that the relative contents of calcium oxalate in the diseased leaves were increased,and the relative contents of polysaccharide and protein decreased. The blade 1800~800 cm-1range of the second derivative of systematic cluster found diseased leaves change did not affect the chemical composition of the clustering effect,clustering correct rate of 100%.
Key words:FTIR; Hierarchical cluster analysis; dbsorbance ratio; diseased leaves
中图分类号:O657.37
文献标志码:A
doi:10.13883/j.issn1004-5929.201601014
文章编号:1004-5929(2016)01-0084-07
作者简介:刘艳(1990-),女,云南,在读硕士,主要从事生物光谱学方面研究. E-mail: 340596704@qq.com通讯作者:司民真,E-mail:siminzhen@hotmail.com
基金项目:国家自然科学基金(13064001,10864001)
收稿日期:2015-08-15; 修改稿日期: 2015-09-10
