肾胺酶减轻高糖诱导的足细胞损伤
2021-08-26张芳菲尹建永汪年松
赵 婷, 张芳菲, 尹建永, 汪年松,2, 王 锋,2*
1. 上海交通大学附属第六人民医院肾内科,上海 200030 2. 上海市第八人民医院肾内科,上海 200235
糖尿病是一种常见的代谢性疾病,其特征为患者血糖长期高于标准值。2019年,全世界有4.63亿成人患糖尿病;国际糖尿病联合会估计,到2045年全世界范围内将有成年7亿糖尿病患者[1]。糖尿病肾病(diabetic nephropathy, DN)是糖尿病的严重并发症,是终末期肾脏疾病的主要原因[2-3]。DN的早期病理变化涉及多种机制,包括小血管病变、肾小球肥大、肾小球基底膜(glomerular basement membrane,GBM)增厚和肾小管损害,随着病程进展,最终出现肾小球硬化和肾小管间质纤维化。足细胞是肾小球滤过屏障的关键组成部分,实验与临床研究[4-5]均表明,肾小球足细胞损伤是导致糖尿病肾小球硬化症的主要机制。目前DN的治疗措施有限,血糖控制和血压控制只能部分缓解DN进展,因此,迫切需要寻找DN的治疗新靶点和药物。
肾胺酶是2005年耶鲁大学华人学者Xü等[6]发现的一种黄素蛋白,主要表达在肾脏和心脏,结构中含有单胺氧化酶结构域,可分解儿茶酚胺,调节血压与心血管功能[7]。以往研究[8]表明,肾胺酶对啮齿动物有强大而快速的降压作用,可降低心脏的收缩力和心率,提示肾胺酶这种作用可能通过降解循环儿茶酚胺而介导。
除了作为酶发挥作用,肾胺酶还有细胞与组织保护功能[9-10],在多种急性和慢性肾脏疾病的动物模型中均显示抗凋亡和抗炎作用,可减轻肾脏损伤[11-13]。肾胺酶在完全单侧输尿管梗阻模型和5/6肾切除模型中显著减轻慢性肾脏病(chronic kidney disease, CKD)纤维化[12,14],参与局部和远程缺血预处理对急性肾损伤的保护作用[15-16]。肾胺酶缺失的肾缺血再灌注(ischemia/reperfusion, IR)的小鼠炎症和细胞凋亡增加及显著肾小管坏死;而重组肾胺酶能改善这些变化[17]。本课题组以往研究[18]发现,用肾胺酶进行预处理,可减轻对比剂诱发的肾病大鼠(contrast-induced nephropathy,CIN)肾功能的恶化,减轻肾小管坏死、氧化应激、细胞凋亡和炎症。另有研究[19]发现,肾胺酶可改善单侧输尿管梗阻(unilateral ureteral obstruction,UUO)大鼠的肾间质纤维化,通过抑制氧化应激来发挥抗纤维化作用。然而,肾胺酶对高糖诱导的足细胞损伤是否有减轻作用尚未明确。本研究通过高糖培养足细胞并补充肾胺酶,来探讨肾胺酶对高糖诱导的足细胞损伤的作用及其可能的机制。
1 材料与方法
1.1 细胞来源 条件性永生的小鼠足细胞MPC5细胞系由复旦大学儿童医院徐虹教授友情赠送。
1.2 主要试剂 RPMI1640培养基购于美国Thermo Fisher Scientific公司;胎牛血清(FPS,Fetal Bovine Serum)购于美国Gibco公司;甘露醇购于美国Sigma-Aldrich公司;反转录试剂盒M-MLV Reverse Transcriptase购于美国Promega公司;实时荧光定量PCR试剂盒购于美国Thermo Fisher Scientific公司;Trizol购于美国Invitrogen公司;SYBR Green PCR预混液购于TaKaRa公司;StepOnePlus PCR Systems购于美国Applied Biosystems公司;caspase-3活性检测试剂盒购于碧云天公司;Ⅳ型胶原α酶联免疫吸附测定(enzyme linked immunosorbent assay,ELISA)试剂盒购于美国Cloud-Clone公司;转化生长因子β1(transforming growth factor β1,TGF-β1)及单核细胞趋化因子1(monocyte chemoattractant protein 1,MCP-1)ELISA试剂盒均购于美国R&D Systems公司;p21 ELISA试剂盒购于英国Abcam公司;重组肾胺酶由本实验室制备[20]。
1.3 细胞处理 足细胞先于33℃、5% CO2培养箱中扩增性培养5 d:用含10 U/mL γ-干扰素的RPMI1640完全培养基(含10%灭活FBS、100 U/mL青霉素和0.1 g/L链霉素)培养细胞。培养瓶内铺0.1 g/L Ⅰ型胶原并于37℃培养箱孵育1 h,将上述扩增性培养的细胞接种到培养瓶,且培养基不含干扰素,于37℃、5% CO2培养箱中培养14 d,促其分化成熟。具体培养方法参考相关文献[21-22]。
将同步化处理(1% FBS培养24 h)的分化成熟的足细胞随机分为对照组(D-葡萄糖5 mmol/L培养)、甘露醇组(D-葡萄糖5 mmol/L+甘露醇25 mmol/L培养)、高糖组(D-葡萄糖30 mmol/L培养)和肾胺酶处理组(重组肾胺酶蛋白60 μg/mL预处理6 h+D-葡萄糖30 mmol/L培养)。肾胺酶使用浓度经既往实验[13]及Wang等[23]测试为最适浓度。48 h后收集细胞进行分析。实验重复3次。
1.4 Ⅳ型胶原α、TGF-β1、MCP-1与F-actin mRNA检测 收集各组细胞以Trizol提取总RNA,用M-MLV Reverse Transcriptase 试剂盒反转录成cDNA,用StepOnePlus PCR系统和SYBER Green PCR master Mix实时荧光定量PCR,反应体系和反应条件按照说明书配制和设置。以18s rRNA为内参基因。各基因引物序列见表1。
1.5 Caspase-3活性检测 用胰酶消化各组细胞,并收集至备用的细胞培养液中。离心后收集细胞,按照每200万细胞加入100 μL裂解液的比例加入裂解液,重悬沉淀,冰育裂解15 min后离心,取上清测定caspase-3酶的活性。依次加入底物和待测样品及标准品。caspase-3催化底物Ac-DEVD-pNA产生黄色的pNA,pNA在405 nm附近有强吸收,通过测定吸光度来检测caspase 3的活性。

表1 各基因引物序列
1.6 Ⅳ型胶原α、TGF-β1和MCP-1蛋白表达的检测 细胞上清1 000×g离心20 min,取上清,分别在预先包被小鼠Ⅳ型胶原α、TGF-β1和MCP-1蛋白捕获抗体的微孔中,依次加入待测样品、标准品、HRP标记的检测抗体,经过温育后彻底洗涤。用底物TMB显色,TMB在过氧化物酶的催化下转化成蓝色,并在酸的作用下转化成最终的黄色。颜色的深浅与样品中的蛋白含量正相关。用酶标仪在450 nm波长处测定吸光度(A值),计算样品浓度。
1.7 p21活性的检测 采用ELISA试剂盒检测上清中p21活性,预先包被小鼠p21捕获抗体的微孔中,依次加入标本、标准品、HRP标记的检测抗体,经过温育后彻底洗涤。用底物TMB显色,TMB在过氧化物酶的催化下转化成蓝色,并在酸的作用下转化成最终的黄色。颜色的深浅与样品中的p21活性正相关。

2 结 果
2.1 足细胞Ⅳ型胶原α表达水平 结果(图1)表明,与对照组相比,高糖诱导使足细胞Ⅳ型胶原α的表达水平显著升高(P<0.05);肾胺酶处理足细胞Ⅳ型胶原α表达水平显著下调(P<0.05)。甘露醇组与对照组差异无统计学意义。
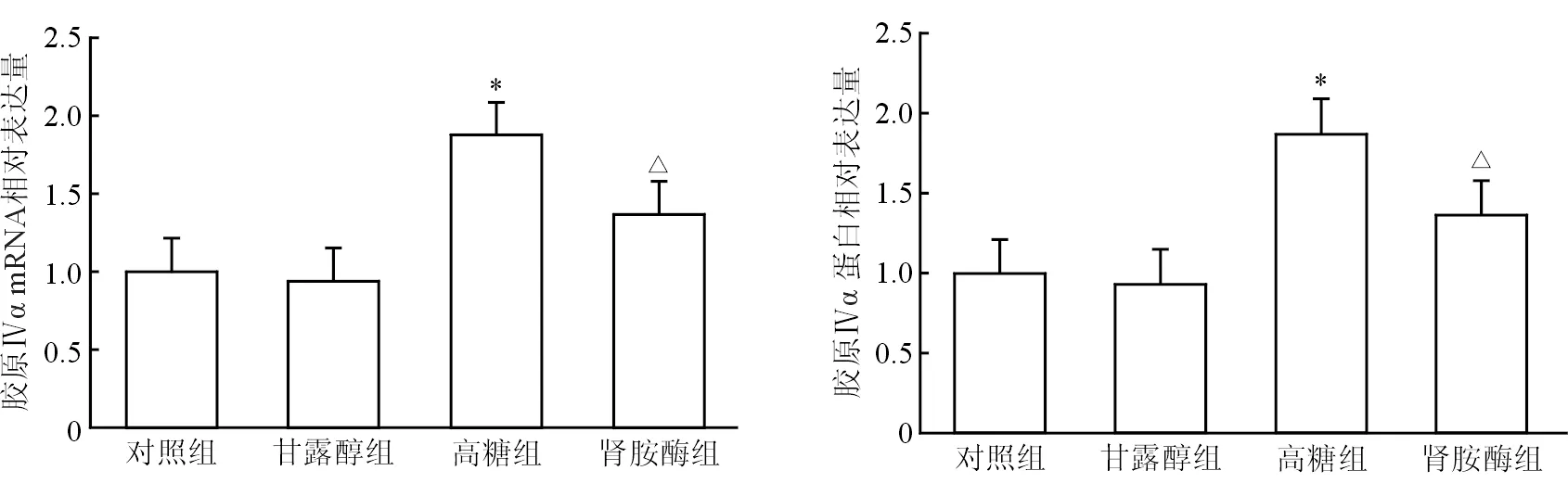
图1 肾胺酶使高糖诱导的足细胞Ⅳ型胶原α表达水平下调
2.2 足细胞TGF-β1表达水平 结果(图2)表明,与对照组相比,高糖诱导足细胞TGF-β1表达水平显著升高(P<0.05);肾胺酶处理使高糖诱导的足细胞TGF-β1表达水平显著下调(P<0.05)。甘露醇组与对照组差异无统计学意义。
2.3 足细胞MCP-1表达水平 结果(图3)表明,与对照组相比,高糖诱导细胞MCP-1表达水平增高(P<0.05);肾胺酶处理使高糖诱导的足细胞MCP-1表达水平显著下调(P<0.05)。甘露醇组与对照组差异无统计学意义。
2.4 足细胞p21的活性 结果(图4)表明,与对照组相比,高糖诱导足细胞p21活性增强(P<0.05);肾胺酶使高糖诱导的足细胞p21活性降低(P<0.05)。甘露醇组与对照组差异无统计学意义。

图2 肾胺酶使高糖诱导的足细胞TGF-β1表达水平下调
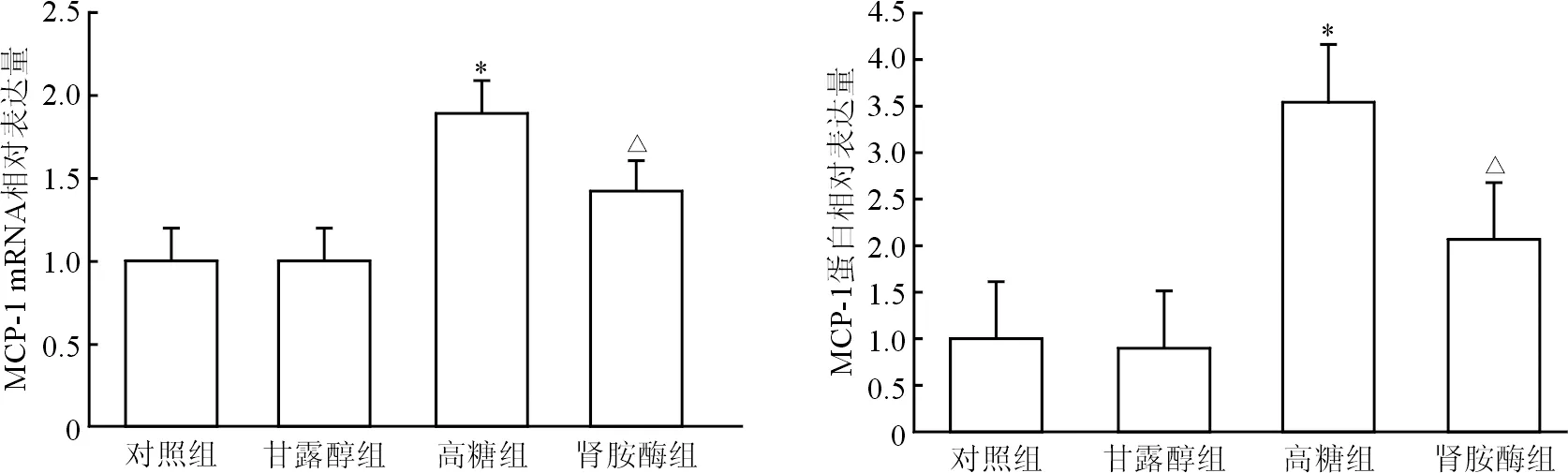
图3 肾胺酶使高糖诱导的足细胞MCP-1表达水平下调
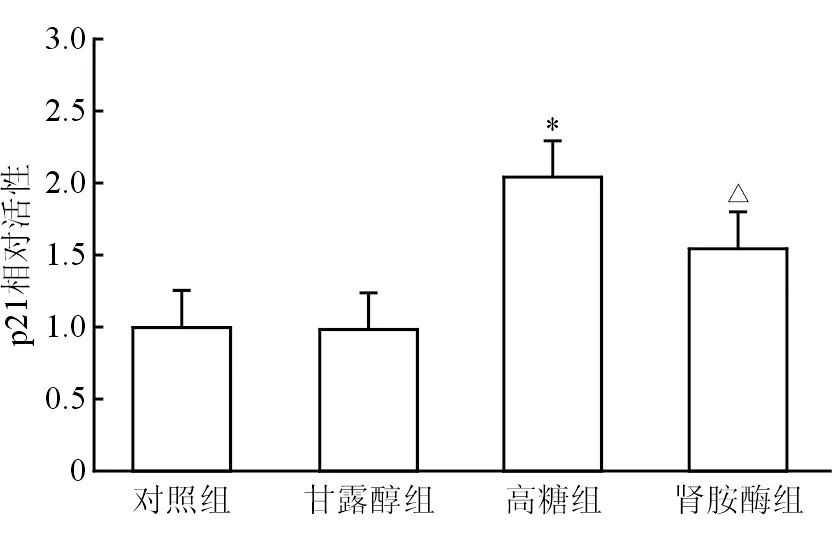
图4 肾胺酶下调高糖诱导的足细胞p21活性
2.5 足细胞caspase-3活性 结果(图5)表明,与对照组相比,高糖诱导足细胞caspase-3活性显著升高(P<0.05);肾胺酶下调高糖诱导的足细胞caspase-3活性(P<0.05)。甘露醇组与对照组差异无统计学意义。
2.6 足细胞F-actin表达比较 结果(图6)表明,各组足细胞骨架蛋白F-actin mRNA表达差异无统计学意义。
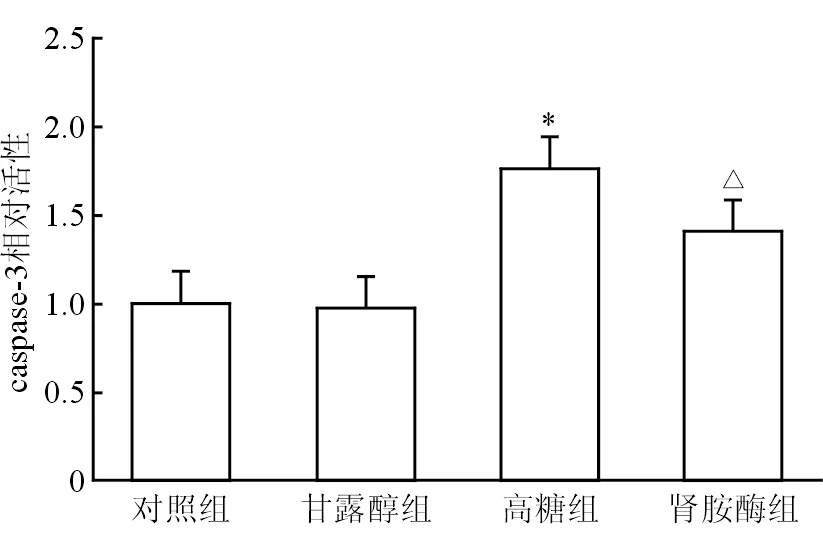
图5 肾胺酶下调高糖诱导的足细胞caspase-3活性
图6 各组足细胞F-actin表达情况
3 讨 论
DN已成为全球范围内终末期肾病的主要原因之一。临床以蛋白尿、高血压和肾功能的逐渐丧失为特征。DN一旦发展到终末期肾病甚至肾衰竭,将需要进行替代治疗,这对患者和社会来说都是非常大的负担。因此,探寻其更加有效的治疗方式极为迫切。
病理上,DN主要体现在细胞外基质的沉积、肾小球基底膜增厚、肾小球增殖性变化以及肾小管萎缩,最终导致不可逆的肾小球硬化和间质纤维化,这也是多种肾脏疾病的最终共同途径[24]。足细胞即肾小囊脏层上皮细胞,附着于肾小球基底膜的外侧,连同血管内皮细胞和肾小球基底膜构成了肾小球血液滤过屏障。足细胞是肾小球滤过屏障的关键组成部分,也是产生胶原的重要细胞之一,容易受到多种因素的损伤[25-26]。足细胞损伤和凋亡在DN的发生发展中起关键作用[27]。在DN中,足细胞损伤伴随复杂的生物学变化,包括细胞代谢异常和细胞完整性丢失及凋亡。足细胞形态变化主要包括足细胞肥大、足细胞上皮-间质转化、足细胞脱离和凋亡[28]。足细胞损伤最终导致蛋白尿,细胞外基质(extracellular matrix, ECM)成分的积聚和肾小球硬化[29]。
本研究采用体外高糖培养足细胞,模拟了DN的生理环境,并用肾胺酶重组蛋白预处理足细胞以研究其作用。胶原蛋白是细胞外基质的主要成分,且Ⅳ型胶原是基底膜网状结构的关键组成成分。本研究发现,在高糖刺激下,足细胞Ⅳ型胶原α表达水平显著增加,而肾胺酶可降低足细胞Ⅳ型胶原α表达水平,减少细胞外基质积聚。本研究还证明肾胺酶可抑制高糖诱导的足细胞凋亡,可显著降低足细胞凋亡相关蛋白caspase-3活性,这与Wang等[23]的研究结果一致。
TGF-β1是转化生长因子β细胞因子超家族的多肽成员,具有控制细胞生长、增殖、分化和凋亡等多种细胞功能。以往研究[30]证明糖尿病环境增强氧化应激并诱导TGF-β1的表达。TGF-β1诱导ECM的过量产生和抑制ECM的降解,是导致大多数慢性肾脏病纤维化的主要细胞因子[31]。TGF-β1还通过增加肾小球通透性和减少近段小管的重吸收来调节尿白蛋白排泄和诱导上皮-间质转化[32-33]。此外,TGF-β1还是促进足细胞凋亡的重要细胞因子之一[34]。与上述结论一致,本研究证明高糖培养的足细胞TGF-β1表达显著增加,而重组肾胺酶可抑制高糖培养的足细胞TGF-β1表达。
单核细胞/巨噬细胞是DN肾脏中最丰富的浸润细胞[35]。趋化因子及其受体在免疫细胞向肾脏组织的迁移中起关键作用,其中重要的趋化因子之一为MCP-1。MCP-1趋化单核细胞到肾脏,介导肾脏炎症和纤维化[36-37],是识别肾纤维化危险的潜在生物标志物[38-39]。MCP-1可反映DN中肾小管损伤和肾脏炎症的水平[40],是预测DN进展的重要因子[41-42]。同样地,本研究证明肾胺酶可显著降低高糖培养的足细胞MCP-1表达水平。
足细胞肥大是糖尿病肾病最早的肾小球形态变化之一,在DN的进展中发挥重要作用[43-44]。其中p21又叫p21Waf1/Cip1,也称为细胞周期蛋白依赖性激酶抑制剂1,能够抑制细胞周期蛋白,干扰细胞周期进程,使细胞周期停滞,导致细胞肥大[45-46]。p21在DN的肾小球肥大中起关键作用[47]。p21还与肾脏纤维化密切相关。研究[48]表明p21基因敲除可显著抑制肾脏纤维化,降低TGF-β表达水平。本研究发现,高糖诱导足细胞中p21活性增加,肾胺酶可显著抑制该效应。因此肾胺酶可能通过抑制p21活性恢复足细胞细胞周期、抑制细胞肥大和减轻纤维化。
综上所述,本研究利用体外试验证实肾胺酶可减轻高糖诱导的足细胞损伤和凋亡,可能与抑制炎症、纤维化和p21活性有关。因此,肾胺酶可能具有保护肾功能的作用,为临床治疗DN提供了新的思路。然而,本研究仅限于体外试验,且暂时没有发现高糖和肾胺酶对足细胞骨架蛋白的影响,因此,肾胺酶对DN患者肾功能的保护作用以及其详细机制尚需要进一步探究。
利益冲突:所有作者声明不存在利益冲突。
