LTBP2通过TLR4/NF-κB信号通路抑制糖尿病大鼠海马神经元凋亡
2021-08-26栾宁刘丹刘畅王新杨侯阳张晓妍
栾宁,刘丹,刘畅,王新杨,侯阳,张晓妍△
随着糖尿病病程的延长,患者会出现学习记忆能力下降[1-2],这与血糖控制不良有直接关系[3]。此外,糖尿病通常会增加患者痴呆的发病率[4];也会导致海马神经元受损,包括细胞凋亡,进而引起认知障碍和记忆丧失[5]。研究发现,神经元凋亡与炎症、氧化应激联系紧密[6]。潜在转化生长因子β结合蛋白2(latent transforming growth factor beta binding protein2,LTBP2)属于细胞外基质蛋白家族的一员,与多种疾病中炎症、氧化应激形成有关[7-8]。但是,LTBP2 对糖尿病认知功能障碍的影响尚鲜见报道。本研究拟探讨LTBP2及其转导通路对糖尿病大鼠学习记忆的影响。
1 材料与方法
1.1 材料
1.1.1 实验动物 雄性SD 大鼠60 只,体质量180~220 g,购自锦州医科大学,动物生产许可证编号:SCXK(辽)2019-16。
1.1.2 试剂及仪器 链脲佐菌素(streptozotocin,STZ,Sigma);LTBP2、Toll样受体4(Toll like receptor 4,TLR4)、核转录因子-κB(nuclear factor-κB,NF-κB)、GAPDH 一抗(英国Abcam公司);免疫组化试剂盒、TUNEL染色试剂盒、Western blot二抗、RNA提取试剂盒、反转录试剂及PCR试剂(北京碧云天公司)。正置显微镜(日本Olympus 公司),石蜡切片机(德国SLEE 公司),水平电泳仪、荧光定量PCR 仪(BIORAD),Morris 水迷宫(玉研仪器公司)。si-LTBP2 由上海吉玛公司设计合成,其反义寡核苷酸序列为5'-CCGCAACAACGCCAUCUAUTT-3',对 照 序 列 为 5'-AUAGAUGGCGUUGUUGCGGTT-3'。
1.2 方法
1.2.1 动物分组及模型制备 45只大鼠腹腔一次性注射STZ 55 mg/kg,72 h后采尾静脉血测血糖,将血糖>16.7 mmol/L的大鼠定为糖尿病模型,成模率为100%。模型诱导成功后,应用随机数字表法将大鼠分成3 组:糖尿病(DM)组、si-LTBP2组(大鼠海马给予腺病毒包装的针对LTBP2的siRNA 10 μL)、sc-LTBP2组(大鼠海马给予LTBP2对照序列10 μL),每组15只。另取15 只正常大鼠作为对照(CON)组。CON 组和DM组给予等剂量生理盐水。常规饲养,环境温度为20~25 ℃,湿度为50%~70%。脑立体定位注射:根据大鼠脑图谱定位海马部位进行微量注射,给药剂量为10 μL。12周后进行各项指标检测。实验遵循国家《实验动物管理条例》。
1.2.2 水迷宫检测 12周后,每组应用随机数字表法取5只大鼠,进行定位航行和空间探索实验。(1)定位航行实验:大鼠依次从水池的4个象限入水,大鼠登上平台并维持2 s 后,计时停止并记为逃避潜伏期。大鼠登上平台后,使其停留于平台15 s以增强其学习记忆,擦干后放在温暖环境中。如60 s内未登上平台,则进行人工引导。第1~3 天,平台置于液面上约1 cm;第4~5 天,平台置于液面下约1 cm。(2)空间探索实验:将平台移去,每只鼠从原平台所在象限的对侧象限入水,记录60 s内小鼠的游泳速度、在原平台区域所处的时间。目标象限停留时间百分比=目标象限内游泳时间/总游泳时间×100%。
1.2.3 取材 随机数字表法每组取5 只大鼠,以2%戊巴比妥钠麻醉,4%多聚甲醛灌注固定后取出海马,石蜡包埋切片,厚度为5 μm,用于免疫组化及TUNEL 染色。每组随机取5 只大鼠,深度麻醉后取出海马,提取总RNA,定量后于-80 ℃保存,用于实时荧光定量聚合酶链式反应(qPCR)。每组剩余的5 只大鼠深度麻醉,处死后取海马,冰上剪碎,裂解,冰上静置30 min后4 ℃、12 000 r/min离心25 min,留上清液。BCA法测蛋白浓度并制样,-20 ℃保存用于Western blot。
1.2.4 免疫组化检测大鼠海马LTBP2 表达 经1.2.3 制备的切片于PBS洗涤3次,每次5 min;切片置于体积分数3%H2O2室温10 min,PBS洗涤3次,每次3 min;3%山羊血清室温孵育30 min;不洗,滴加兔抗大鼠LTBP2(1∶400),4 ℃过夜;PBS洗涤3 次,每次3 min;滴加二抗,室温30 min;PBS 洗涤3 次,每次3 min;滴加链霉亲和素-生物素复合物(streptavidin-biotin complex,SABC)试剂,室温30 min;PBS洗涤3次,每次3 min;二氨基联苯胺(3,3’-diaminobenzidine,DAB)显色,复染、脱水、透明封片后荧光显微镜拍照,并应用Image J 软件分析同视野下LTBP2阳性细胞与总细胞数的比值作为表达阳性率。
1.2.5 qPCR 检测海马LTBP2 mRNA 表达变化 取1 μg RNA,按照反转录试剂盒说明书将RNA 反转录为cDNA。反转录条件:37 ℃ 15 min,85 ℃ 5 s。PCR循环参数:95 ℃ 2 min;95 ℃ 30 s,60 ℃ 30 s,40 个循环。每个样本重复 3 次。结果为Ct值。以GAPDH为内参照,对目标基因进行归一化处理,并应用2-ΔΔCt法来比较每组各个部位样品中LTBP2 mRNA 的表达差异。LTBP2 引物应用DNASTAR 软件设计,由上海吉玛公司合成,引物序列为:上游5'-GGACGCGGAGTGTGTGAATACC-3',下游 5'-GGGTAGCAGAAGGCAGGAGTAGG-3'。GAPDH 引物序列为:上游5'-TCCTGCACCACCAACTGCTTAG-3',下游5'-AGTGGCAGTGATGGCATGGACT-3'。
1.2.6 Western blot 检测LTBP2、TLR4、NF-κB 蛋白相对表达量 取1.2.3制备的上清液,BCA 法测定蛋白浓度,电泳时加入12 μL 样品;电泳、转膜后1%BSA 室温封闭2 h;加入一抗(兔抗大鼠LTBP2,1∶2 000;兔抗大鼠TLR4,1∶5 000;兔抗大鼠NF-κB,1∶8 000;兔抗大鼠GAPDH,1∶5 000),4 ℃孵育过夜;TBST 洗涤 4 次,每次 5 min;加入二抗室温 2 h,孵育后TBST 洗涤4 次,每次5 min;化学发光法ECL 显影,Image J 软件分析灰度值。
1.2.7 TUNEL 染色检测各组大鼠海马神经元凋亡 经1.2.3制备的切片脱蜡,PBS 洗3 次,4%多聚甲醛固定30 min,PBS洗 3 次,加入含 0.1%Triton X-100 的 PBS 冰浴孵育 2 min,配制TUNEL 检测液,TUNEL 检测液按照末端脱氧核苷酸转移酶(terminal deoxyribonucleotidyl transferase,TdT)与荧光标记液=1∶24的体积配制,PBS 洗2次,样品加50 μL TUNEL 检测液,37 ℃孵育60 min,PBS洗3次,封片后荧光显微镜下拍照。计数TUNEL 阳性细胞,凋亡率=TUNEL 阳性细胞数/总细胞数×100%。
1.3 统计学方法 采用SPSS 20.0软件进行统计分析。符合正态分布的计量资料以均数±标准差()表示,组间比较采用单因素方差分析,方差齐时采用SNK-q检验进行多重比较,方差不齐时采用Games-Howell 法,以P<0.05 为差异有统计学意义。
2 结果
2.1 Morries 水迷宫检测结果 定位航行实验结果显示,与 CON 组相比,DM 组、si-LTBP2 组和 sc-LTBP2组大鼠平均逃避潜伏期明显缩短(P<0.05);与DM 组相比,si-LTBP2 组明显延长(P<0.05)。空间探索实验结果显示,与CON 组相比,DM 组、si-LTBP2 组和sc-LTBP2 组大鼠在目标象限停留的时间百分比明显降低;与DM组相比,si-LTBP2组明显增加(P<0.05)。大鼠的运动轨迹见图1,水迷宫检测结果见表1。

Fig.1 Morris water maze trajectory of rats in the four groups图1 4组大鼠水迷宫运动轨迹图
Tab.1 The Morris water maze results of the latency of escape and the percentage of the residence time in the target quadrant of the four groups of rats表1 4组大鼠水迷宫逃避潜伏期及目标象限停留时间百分比检测结果 (n=5,)

Tab.1 The Morris water maze results of the latency of escape and the percentage of the residence time in the target quadrant of the four groups of rats表1 4组大鼠水迷宫逃避潜伏期及目标象限停留时间百分比检测结果 (n=5,)
**P<0.01;a与CON组比较,b与DM组比较,c与si-LTBP2组比较,P<0.05
组别CON组DM组si-LTBP2组sc-LTBP2组F逃避潜伏期(s)52.92±1.61 26.77±1.16a 45.26±1.44ab 26.69±1.01ac 300.470**目标象限停留时间百分比(%)22.41±2.27 12.67±0.66a 18.55±0.71ab 12.88±1.17ac 35.873**
2.2 4组大鼠海马LTBP2蛋白表达 免疫组织化学结果显示,LTBP2 阳性表达主要分布于海马区神经元细胞质,阳性信号呈棕黄色颗粒,见图2。CON组、DM 组、si-LTBP2 组、sc-LTBP2 组 LTBP2 蛋白表达阳性率分别为 13.70%±0.94%、74.29%±1.93%、25.87%±1.38%和73.54%±1.74%(n=5,F=1 259.482,P<0.01)。与CON组相比,DM组、si-LTBP2组和sc-LTBP2组大鼠海马LTBP2蛋白表达明显增加;与DM组相比,si-LTBP2 组LTBP2 蛋白表达明显减少(P<0.05)。
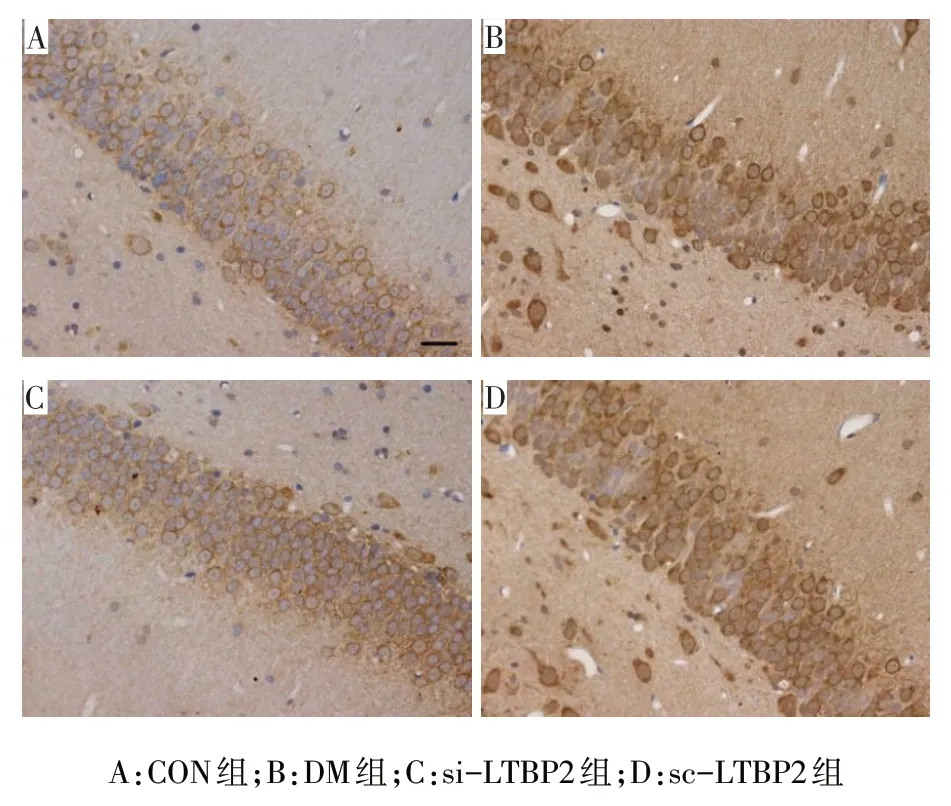
Fig.2 Immunohistochemical staining of LTBP2 protein in hippocampus of rats in the four groups(×400)图2 4组大鼠海马LTBP2蛋白免疫组化染色(×400)
2.3 qPCR检测4组大鼠海马LTBP2mRNA表达 4组LTBP2mRNA 表达水平分别为 1.00±0.00、7.31±0.13、2.98±0.15 和 7.27±0.10(n=5,F=2 400.370,P<0.01)。与 CON 组相比,DM 组、si-LTBP2 组和 sc-LTBP2 组大鼠海马LTBP2mRNA 表达水平明显增加;而与DM组相比,si-LTBP2组LTBP2mRNA表达水平明显减少(P<0.05),见图3。
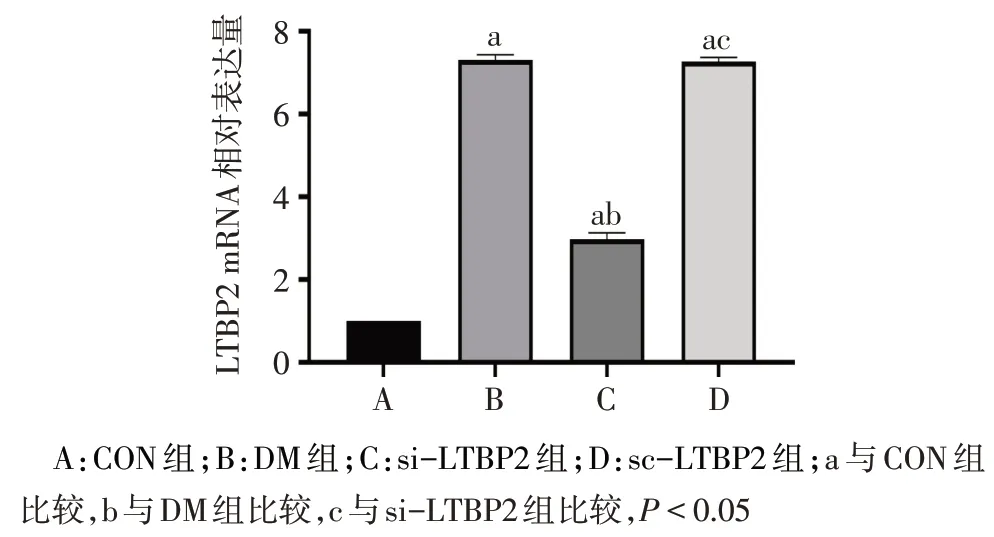
Fig.3 Comparison of LTBP2 mRNA expression in hippocampus of rats between the four groups图3 4组大鼠海马LTBP2 mRNA表达量比较
2.4 Western blot 检测海马LTBP2、TLR4、NF-κB 蛋白相对表达量 与CON组相比,DM组、si-LTBP2组和sc-LTBP2 组大鼠海马LTBP2、TLR4、NF-κB 蛋白表达水平明显增加;而与DM 组相比,si-LTBP2 组LTBP2、TLR4、NF-κB 蛋白表达水平明显减少(P<0.01),见图4、表2。
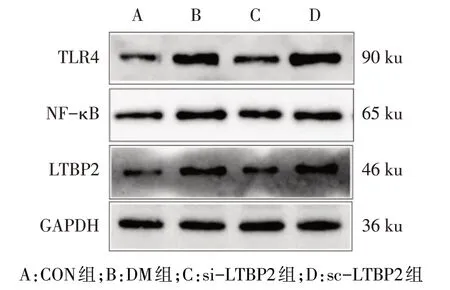
Fig.4 The relative expressions of LTBP2,TLR4 and NF-κB in hippocampus detected by Western blot assay图4 Western blot检测海马LTBP2、TLR4、NF-κB蛋白相对表达量
Tab.2 Comparison of LTBP2,TLR4 and NF-κB protein expressions in hippocampus of rats between the four groups表2 4组大鼠海马LTBP2、TLR4、NF-κB蛋白表达水平比较 (n=5,%,)

Tab.2 Comparison of LTBP2,TLR4 and NF-κB protein expressions in hippocampus of rats between the four groups表2 4组大鼠海马LTBP2、TLR4、NF-κB蛋白表达水平比较 (n=5,%,)
**P<0.01,a与CON组比较,b与DM组比较,c与si-LTBP2组比较,P<0.01
组别CON组DM组si-LTBP2组sc-LTBP2组F TLR4/GAPDH 15.44±1.09 140.92±3.35a 25.36±0.73ab 141.63±2.05ac 3 417.929**NF-κB/GAPDH 20.55±1.13 123.20±2.33a 83.02±2.50ab 122.06±2.57ac 1 428.562**LTBP2/GAPDH 17.38±0.99 118.59±2.13a 32.77±1.74ab 117.99±1.71ac 3 084.710**
2.5 TUNEL 染色检测海马神经元凋亡 CON 组、DM 组、si-LTBP2 组、sc-LTBP2 组凋亡 率分别为2.83%±0.29%、64.03%±1.71%、17.14%±1.29% 和63.21%±1.29%(n=5,F=1 876.135,P<0.01)。 与CON 组相比,DM 组、si-LTBP2 组和 sc-LTBP2 组大鼠海马神经元细胞凋亡明显增加,而与DM组相比,si-LTBP2组细胞凋亡明显减少(P<0.01),见图5。

Fig.5 Apoptosis of hippocampus of rats detected by TUNEL staining in the four groups(×400)图5 TUNEL染色检测4组大鼠海马细胞凋亡(×400)
3 讨论
3.1 糖尿病海马神经元凋亡诱导大鼠学习记忆能力下降 1型糖尿病(T1DM)和T2DM都会引起神经损伤并发症,包括学习记忆功能障碍的风险增加。越来越多的动物模型证据表明,糖尿病在不同程度上损害了认知功能,包括学习、记忆和注意力,并增加了抑郁和焦虑的发病率[9-10]。随着糖尿病患者痴呆风险增加,更加重了学习和记忆缺陷[11]。本研究发现,糖尿病大鼠在水迷宫实验中平均逃避潜伏期明显缩短,在目标象限停留的时间百分比明显降低,说明糖尿病会引起大鼠学习记忆损伤。本研究还发现,糖尿病可诱导大鼠海马神经元凋亡,TUNEL 阳性细胞明显增多,这也在某种程度上加重了大鼠学习记忆障碍。以上结果表明,糖尿病可降低大鼠学习记忆能力,诱导神经元凋亡,这提示本实验模型诱导成功。
3.2 LTBP2 可介导糖尿病大鼠学习记忆功能障碍 研究发现,神经炎症在糖尿病认知功能障碍中尤为关键,抑制海马区炎症反应对其治疗有益[12]。转化生长因子-β(TGF-β)家族的生长因子除了对细胞生长具有免疫调节作用,还在炎症及应激反应中起重要作用[13]。TGF-β 是由细胞分泌的潜在复合物,含有TGF-β 及其前肽LAP(潜在相关肽)。在大多数细胞中,LAP与潜在TGF-β结合蛋白(LTBP)共价连接。LTBPs 是TGF-βs 高效分泌和正确折叠所必需的,LTBPs分泌的大量潜在复合物通过LTBPs的N端与细胞外基质共价结合。LTBPs家族具有典型的重复序列结构域,目前已鉴定出4 种不同的LTBPs和2种纤维蛋白,这其中包括LTBP2。有研究发现,LTBP2 通过与 LTBP1 竞争纤维蛋白-1 的结合位点,间接引起TGF-β 的激活,与多种疾病介导的炎症、氧化应激密切相关,且可诱导细胞凋亡[8]。沉默LTBP2基因可以通过减轻心肌氧化应激损伤,抑制扩张型心肌病大鼠心肌纤维化与心肌重塑,进而减轻心肌纤维化[7]。本研究发现,糖尿病状态下,大鼠海马区LTBP2 蛋白和LTBP2 mRNA 表达明显增加,并伴随海马区细胞凋亡率增高,大鼠学习能力降低,说明LTBP2 可能会引起糖尿病大鼠学习记忆降低。本研究对糖尿病大鼠海马注射si-LTBP2来沉默LTBP2表达,发现凋亡率明显降低,大鼠学习记忆能力得到明显改善,提示LTBP2 介导了糖尿病认知功能障碍,但具体机制不清。
3.3 LTBP2通过TLR4/NF-κB信号通路介导糖尿病大鼠学习记忆功能障碍 TLR4/NF-κB 信号通路与多种炎症因子的表达调控有关,该通路介导了脑缺血时神经元的损伤[14]。TLR4 可通过选择性识别内源性损伤相关的分子最终激活NF-κB,导致肿瘤坏死因子(TNF)-α、白细胞介素(IL)-6、IL-1β 等炎性因子释放,诱发炎症[15]。抑制TLR4/NF-κB 途径可减弱脂多糖诱导的海马炎症反应[14]。TLR4/NF-κB信号通路还可参与异丙酚诱导的神经损伤[16]。因此,本研究对糖尿病大鼠海马注射si-LTBP2来抑制LTBP2 蛋白的表达。Western blot 检测结果发现,抑制 LTBP2 的表达后,TLR4 和 NF-κB 蛋白表达水平均显著下调,这提示LTBP2 介导的糖尿病认知功能障碍与TLR4/NF-κB信号通路密切相关。
综上所述,糖尿病状态下会引起LTBP2 表达上调和海马神经元凋亡,最终引起大鼠学习记忆能力下降。沉默LTBP2表达后可改善糖尿病大鼠认知功能障碍,这可能与抑制TLR4/NFκB 信号通路有关。本研究尚存在不足之处,如未对正常大鼠进行海马LTBP2基因敲除来验证LTBP2与学习记忆能力的关系;沉默LTBP2 后,虽然取得了一定的治疗效果,但与CON 组还有一定的差距;LTBP2 最终是通过影响TGF-β的表达、分泌或活性发挥作用的,但本研究未对大鼠海马组织中TGF-β 的表达水平或活性进行检测;脑立体定位注射为混杂因素,而本研究未设置假手术组,对组间比较会有一定影响。
