低频超声联合微泡对比剂通过PI3K/AKT通路对乳腺癌耐药株MCF-7/ADR多药耐药的逆转机制研究
2021-08-26贺修宝胡小梅郭雅婧
贺修宝,胡小梅,郭雅婧△
乳腺癌的发病率居全球女性恶性肿瘤的首位,且在我国的发病率逐年增高[1]。化学疗法作为乳腺癌的辅助治疗方法,广泛应用于不同病情程度患者的术前或术后治疗,有利于限制肿瘤进展,延长患者生存期,然而其缺乏靶向性,且最终会产生耐药,影响治疗有效性[2-3]。低频超声联合微泡(LFUSMB)是近年出现的一项治疗技术,微泡可在低频超声下破裂产生空化作用,增加破裂处血管及细胞膜的通透性,提高药物传递效率,具有针对性和非侵入性,在肿瘤治疗中具有应用前景[4]。研究显示,LFUSMB可提高甲状腺癌细胞中活性氧(ROS)水平,促进自噬性死亡的发生,并抑制黑色素瘤B16 细胞的生长[5-6]。Chen 等[7]发现,LFUSMB 可克服结直肠癌细胞的耐药性,降低耐药蛋白腺苷三磷酸结合盒家族蛋白G 成员2(ABCG2)表达,提高卟啉/喜树碱/氟尿苷对癌细胞的杀伤作用,但其在乳腺癌中的作用机制仍不清楚。本研究通过探讨LFUSMB 对乳腺癌MCF-7/阿霉素(ADR)细胞耐药性的影响并探究其机制,以期为乳腺癌的治疗提供参考。
1 材料与方法
1.1 材料 人乳腺癌MCF-7/ADR 细胞购自武汉普诺赛生命科技有限公司。阿霉素(ADR,纯度>98.0%)购自美国Sigma 公司;磷脂酰肌醇 3 激酶(PI3K)活化剂 740 YP 购自MCE公司;MCF细胞专用培养基购自武汉普诺赛生命科技有限公司;微泡对比剂Sonovue购自意大利Bracco公司;兔抗人P糖蛋白(P-gp)、p-PI3K、蛋白激酶B(AKT)、p-AKT抗体,小鼠抗人β-actin、抗多药耐药蛋白(MRP)2、乳腺癌抗性蛋白(BCRP/ABCG2)抗体及羊抗兔、羊抗小鼠或兔IgG 抗体均购自美国Abcam 公司;小鼠抗人MRP1、PI3K 抗体均购自Santa Cruz Biotechnology 公司;CCK-8 试剂盒购自上海碧云天生物技术有限公司;低频超声治疗系统购自美国Philips 公司;电泳仪、酶标仪购自美国BioRad公司。
1.2 细胞培养 将MCF-7/ADR 细胞解冻后离心,采用含1 mg/L ADR 的MCF 细胞培养基悬浮细胞以维持ADR 耐药性,于培养箱(37 ℃、5%CO2)中复苏培养,1周传代3次,收集第3代对数生长期的MCF-7/ADR细胞计数后进行实验。
1.3 CCK-8法筛选LFUSMB作用时间 将1.2中对数生长期的 MCF-7/ADR 细胞制备为 5×105个/mL 的悬浮液,接种于3.5 cm 培养皿中(2 mL/皿),加入1 mL MCF 细胞培养基(含1 mg/L ADR)和30%微泡对比剂混匀。将培养皿置于脱气无菌水填充的水箱中,用超声探头在距培养皿底部1 cm处进行辐射处理即超声处理。超声设置[8]:频率1 MHz,强度1.0 W/cm2,效率70%。将未经LFUSMB 处理的细胞(未超声处理组)和上述经超声处理10 s、30 s、60 s、90 s 的细胞(LFUSMB 10 s组、LFUSMB 30 s 组、LFUSMB 60 s 组、LFUSMB 90 s 组)制备5×104个/mL的悬浮液,接种于96孔板(100 μL/孔),加入MCF细胞培养基(含1 mg/L ADR)。培养48 h后,每孔加入10 μL CCK-8溶液,继续培养4 h,酶标仪测量各孔在450 nm处的吸光度值(A450),细胞活性=[(A450超声处理组-A450空白组)(/A450未超声处理组-A450空白组)]×100%。
1.4 CCK-8 法测定ADR 对MCF-7/ADR 细胞的半抑制浓度(IC50) 对数生长期的MCF-7/ADR 细胞接种于3.5 cm 培养皿中(1×106个/皿)培养,分为LFUSMB 30 s 组(按照1.3 中方法采用LFUSMB干预30 s)和未超声处理组(不经LFUSMB干预),干预后收集细胞制备5×104个/mL 的悬浮液,接种于96孔板(100 μL/孔),加入含终质量浓度0、1、5、10、20、30、40、50、60、70 mg/L ADR的MCF细胞培养基培养48 h后,按照1.3中方法检测各组细胞活性,绘制药物抑制拟合曲线图并计算ADR 对MCF-7/ADR 细胞的IC50。相对耐药逆转倍数=IC50(LFUSMB 30 s组)/IC5(0未超声处理组)。
1.5 细胞分组及处理 对数生长期的MCF-7/ADR 细胞接种于3.5 cm 培养皿中(1×106个/皿)。对照(C)组:采用MCF细胞培养基正常培养;ADR 组:采用加入ADR(终质量浓度20 mg/L)的MCF 细胞培养基培养;LFUSMB+ADR 组:采用加入ADR(终质量浓度20 mg/L)的MCF 细胞培养基培养并经LFUSMB 处理 30 s;另外,为探究 PI3K/AKT 通路对 MCF-7/ADR 细胞耐药性的作用,设置LFUSMB+ADR+740 YP(PI3K/AKT通路激活剂)组:采用加入ADR(终质量浓度20 mg/L)和740 YP(终质量浓度50 mg/L)的MCF 细胞培养基培养并经LFUSMB处理30 s,按上述分组处理后继续培养48 h,收集细胞进行检测。每组重复6次。
1.6 Annexin V-FIFC/PI 法检测凋亡率 取1.5 各组MCF-7/ADR 细胞经胰酶消化后,按照Annexin V-FIFC/PI 试剂盒操作,调整细胞含量为5×105个/mL,加入500 μL 平衡试剂将细胞重悬,依次加入10 μL的Annexin V-FIFC和PI混匀后避光孵育10 min,流式细胞仪检测细胞凋亡率。
1.7 Western blot 检测蛋白表达 取1.5各组MCF-7/ADR 细胞经胰酶消化、裂解液裂解后,离心保留上清,BCA试剂盒测蛋白浓度。分别取30 μg 蛋白质进行SDS-PAGE 电泳分离,电泳结束后转印至PVDF膜。经奶粉封闭后,加入一抗,包括β-actin小鼠单抗(1∶2 000)、P-gp兔单抗(1∶1 000)、MRP1小鼠单抗(1∶2 000)、MRP2 小鼠单抗(1∶2 000)、BCRP/ABCG2小鼠单抗(1∶1 000)、PI3K 小鼠单抗(1∶1 000)、AKT 兔多抗(1∶2 000)、p-PI3K 兔单抗(1∶1 000)以及 p-AKT 兔多抗(1∶2 000)4 ℃孵育过夜,洗膜后加入羊抗小鼠或兔二抗(1∶3 000)孵育1 h,洗膜后加入ECL 发光液显影拍照,用目的蛋白和β-actin内参条带灰度值的比值表示目的蛋白相对表达量。
1.8 统计学方法 采用GrapdhPad 8.0或SPSS 24.0进行数据处理。数据以表示,多组间比较采用单因素方差分析,组间多重比较行Bonferroni-t检验。P<0.05为差异有统计学意义。
2 结果
2.1 LFUSMB 对MCF-7/ADR 细胞活力的影响 未超声处理组、LFUSMB 10 s 组、LFUSMB 30 s 组、LFUSMB 60 s 组、LFUSMB 90 s 组 MCF-7/ADR 细胞活 性 分 别 为(100.00±0.05)% 、(97.20±3.67)% 、(93.56±4.95)%、(83.04±3.64)%、(57.58±3.81)%(n=6,F=136.296,P<0.01)。与未超声处理组比较,LFUSMB 60 s组、LFUSMB 90 s组细胞活性显著降低(P<0.05),LFUSMB 10 s 组、LFUSMB 30 s 组细胞活性无显著变化(P>0.05)。后续采用LFUSMB 干预30 s进行研究。
2.2 LFUSMB 对细胞耐药性的影响 LFUSMB 30 s组ADR 对MCF/ADR 细胞的IC5(05.74 mg/L)低于未超声处理组(47.06 mg/L),相对耐药逆转倍数约为8.20倍,见图1。

Fig.1 The effect of LFUSMB on the drug resistance of MCF-7/ADR cells图1 LFUSMB对MCF-7/ADR细胞耐药性的影响
2.3 LFUSMB对细胞凋亡率的影响 C组、ADR组、LFUSMB+ADR 组MCF-7/ADR 细胞凋亡率分别为(1.78±0.54)%、(13.15±1.65)%、(67.59±3.71)%(n=6,F=1 327.427,P<0.01),见图2。ADR 组细胞凋亡率较C组增高,LFUSMB+ADR 组细胞凋亡率较ADR组进一步增高(P<0.05)。
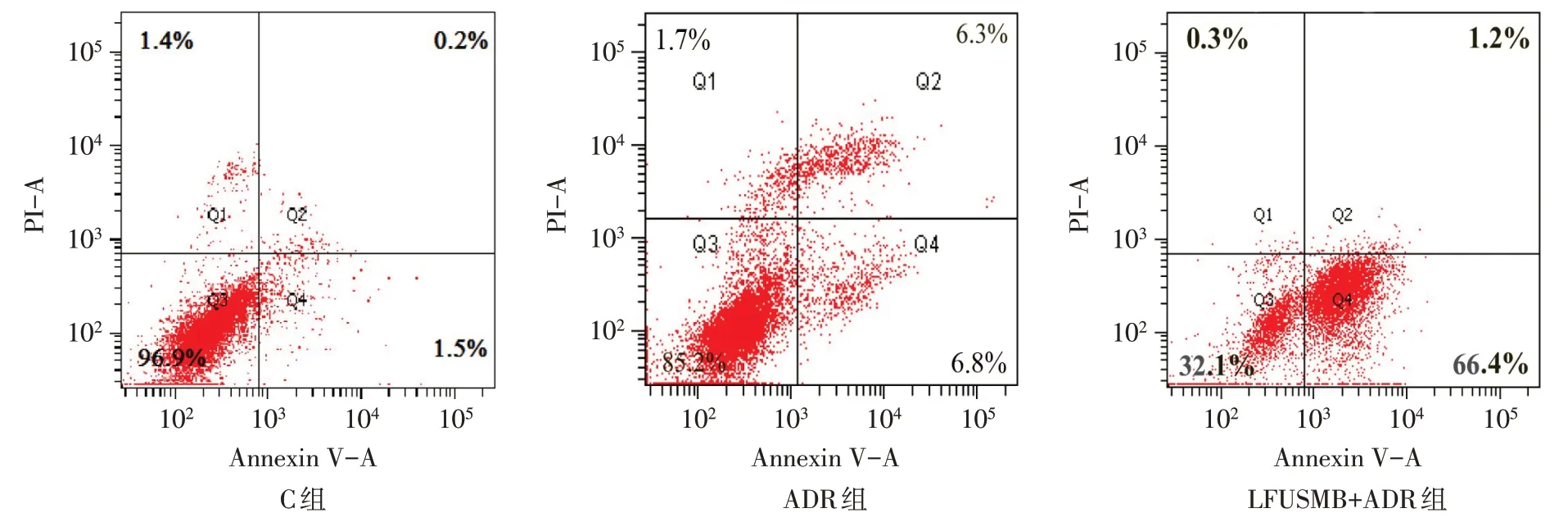
Fig.2 The effect of LFUSMB on the apoptosis rate of MCF-7/ADR cells图2 LFUSMB对MCF-7/ADR细胞凋亡率的影响
2.4 LFUSMB 对 MCF-7/ADR 细胞中 MRP1、MRP2、P-gp、BCRP/ABCG2 蛋白表达的影响 ADR 组细胞MRP1、MRP2、P-gp、BCRP/ABCG2 蛋白表达水平较C 组无明显变化 ,LFUSMB+ADR 组 细 胞 MRP1、MRP2、P-gp、BCRP/ABCG2 蛋白表达水平较 C 组和ADR组显著下调(P<0.05),见图3、表1。
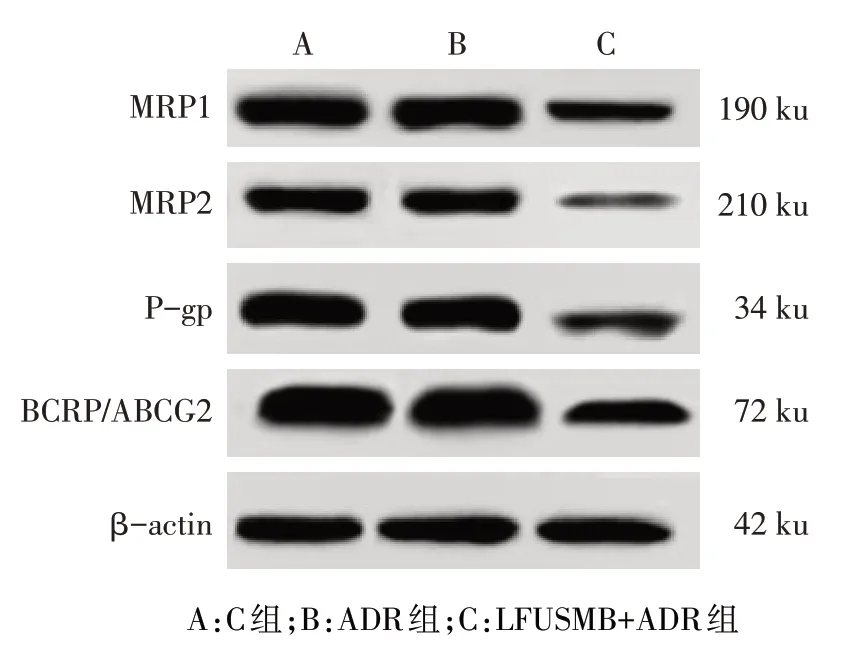
Fig.3 MRP1,MRP2,P-gp and BCRP/ABCG2 protein expressions detected by Western blot assay图3 Western blot检测MRP1、MRP2、P-gp、BCRP/ABCG2蛋白表达
Tab.1 Comparison of MRP1,MRP2,P-gp and BCRP/ABCG2 protein expressions between the three groups of MCF-7/ADR cells表1 3组MCF-7/ADR细胞MRP1、MRP2、P-gp、BCRP/ABCG2蛋白表达比较 (n=6,)

Tab.1 Comparison of MRP1,MRP2,P-gp and BCRP/ABCG2 protein expressions between the three groups of MCF-7/ADR cells表1 3组MCF-7/ADR细胞MRP1、MRP2、P-gp、BCRP/ABCG2蛋白表达比较 (n=6,)
**P<0.01;a与C组比较,b与ADR组比较,P<0.05
组别C组ADR组LFUSMB+ADR组F MRP1 1.86±0.05 1.83±0.07 0.79±0.04ab 742.467**MRP2 1.01±0.09 0.97±0.06 0.42±0.03ab 155.286**P-gp 1.26±0.07 1.23±0.08 0.74±0.06ab 102.966**BCRP/ABCG2 1.95±0.10 1.97±0.09 0.82±0.05ab 378.612**
2.5 LFUSMB对MCF-7/ADR细胞PI3K/AKT通路蛋白表达的影响 ADR 组细胞p-PI3K/PI3K 和p-AKT/AKT较C组无明显变化,LFUSMB+ADR组细胞p-PI3K/PI3K和p-AKT/AKT较C组和ADR组显著降低(P<0.05),见图4、表2。
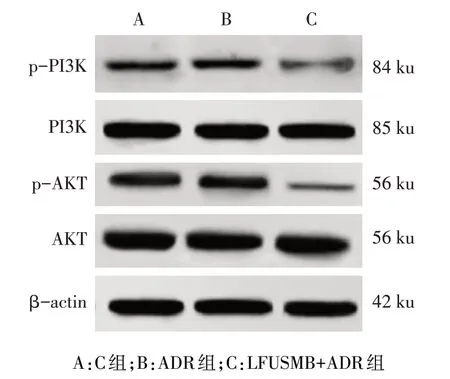
Fig.4 The protein expression of PI3K/AKT pathway detected by Western blot assay图4 Western blot检测PI3K/AKT通路蛋白表达
Tab.2 Comparison of PI3K/AKT pathway protein expression between the three groups of MCF-7/ADR cells表2 3组MCF-7/ADR细胞PI3K/AKT通路蛋白表达比较(n=6,)

Tab.2 Comparison of PI3K/AKT pathway protein expression between the three groups of MCF-7/ADR cells表2 3组MCF-7/ADR细胞PI3K/AKT通路蛋白表达比较(n=6,)
**P<0.01;a与C组比较,b与ADR组比较,P<0.05
组别C组ADR组LFUSMB+ADR组F p-PI3K/PI3K 0.46±0.09 0.44±0.06 0.21±0.03ab 27.571**p-AKT/AKT 0.57±0.08 0.58±0.05 0.13±0.02ab 127.807**
2.6 PI3K/AKT 通路激活剂对LFUSMB 干预后MCF-7/ADR 细胞凋亡及MRP1、MRP2、P-gp、BCRP蛋白表达的影响 与LFUSMB+ADR 组比较,LFUSMB+ADR+740 YP 组 MCF-7/ADR 细 胞凋 亡 率显著降低,MRP1、MRP2、P-gp、BCRP/ABCG2蛋白水平显著增高(P<0.05),见图5、表3。

Fig.5 The MRP1,MRP2,P-gp and BCRP/ABCG2 protein expressions detected by Western blot assay图5 Western blot检测MRP1、MRP2、P-gp、BCRP/ABCG2蛋白表达
Tab.3 Comparison of MCF-7/ADR cell apoptosis rate and MRP1,MRP2,P-gp,BCRP/ABCG2 protein expressions beteween the 3 groups表3 3组MCF-7/ADR细胞凋亡率及MRP1、MRP2、P-gp、BCRP/ABCG2蛋白表达比较 ()
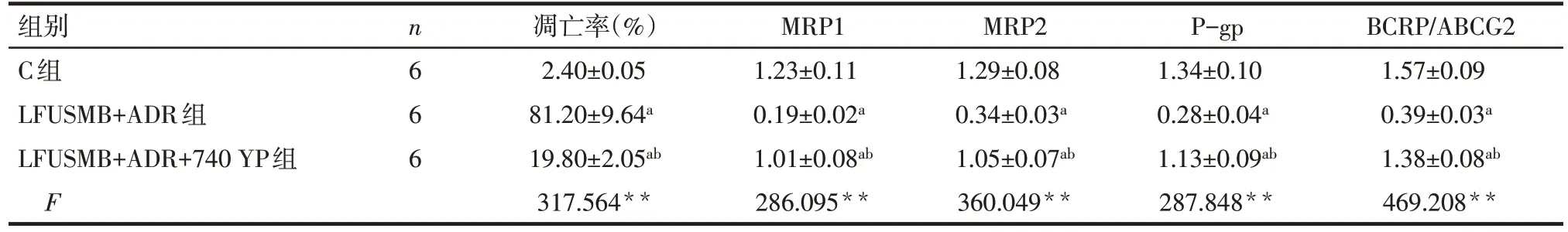
Tab.3 Comparison of MCF-7/ADR cell apoptosis rate and MRP1,MRP2,P-gp,BCRP/ABCG2 protein expressions beteween the 3 groups表3 3组MCF-7/ADR细胞凋亡率及MRP1、MRP2、P-gp、BCRP/ABCG2蛋白表达比较 ()
**P<0.01;a与C组比较,b与LFUSMB+ADR组比较,P<0.05
组别C组LFUSMB+ADR组LFUSMB+ADR+740 YP组F n6 6 6凋亡率(%)2.40±0.05 81.20±9.64a 19.80±2.05ab 317.564**MRP1 1.23±0.11 0.19±0.02a 1.01±0.08ab 286.095**MRP2 1.29±0.08 0.34±0.03a 1.05±0.07ab 360.049**P-gp 1.34±0.10 0.28±0.04a 1.13±0.09ab 287.848**BCRP/ABCG2 1.57±0.09 0.39±0.03a 1.38±0.08ab 469.208**
3 讨论
目前对乳腺癌等肿瘤广泛采用化学疗法,随着治疗的进行,最终肿瘤细胞会对化疗药物产生继发性耐药,从而限制其疗效[9]。因此寻找改善肿瘤耐药性的新治疗策略至关重要。低频超声通常小于5 W/cm2,是一种物理刺激,作为对比剂的微泡可以增加病灶检测的图像对比度,两者联合用于治疗时可通过声孔效应增强细胞膜和血管系统的渗透,靶向特异性位点传递药物,增强药物或基因传递,改善细胞对药物的摄取,进而提高治疗功效[10-11]。但是,除提高细胞膜通透性外,是否涉及其他机制并不清楚。Qu 等[8]研究显示,强度 1.0 W/cm2,频率 1 MHz的超声联合30%微气泡为MCF-7/ADR 细胞的最佳作用参数,本研究采用上述参数作用MCF-7/ADR细胞60 s 时,观察到细胞活性为(83.04±3.64)%,与上述研究观察到的活性(82.91±2.83)%相近,作用30 s时细胞活性为(93.56±4.95)%,对MCF-7/ADR 细胞的毒性较小,后续按照上述参数采用LFUSMB 干预30 s 进行研究。洪丽杰等[12]发现,LFUSMB 可抑制卵巢癌细胞在裸鼠中的生长。武雨琦等[13]研究显示,LFUSMB 可逆转前列腺癌对紫杉醇的耐药性。本研究结果显示,LFUSMB 30 s组ADR 对MCF/ADR细胞的IC50低于未超声处理组,相对耐药逆转倍数约为8.20倍,进一步分析发现,LFUSMB可促进ADR作用下MCF-7/ADR细胞的凋亡,表明LFUSMB可逆转乳腺癌MCF/ADR 细胞对ADR 的耐药性,其机制有待探索。
PI3K/Akt 信号的活化有利于抑制肿瘤细胞凋亡,维持肿瘤细胞增殖,在人类乳腺癌等肿瘤的发生及多药耐药中具有重要作用[14]。研究显示,通过抑制PI3K/AKT信号通路,核糖体S6蛋白激酶4可以抑制MCF-7/多柔比星(DOX)细胞侵袭和肿瘤生长,促进细胞凋亡,减弱MCF-7/DOX 细胞的DOX 耐药性[15]。Qiu 等[16]发现,低频超声可通过抑制 PI3K/AKT/NF-κB信号通路,下调ABC家族蛋白的表达水平,抑制细胞活力和增殖,逆转胰腺癌的耐药性。本研究发现,MCF-7/ADR细胞p-PI3K/PI3K和p-AKT/AKT 在 ADR 联合 LFUSMB 作用下显著降低,表明LFUSMB 可抑制PI3K/AKT 信号的活化。MRP1、MRP2、P-gp及BCRP/ABCG2均属于ABC家族蛋白,作为能量依赖性外排泵,可促进细胞对有毒物质的外排作用,从而降低其在细胞内的蓄积,在避免外来毒性物质损伤机体的同时,可能导致细胞对化疗药物产生耐药性[17-18]。研究显示,PI3K/AKT 通路与乳腺癌耐药性有关[19]。另外,抑制PI3K 活化可下调P-gp、BCRP/ABCG2 等 ABC 家族蛋白表达,提高耐药肿瘤细胞的药物敏感性[20]。本研究观察到,LFUSMB 作用后可显著抑制MCF-7/ADR 细胞中MRP1、MRP2、P-gp、BCRP/ABCG2 蛋白 表 达 ,与LFUSMB 对PI3K/AKT 通路的作用趋势一致,由此推测,LFUSMB 作用于 MCF-7/ADR 细胞,可抑制 PI3K/AKT 通路,下调 MRP1、MRP2、P-gp、BCRP/ABCG2多种耐药蛋白表达,从而减少MCF-7/ADR 细胞对ADR 的外排,增加ADR 在细胞内积累,诱导细胞凋亡,逆转乳腺癌MCF/ADR 细胞的耐药性。另外,本研究还发现,PI3K/AKT 通路激活剂可拮抗LFUSMB对 MCF-7/ADR 细胞凋亡及 MRP1、MRP2、P-gp、BCRP/ABCG2 蛋白表达的影响,进一步表明LFUSMB 可调控PI3K/AKT 通路活化,逆转乳腺癌MCF-7/ADR细胞耐药性。
综上所述,LFUSMB 可逆转乳腺癌MCF/ADR 细胞对ADR 的耐药性,与抑制PI3K/AKT 通路、下调MRP1 等ABC 家族蛋白表达、增加ADR 在细胞内积累及诱导细胞凋亡有关。但是,PI3K/AKT通路下游仍有多种蛋白级联传递,且多药耐药蛋白表达可受到多种通路调控。本研究仅揭示了PI3K/AKT 通路在LFUSMB 逆转肿瘤耐药性中的作用,后续将对其他通路及PI3K/AKT通路下游靶点进行分析,进一步揭示LFUSMB 逆转肿瘤耐药性的机制,为LFUSMB应用于肿瘤治疗提供参考。
