BMAL1对H2O2诱导的H9C2心肌细胞损伤的影响及机制探讨
2021-08-26易娜袁李礼
易娜 ,袁李礼
随着经济发展、居民生活方式转变和人口老龄化加速,我国心血管疾病的患病率和死亡率呈逐年递增趋势[1]。研究显示,心血管疾病的急性发作发病时间和严重程度具有昼夜变化的特点,生物钟基因表达的改变参与心血管疾病的病理生理过程[2]。脑和肌肉组织芳香烃受体核转运蛋白的类似蛋白1(brain and muscle Ah receptor nuclear translocator protein-like-1,BMAL1)作为昼夜节律系统的核心基因之一,调控生物钟基因的转录[3]。因此,探讨BMAL1 对心血管疾病的调控机制有助于寻找新的心肌细胞保护策略和靶点。氧化应激是心血管疾病的发病机制之一,心血管疾病发作时机体会产生大量的氧自由基,导致氧化应激损伤,因此抑制氧化应激有助于改善心肌损伤[4]。核因子E2 相关因子2(nuclear factor E2-related factor 2,NRF2)/血红素加氧酶-1(heme oxygenase-1,HO-1)信号轴是调控氧化应激性疾病的重要靶点[5]。目前,BMAL1 是否通过调控NRF2/HO-1 信号轴而改善心血管疾病发作时的细胞损伤和氧化应激尚不清楚。本研究构建了过氧化氢(hydrogen peroxide,H2O2)诱导的H9C2 大鼠心肌细胞损伤模型,探讨节律基因BMAL1对心肌细胞损伤、氧化应激以及NRF2/HO-1 信号轴的影响,为揭示BMAL1在心血管疾病中的分子机制提供实验依据。
1 材料与方法
1.1 主要材料和仪器 H9C2大鼠心肌细胞购自中国科学院上海细胞库,DMEM 培养基、胎牛血清、磷酸盐缓冲液(phosphate buffer saline,PBS)、胰酶和双抗购自Gibco 公司;CCK-8检测试剂盒购自上海东仁化学科技有限公司;超氧化物 歧 化 酶(superoxide dismutase,SOD)和 丙 二 醛(malondialdehyde,MDA)检测试剂盒购自南京建成生物工程研究所;BMAL1过表达慢病毒购自上海吉凯基因化学技术有限公司;NRF2 抑制剂 ML385 和 HO-1 抑制剂 Znpp 购自selleck 公司;兔抗 BMAL1、NRF2、HO-1 和 GAPDH 抗体以及羊抗兔二抗购自Abcam公司;RNAiso Plus、逆转录试剂盒、荧光定量 PCR(qPCR)试剂盒购自 TAKARA 公司;BMAL1和GAPDH引物购自湖南擎科生物技术有限公司。二氧化碳培养箱为 Thermo 产品;酶标仪为 Biotek 产品;qPCR 仪为Applied Biosystems 产品;蛋白电泳分离、转膜和成像系统为Bio-Rad产品。
1.2 细胞培养和模型构建 采用含10%胎牛血清的DMEM培养基培养H9C2 心肌细胞,选取状态良好的对数生长期细胞开展实验。用终浓度为0.2 mmol/L的H2O2诱导H9C2细胞构建损伤模型,处理24 h后进行后续实验。
1.3 BMAL1 稳定过表达的 H9C2 细胞构建 将 1×106个H9C2 细胞接种于直径60 mm 细胞培养皿,待培养24 h 后加入30 μL BMAL1 慢病毒进行感染,48 h 后更换细胞培养液,用含2 mg/L 嘌呤霉素的细胞培养液进行筛选,每隔2~3 d 进行细胞传代,培养2 周后获得BMAL1 稳定过表达的H9C2细胞。
1.4 实验分组
1.4.1 实验1 取对数生长期H9C2细胞分为对照组、H2O2组(0.2 mmol/L 的H2O2处理24 h)、BMAL1 过表达(BMAL1-OE)组(过表达BMAL1病毒感染)、BMAL1过表达+H2O2(BMAL1-OE+H2O2)组(过表达 BMAL1 病毒感染,再用 0.2 mmol/L 的H2O2处理24 h)。
1.4.2 实验2 取对数生长期的H9C2 细胞分为H2O2组(0.2 mmol/L 的 H2O2处 理 24 h)、BMAL1 过 表 达 +H2O2(BMAL1-OE+H2O2)组(过表达 BMAL1 病毒感染,再用0.2 mmol/L 的 H2O2处理 24 h)、BMAL1 过表达+抑制 NRF2+H2O2(BMAL1-OE+ML385+H2O2)组(过表达 BMAL1 病毒感染,用 NRF2 抑制剂 2 μmol/L 的 ML385 预处理 24 h 后用0.2 mmol/L 的 H2O2处理 24 h)、BMAL1 过表达+抑制 HO-1+H2O2(BMAL1-OE+Znpp+H2O2)组(过表达BMAL1 病毒感染,用HO-1抑制剂5 μmol/L的Znpp预处理24 h后用0.2 mmol/L的H2O2处理24 h)。
1.5 qPCR 法 验 证 BMAL1-OE 组BMAL1mRNA 表 达 情况 另取 H9C2 细胞按 5×105个/孔接种于 6 孔板,按 1.4.1对照组和BMAL1-OE 组方案分组进行干预,24 h 后收集细胞,经RNAiso Plus 裂解后提取细胞总RNA,逆转录成cDNA 后,分别使用特异性引物进行qPCR 扩增分析。BMAL1引物:上游5'-GCCACTGACTACCAAGAAAG-3',下游5'-GTTCATTTTGTCCCGACGCC-3';GAPDH引物:上游 5'-AGTGCCAGCCTCGTCTCATA-3',下游 5'-ATGAAGGGGTCGTTGATGGC-3'。以GAPDH为内参,使用相对定量 2-ΔΔCT法计算BMAL1的相对表达水平。
1.6 CCK-8法检测细胞活力 H9C2细胞按8 000个/孔接种于96 孔板,按照2 种实验方案分别对细胞进行干预,24 h 后每孔中加入 10 μL 的 CCK-8 试剂,于 37 ℃孵育 1 h 后测定450 nm 吸光度(A450)值,计算各组细胞相对活力(%)=[A450(实验组)-A45(0空白)][/A45(0对照组)-A45(0空白)]×100%。
1.7 细胞上清SOD 和MDA 氧化应激状态检测 另取H9C2细胞按8 000个细胞/孔接种于96孔板,按照2种实验方案分别对细胞进行干预,24 h 后收集细胞上清液,采用羟胺法检测SOD活性、TBA法检测MDA含量,所有操作均按试剂说明书进行。
1.8 Western blot 法检测实验1中各组细胞BMAL1、NRF2和HO-1 蛋白表达 另取 H9C2 细胞按 5×105个/孔接种于 6 孔板,按照1.4.1分组干预,24 h后收集各组H9C2细胞用PBS清洗3次,RIPA裂解液提取总蛋白,BCA蛋白定量后煮沸变性。配置12%的SDS-PAGE,各泳道加入30 μg总蛋白电泳分离,转印至PVDF 膜后用5%脱脂奶粉封闭1 h,加入兔抗鼠一抗(1∶2 000)4 ℃孵育过夜,羊抗兔二抗(1∶4 000)室温孵育1 h,ECL 化学发光后成像系统采集,用Image J V1.5 分析条带灰度值(V),以GAPDH作为内参,分析目的蛋白相对表达水平,各组目的蛋白相对表达水平=[V(各组目的蛋白灰度值)/V(各组GAPDH 灰度值)]÷[V(对照组目的蛋白灰度值)/V(对照组GAPDH灰度值)]。
1.9 统计学方法 采用GraphPad Prism 8软件进行统计学分析。符合正态分布的计量数据用表示,2 组间比较用t检验,多组间比较采用单因素方差分析,组间多重比较采用Bonferroni校正的t检验,P<0.05为差异有统计学意义。
2 结果
2.1 实验1
2.1.1 H9C2细胞BMAL1过表达效果 与Control组相比,BMAL1-OE 组BMAL1mRNA 表达水平升高(1.02±0.07和4.21±0.25;n=6,t=29.660,P<0.01)。
2.1.2 BMAL1 过表达对各组细胞损伤和氧化应激的影响 与Control 组相比,H2O2组H9C2 细胞活力和细胞上清液SOD 活性降低,MDA 含量增加(P<0.05);与 H2O2组相比,BMAL1-OE+H2O2组 H9C2 细胞活力和细胞上清液SOD活性增加,MDA含量降低(P<0.05);与BMAL1-OE组相比,BMAL1-OE+H2O2组H9C2 细胞活力和细胞上清液SOD 活性降低,而MDA含量增加(P<0.05),见表1。
Tab.1 Comparison of cell viability,SOD activity and MDA content between the four groups表1 实验1中各组细胞活力、SOD活性、MAD含量的比较(n=6,)

Tab.1 Comparison of cell viability,SOD activity and MDA content between the four groups表1 实验1中各组细胞活力、SOD活性、MAD含量的比较(n=6,)
**P<0.01;a与Control组比较,b与H2O2组比较,c与BMAL1-OE组比较,P<0.05;BMAL1-OE组与Control 组、H2O2组无需比较,未作标记;表2同
组别Control组H2O2组BMAL1-OE组BMAL1-OE+H2O2组F细胞活力(%)101.30±2.65 60.01±2.58a 96.97±3.71 77.99±2.30bc 263.800**SOD活性(U/L)33.47±2.75 16.60±0.80a 35.81±4.87 24.26±2.45bc 64.700**MDA含量(μmol/L)4.14±0.80 6.92±0.83a 3.94±0.72 5.37±0.81bc 18.250**
2.1.3 各组NRF2 和HO-1 蛋白相对表达水平比较 与 Control 组相比,H2O2组 H9C2 细胞 BMAL1、NRF2和HO-1蛋白相对表达水平均降低(P<0.05);与 H2O2组 相 比 ,BMAL1-OE+H2O2组 H9C2 细 胞BMAL1、NRF2和HO-1蛋白相对表达水平增加(P<0.05),见图1、表2。

Fig.1 Comparison of BMAL1,NRF2 and HO-1 protein expression between the four groups图1 各组BMAL1、NRF2和HO-1蛋白相对表达水平比较
Tab.2 Comparison of BMAL1,NRF2 and HO-1 protein expression between the four groups表2 各组细胞BMAL1、NRF2和HO-1蛋白相对表达水平比较 (n=6,)
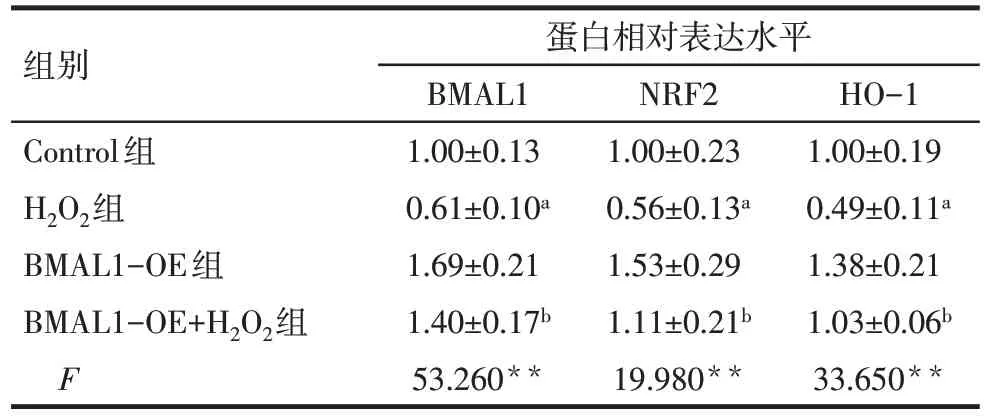
Tab.2 Comparison of BMAL1,NRF2 and HO-1 protein expression between the four groups表2 各组细胞BMAL1、NRF2和HO-1蛋白相对表达水平比较 (n=6,)
组别Control组H2O2组BMAL1-OE组BMAL1-OE+H2O2组F蛋白相对表达水平BMAL1 1.00±0.13 0.61±0.10a 1.69±0.21 1.40±0.17b 53.260**NRF2 1.00±0.23 0.56±0.13a 1.53±0.29 1.11±0.21b 19.980**HO-1 1.00±0.19 0.49±0.11a 1.38±0.21 1.03±0.06b 33.650**
2.2 实验 2 与 H2O2组相比,BMAL1-OE+H2O2组H9C2 细胞活力和细胞上清液SOD 活性增加,MDA含量降低(P<0.05);与BMAL1-OE+H2O2组相比,BMAL1-OE+ML385+H2O2组和BMAL1-OE+Znpp+H2O2组H9C2 细胞活力和细胞上清液SOD 活性降低,MDA含量增加(P<0.05),见表3。
Tab.3 Comparison of cell viability,SOD activity and MDA content between the four groups表3 实验2中各组细胞活力、SOD活性、MAD含量的比较(n=6,)

Tab.3 Comparison of cell viability,SOD activity and MDA content between the four groups表3 实验2中各组细胞活力、SOD活性、MAD含量的比较(n=6,)
**P<0.01;a与H2O2组比较,b与BMAL1-OE+H2O2组比较,P<0.05
组别H2O2组BMAL1-OE+H2O2组BMAL1-OE+ML385+H2O2组BMAL1-OE+Znpp+H2O2组F细胞活力(%)54.62±6.20 79.58±8.79a 65.33±4.58ab 65.09±3.72ab 16.750**SOD活性(U/L)12.86±2.10 28.20±3.24a 21.45±2.52ab 20.58±1.42ab 40.720**MDA含量(μmol/L)6.96±0.85 4.84±0.63a 6.16±0.31b 6.25±0.63b 11.600**
3 讨论
昼夜节律变化在生命体中广泛存在,主要由生物钟基因调控。研究显示,生物钟与心血管的生理功能关系密切,血压和心率的周期变化受控于生物钟,生物钟的失调会对心血管功能产生不利影响[6]。生物钟的疾病机制研究,对心血管疾病的防治是一个新的研究切入点[7]。BMAL1是生物钟节律调控的核心基因之一,其基因敲除后会导致节律丧失,对血压、心率和活动度产生重要影响[8]。本研究结果显示,与Control组相比,H9C2细胞感染BMAL1过表达慢病毒后BMAL1mRNA 表达水平升高,表明成功地构建了稳定过表达BMAL1的心肌细胞系。
H2O2作为构建心肌细胞损伤体外模型的常用方法,也是心血管疾病研究的重要工具[9]。本研究结果显示,与Control 组相比,H2O2组H9C2细胞活力降低,而BMAL1-OE+H2O2组细胞活力则显著高于H2O2组,提示 BMAL1 可减轻 H2O2诱导的 H9C2 细胞损伤,BMAL1 能够对抗心肌损伤发挥保护作用,与既往在糖尿病大鼠心肌损伤中BMAL1 的研究结果一致[10]。
氧化应激与多种心血管疾病的发生、发展有着密切关系,其所导致的心肌细胞损伤是疾病发生重要机制之一[11]。SOD作为生物体内存在的一种抗氧化酶,是清除自由基的重要分子;而MDA 则是脂质过氧化的重要产物之一,SOD和MDA被认为是反映生物体氧化应激状态的重要指标[12]。氧化应激水平同样具有昼夜节律性,生物钟基因和氧化应激均能参与调控心血管疾病[13]。本研究结果显示,与Control 组相比,H2O2组细胞上清液SOD 活性降低,MDA含量增加;与H2O2组相比,BMAL1-OE+H2O2组细胞上清液SOD 活性增加,MDA 含量降低,提示BMAL1 能对抗H2O2所诱导的氧化应激,这与Xie等[14-15]报道的敲低BMAL1能促进氧化应激,诱导动脉粥样硬化或胰岛β 细胞凋亡的结果相类似,表明BMAL1能够减轻氧化应激损伤。
NRF2/HO-1 信号轴为氧化应激调控中重要的信号通路,BMAL1能够和NRF2协同作用,从而调控氧化还原稳态[16]。本研究结果显示,与Control 组相比,H2O2组 NRF2 和 HO-1 蛋白表达受到抑制,而BMAL1过表达则能促进NRF2和HO-1的蛋白表达。因此,笔者认为BMAL1可能通过NRF2/HO-1途径,调控心肌细胞损伤和氧化应激。为了证实BMAL1是否通过NRF2/HO-1 发挥调控作用,本研究采用NRF2 抑制剂 ML385 或 HO-1 抑制剂 Znpp 分别进行干预。由于ML385和Znpp均为公认的抑制剂,两者对于NRF2和HO-1的抑制效果是明确的。因此,本研究未对各组中NRF2 和HO-1 的蛋白表达进行验证。本研究结果表明,抑制NRF2 或HO-1 后,BMAL1 的细胞保护和抗氧化作用均减弱,提示BMAL1 可通过NRF2/HO-1 信号轴减轻H2O2诱导的H9C2 细胞损伤和氧化应激。这与既往研究报道中的巨噬细胞 BMAL1 能调控 NRF2 的结果相类似[17]。然而BMAL1 对于心血管疾病相关的心肌细胞和内皮细胞的研究尚鲜见报道。研究显示,BMAL1作为一种核转录因子,能与E-Box 元件(nCACGTGn)相结合而调控靶基因转录;大鼠NRF2启动子序列中均含有该序列元件,其机制可能是BMAL1通过转录调控NRF2使NRF2/HO-1 信号轴活化,从而抵抗氧化应激损伤[18]。
综上所述,节律基因BMAL1可减轻H2O2诱导的大鼠心肌细胞损伤和氧化应激,从而发挥其心肌细胞保护作用。其机制可能与调控NRF2/HO-1 信号轴有关。
