6-羧基壳寡糖清除活性氧的能力及作用机理
2021-08-26杨晓莉唐延东张方东裴继诚
杨晓莉,唐延东,张方东,裴继诚
(天津市制浆造纸重点实验室,天津科技大学轻工科学与工程学院,天津 300457)
活性氧(ROS)是氧通过单电子还原产生的一类含氧且化学性质活泼的物质,主要包括羟基自由基、烷氧自由基、超氧阴离子自由基、过氧化氢等自由基与非自由基物质,其中羟基自由基和超氧阴离子自由基的数量最多、分布最广泛、攻击性最强[1].活性氧的产生与紫外光老化有关,紫外线照射产生的 ROS会攻击磷脂双分子层、核酸和细胞器,造成细胞损伤,从而导致皮肤衰老[2].过多的ROS还会引发血管疾病、阿兹海默症、癌症等疾病,因此,清除多余的ROS很有必要[3-5].研究表明:使用外源性自由基清除剂二丁基羟基甲苯(BHT)、丁基羟基茴香醚(BHA)、维生素 C(VC)等可有效清除 ROS,但 BHT和 BHA这类化学合成的自由基清除剂溶解性受限,且长期使用可能会对健康造成危害[6];VC是天然高效自由基清除剂,但具有光敏性,暴露在光照下刺激皮肤且容易失效.因此,寻找安全、高效的天然自由基清除剂成为趋势.
壳寡糖(COS)主要来源于虾蟹壳等海洋资源,是世界上最丰富的可再生资源之一,它由 β-(1-4)-2-氨基-2-脱氧-D-葡萄糖单体组成,分子链上有较为活泼的—OH及—NH2基团,易发生氧化、醚化、季铵化和烷基化等反应[7].同时,壳寡糖具有生产成本低、无毒非致敏性、溶解性好等优良特点[8-9],还具有抗菌、抗肥胖、抗炎症等功能,在医药、食品等领域得到了广泛的应用[10].因此,通过改性壳寡糖提高其性能及开发新功能产品成为研究热点之一.
6-羧基壳寡糖(C-COS)作为一种壳寡糖改性后得到的水溶性衍生物,其分子骨架含有大量阴离子和阳离子基团.近年来,本课题组对 C-COS的保湿性、抗黑色素沉积及抗菌性能进行研究[11-12],但对 ROS的清除能力尚未系统研究.有实验表明,壳寡糖相对分子质量大小和脱乙酰度对清除自由基具有重要影响,相对分子质量越小、脱乙酰度越高的壳寡糖具更好的清除自由基效果[13].此外,有报道[14-15]指出 O-羧甲基壳聚糖和 N-羧甲基壳聚糖相比壳聚糖具有较高的抗氧化活性,表明羧甲基基团的出现提高了壳聚糖的抗氧化活性,这对选择 6-羧基壳寡糖(C-COS)清除ROS提供重要研究思路.
本文选择低相对分子质量、高脱乙酰度的壳寡糖为原材料,用一种绿色环保的方法将壳寡糖 C6伯羟基(—OH)氧化成羧基(—COOH),制备出 6-羧基壳寡糖(C-COS),并采用红外光谱、核磁共振等方法对6-羧基壳寡糖进行表征.通过体外实验探究 6-羧基壳寡糖清除 ROS的能力,并与壳寡糖及 VC进行对比.根据实验结果并结合自由基产生途径,对清除ROS的机理进行分析.
1 材料与方法
1.1 原料与仪器
漆酶,酶活 1072U/mL,诺维信生物技术有限公司;壳寡糖,相对分子质量约为 1000,脱乙酰度90.5%,上海源叶生物科技有限公司;2,2,6,6-四甲基哌啶-1-氧基(TEMPO),Sigma-Aldrich 公司;其他试剂及溶剂纯度为分析纯.
N-1100型旋转蒸发仪,东京理化仪器有限公司;VERTEX 70型傅里叶变换红外光谱仪,德国布鲁克公司;AVANCE Ⅲ400型核磁共振波谱仪,瑞士布鲁克拜厄斯宾有限公司;AT-510型自动电位滴定仪,日本京都电子工业株式会社;UV-2550型紫外分光光度计,日本岛津公司.
1.2 制备方法
取 0.08g 2,2,6,6-四甲基哌啶-1-氧基(TEMPO)溶于 250mL pH=4.7的乙酸-乙酸钠缓冲溶液,加入4g壳寡糖充分搅拌,放置30℃水浴锅中反应 15min;添加 0.4mL漆酶,进行持续 18h的通氧反应;通氧结束后调节反应液至中性;将反应液进行旋蒸,旋蒸至 15mL时,转移至烧杯中并加入300mL无水乙醇,静置 60min;待反应产物析出后,进行真空抽滤,反复醇洗过滤产物至醇洗液澄清;将滤饼放置真空干燥箱 40℃烘干 48h,烘干后研磨得样品粉末.
1.3 表征方法
1.3.1 傅里叶变换红外光谱(FTIR)检测
称取干燥的0.001g样品和0.1g溴化钾,在玛瑙研钵中快速充分研磨后压片 1min,以空气作为采样背景,将压好的样品立刻放入红外光谱仪中进行扫描.设定扫描范围为 400~4000cm-1,分辨率为4cm-1,扫描次数为 32次.
1.3.2 核磁共振(13C NMR)检测
称取150mg样品溶于0.55mL的D2O中,设置采样条件为30°脉冲序列,扫描时间1.36s,弛豫时间1.89s,累积扫描1024次.
1.3.3 酸碱电导滴定检测
称取0.2g样品,溶于10mL 0.1mol/L的HCl溶液中进行酸化,溶解后再加入 90mL水稀释,静置待测.打开自动电位滴定仪,使用 0.1mol/L的 NaOH标准溶液进行滴定,记录 NaOH的消耗体积和电导率,通过式(1)计算出样品的羧基含量.
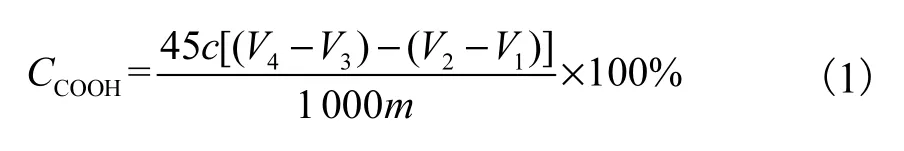
式中:V1、V2和 V3、V4分别为壳寡糖溶液和样品溶液滴定曲线的计量点,代表 NaOH 的消耗体积,mL;c为氢氧化钠溶液的浓度,mol/L;m 为样品质量,g;45为羧基的相对分子质量.
1.4 清除ROS能力的检测
1.4.1 羟基自由基的清除
FeSO4与 H2O2反应产生羟基自由基(·OH),·OH氧化水杨酸产生有色物质,·OH 越多,生成紫色颜色越深.参考 Zhang等[16]的方法,实验设样品组、空白组、对照组.样品组:添加 2mL 6mmol/L的 FeSO4溶液和 2mL 6mmol/L的 H2O2溶液后,再分别添加2mL不同浓度的样品溶液(6-羧基壳寡糖溶液、壳寡糖溶液、抗坏血酸溶液),静置 10min,加入 2mL 6mmol/L的水杨酸溶液摇匀,37℃温水浴 30min,5000r/min离心5min,取上清液于波长510nm处测其吸光度.用蒸馏水代替样品为空白组,用蒸馏水代替水杨酸为对照组.按照式(2)计算·OH的清除率.
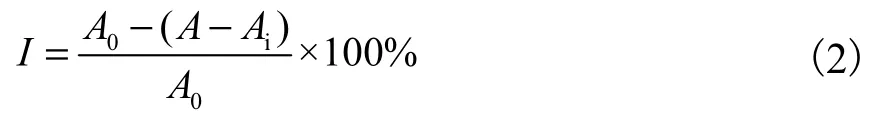
式中:I表示清除率,%;A为样品组吸光度;Ai为对照组吸光度;A0为空白组吸光度.
1.4.2 过氧化氢的清除[17]
用 100mL pH 7.4的磷酸盐缓冲溶液配制20mmol/L过氧化氢(H2O2)溶液.取 3组试管,分别添加l mL不同浓度的6-羧基壳寡糖样品液、壳寡糖样品液、抗坏血酸样品液,同时各加入 2mL H2O2均匀混合,避光 10min后用紫外分光光度计测定其在230nm处的吸光度.用蒸馏水代替样品液为空白组,用蒸馏水代替 H2O2为对照组.按照式(2)计算 3种样品液对过氧化氢的清除率.
1.4.3 烷氧自由基的清除[18]
铁离子可诱导脂质物质产生烷氧自由基(RO·),在加热情况下硫代巴比妥酸(TBA)与过氧化物产生红色化合物.脂质体 PBS分散体系(LLS)的配制:用PBS溶液(0.01mol/L、pH 7.4)溶解 30mg卵磷脂配制 10mg/mL的溶液,标记为 LLS待用.取 100mL烧杯,依次加入 40mL蒸馏水、15g三氯乙酸(TCA)、0.37g硫代巴比妥酸(TBA)、2mL的浓HCl,搅拌至溶解后移液至 100mL容量瓶并用蒸馏水定容,标为 TCA-TBA-HCl.向试管中依次加入1mL LLS、1mL 400µmol/L FeCl3、1mL 不同浓度的样品溶液,混匀后放置暗室 37℃水浴 1h,再加入2mL配制完成的TCA-TBA-HCl混合液,90~100℃水浴 15min,水浴结束后置于冰水冷却,混合液在4000r/min条件下离心 10min,测定上清液在波长532nm处的吸光度.用蒸馏水代替样品液为空白组,用蒸馏水代替 TCA-TBA-HCl为对照组,按式(2)计算3种样品液对烷氧自由基的清除率.
1.4.4 超氧阴离子自由基的清除
邻苯三酚在碱性条件下可生成有色的中间产物超氧阴离子自由基(),产物颜色越深代表超氧阴离子自由基生成越多,可用分光光度法进行检测.参考Acker等[19]的方法取3组试管分别加入0.5mL不同浓度的 6-羧基壳寡糖样品液、壳寡糖样品液、抗坏血酸样品液,再均加入6mL Tris-HCl(50mmol/L,pH 8.1)缓冲溶液,混匀后 37℃水浴处理 10min,然后各加入 lmL经 37℃预热过的邻苯三酚盐酸溶液(7mmol/L),摇匀,精确反应 4min后加 0.5mL浓HCl终止反应,在 325nm 波长处测定吸光度.用蒸馏水代替样品液为空白组,用蒸馏水代替邻苯三酚溶液为对照组,按照式(2)计算 3种样品溶液对·O2-的清除率.
1.5 螯合亚铁离子能力的检测[20]
取 1mL 5mmol/L COS、C-COS溶液分别与0.05mL 2mmol/L 的 FeSO4溶液混合,静置 3min,然后加入 0.1mL 5mmol/L菲洛嗪溶液,37℃静置15min 使反应达到平衡后测定在 562nm 处的吸光度.用蒸馏水代替样品溶液为空白组,用蒸馏水代替FeSO4溶液为对照组.通过式(3)计算COS与C-COS两种溶液螯合Fe2+的能力.

式中:R表示螯合能力,%;A0为空白组吸光度;A为样品组吸光度;Ai为对照组吸光度.
2 结果与讨论
2.1 结构表征分析
2.1.1 傅里叶变换红外光谱(FTIR)分析
壳寡糖(COS)和 6-羧基壳寡糖(C-COS)的红外光谱如图1所示.由图1可知:两者出峰位置大致相同,在 3400cm-1至 3200cm-1处,C-COS比 COS的吸收谱带明显变宽,说明 C-COS的—OH与—NH2强度增加;2880cm-1和 2930cm-1处为 C—H 的伸缩振动峰,主要代表了 C6位的亚甲基和 C2位所连接的乙酰氨基上的甲基;1640cm-1的 N—H弯曲振动峰仍然存在,说明两者均残留部分乙酰胺基;CCOS的 1600cm-1与 1410cm-1处出现了新的较为明显的C=O不对称伸缩振动吸收峰[21],说明壳寡糖氧化后新生成了羧基或醛基.
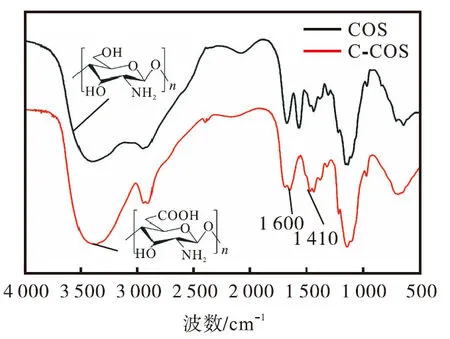
图1 COS与C-COS的红外光谱图Fig.1 Infrared spectra of COS and C-COS
2.1.2 核磁共振(13C NMR)分析
COS与 C-COS溶于 D2O后所得的核磁共振(13C NMR)谱图如图2所示.由图2可知:图中共有6处较为明显的共振峰,从左往右依次位于化学位移101.35、76.54、74.66、72.04、60.16 和 55.52 处,分别代表 COS 与 C-COS 结构上的 C1、C4、C5、C3、C6和 C2[22],表明 COS与 C-COS的吡喃环未被破坏;COS与C-COS分别在化学位移174.78处和174.38处出现较强共振峰,代表COS与C-COS存在部分乙酰氨基(CH3CONH—)[23];COS、C-COS 在化学位移181.61处出现了新的共振峰,与羧酸根(—COO-)的共振峰在 170~190范围内相吻合[24],证明产生新的羧基官能团.综上所述,鉴于吡喃环结构未破坏,C3位仲羟基不能被氧化,C6位伯羟基依然存在,又有新官能团羧基的出现,溶液中又有 Na+存在,推断出漆酶/TEMPO体系是将壳寡糖部分C6位伯羟基氧化成羧酸根后,以羧酸的钠盐形式存在,结合红外光谱检测的结果,说明6-羧基壳寡糖制备成功.
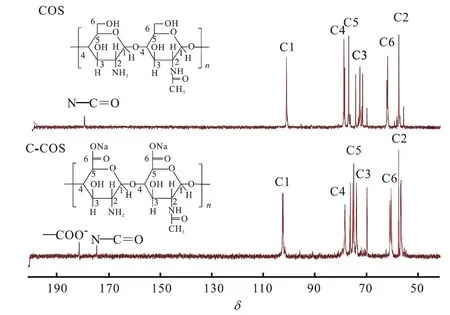
图2 COS与C-COS的核磁共振(13C NMR)谱图Fig.2 13C NMR spectra of COS and C-COS
2.1.3 酸碱电导滴定分析
利用酸碱电导滴定得到 COS与 C-COS相关数据绘制曲线,计算 C-COS中羧基含量,结果如图3所示.由图3可知:两者第一阶段均是溶液中的 HCl与 NaOH 反应,随着滴定的进行,H+与 OH-不断结合生成不导电的 H2O,电导率下降;第二阶段,壳寡糖(COS)的—NH2会与 HCl反应生成氨基盐酸盐(RNH3Cl),氨基盐酸盐与 NaOH反应过程中溶液内的 Na+等离子不断增加,故电导率有短暂上升,而 6-羧基壳寡糖(C-COS)除了氨基盐酸盐,还有RCOONa在HCl溶液下生成的RCOOH、RCOOH与NaOH反应,电导率缓慢上升;第三阶段,当溶液中的羧酸和氨基盐酸盐与 NaOH完全反应后,随着NaOH溶液消耗体积的增加,电导率会快速增大.
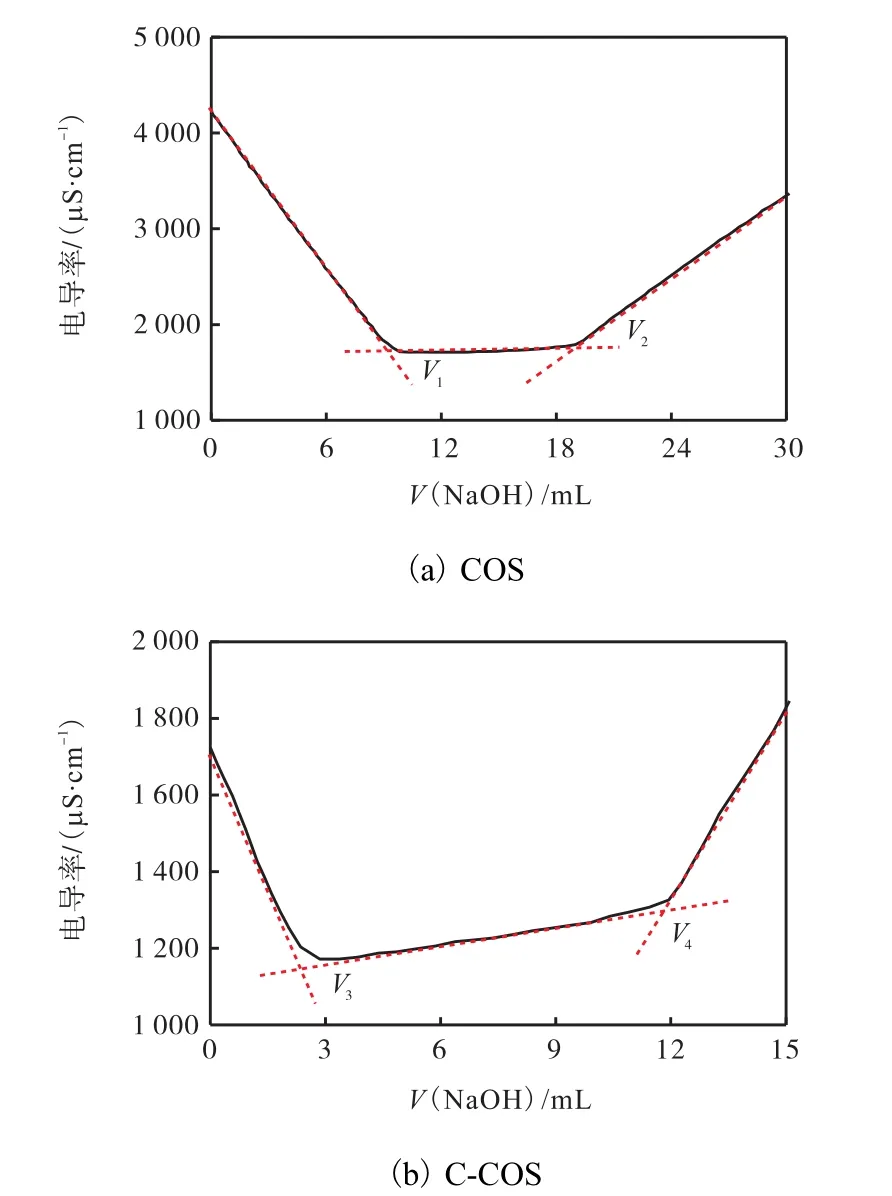
图3 COS与C-COS的酸碱电导滴定分析图Fig.3 Acid-base conductance titration analysis of COS and C-COS
将图3电导滴定曲线中的 4个化学计量点对应的体积(V1、V2、V3、V4)代入式(1),计算后得到了 6-羧基壳寡糖的羧基含量为1.68%,这说明氧化只是将部分C6位羟基氧化为羧基.
2.2 C-COS体外清除ROS能力
2.2.1 对羟基自由基的清除活性
亚铁离子与过氧化氢反应可产生大量羟基自由基,添加不同质量浓度的 COS和 C-COS,考察样品对羟基自由基的清除作用,并与天然抗氧化剂VC进行比较,得到清除曲线,如图4所示.由图4可知:在0~6mg/mL范围内,COS、C-COS及VC的羟基自由基清除率均随浓度增大显著提高;当质量浓度升至4mg/mL时,此时COS、C-COS及VC对羟基自由基的清除率分别为 32%、93%、99%,之后曲线趋于平缓,清除率较为稳定;且质量浓度为 6mg/mL时,CCOS的羟基自由基清除率高达98%,其清除率与VC几乎相同,此时的 COS的羟基自由基清除率仅为33%.可见,C-COS对羟基自由基的清除能力为COS的 2~3倍.这些结果表明,相比壳寡糖(COS),6-羧基壳寡糖(C-COS)有更好的羟基自由基清除效果.
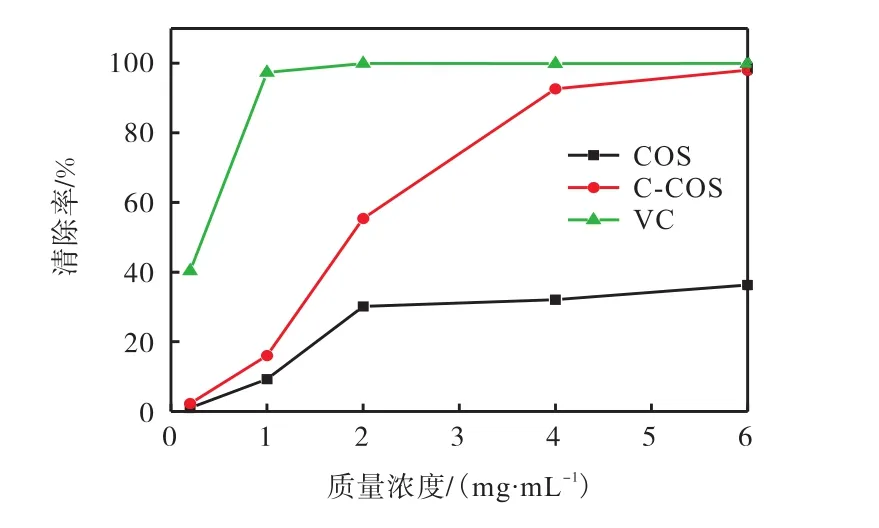
图4 COS与C-COS对羟基自由基的清除作用Fig.4 Scavenging effect of COS and C-COS on hydroxyl radicals
2.2.2 对过氧化氢的清除活性
用定量的过氧化氢,考察不同质量浓度的 COS、C-COS、VC对过氧化氢的清除效果,清除曲线如图5所示.
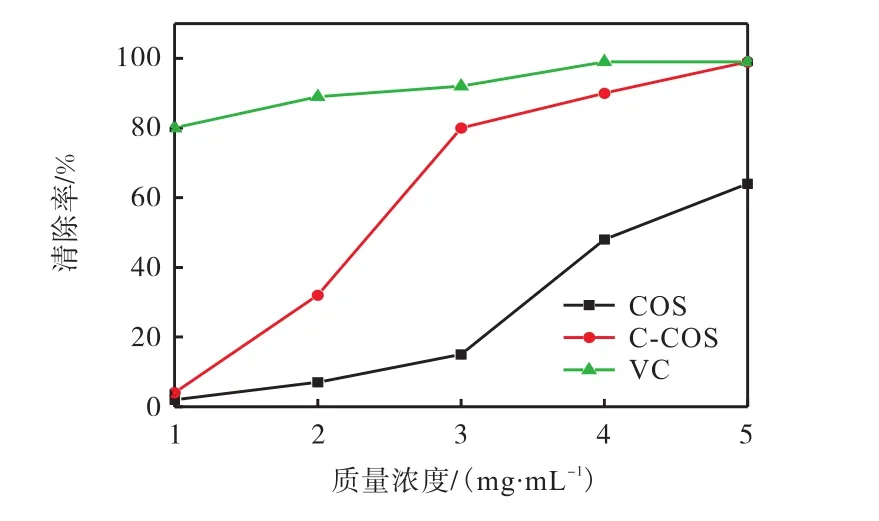
图5 COS与C-COS对过氧化氢的清除作用Fig.5 Scavenging effect of COS and C-COS on hydrogen peroxide
由图5可知:在样品质量浓度范围为 1~5mg/mL时,COS与 C-COS清除过氧化氢能力随浓度上升而增强;在 5mg/mL质量浓度下,C-COS与COS对过氧化氢的清除率分别为 99%和 64%,CCOS较COS过氧化氢清除率显著提高35%,且接近VC的清除率.结果表明,6-羧基壳寡糖较壳寡糖对过氧化氢的清除活性有所提高,且清除效果显著.
2.2.3 对烷氧自由基的清除活性
氧化卵磷脂可产生烷氧自由基,考察不同质量浓度的COS、C-COS与VC对烷氧自由基的清除效果,清除曲线如图6所示.由图6可知:COS与 C-COS对烷氧自由基具有清除作用,且在 1~5mg/mL范围内,随着COS与 C-COS浓度的增加,清除烷氧自由基能力逐渐增强.在质量浓度为 5mg/mL时,COS、C-COS、VC对烷氧自由基的清除率分别为 37%、59%、98%,C-COS较 COS清除率增加 22%,较 VC清除率减少 39%.这说明 6-羧基壳寡糖对烷氧自由基的清除效果强于壳寡糖,与VC相比还有差距.

图6 COS与C-COS对烷氧自由基的清除作用Fig.6 Scavenging effect of COS and C-COS on alkoxy radicals
2.2.4 对超氧阴离子自由基的清除活性
通过邻苯三酚自氧化法制备出超氧阴离子自由基,配制不同质量浓度的 COS进行超氧阴离子清除实验,并与同质量浓度下的 C-COS、VC进行对比,得清除曲线如图7所示.
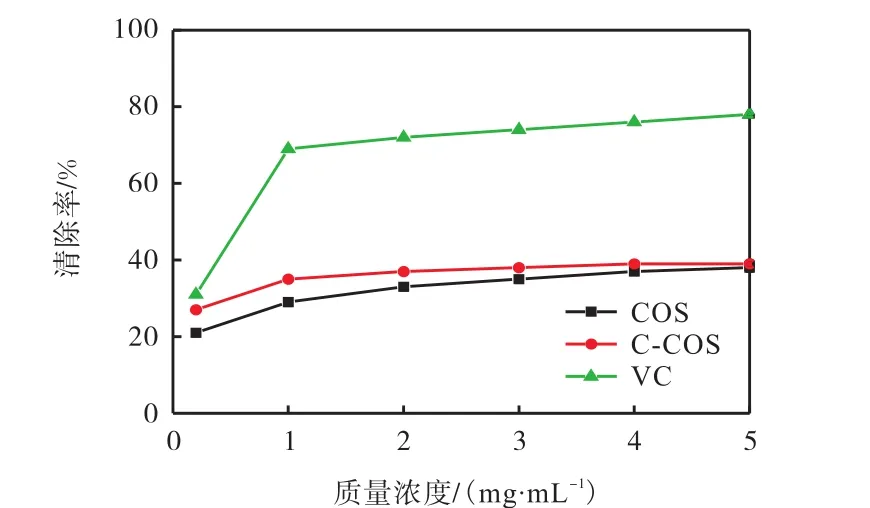
图7 COS与C-COS对超氧阴离子自由基的清除作用Fig.7 Scavenging effect of COS and C-COS on superoxide anion radical
由图7可知:COS与C-COS对超氧阴离子自由基存在清除作用,在样品浓度梯度为 0~5mg/mL时,COS与 C-COS清除超氧阴离子自由基能力均随浓度上升有缓慢提高,但提高效率明显不如清除羟基自由基;在 1mg/mL时,COS与 C-COS对超氧阴离子自由基的清除率分别是29%、35%,C-COS对超氧阴离子自由基的清除率仅比 COS多 6%,即 6-羧基壳寡糖较壳寡糖有小幅度的清除增强效果,效果不显著的原因可能与清除不同自由基机制有关.
2.3 螯合亚铁离子的能力
亚铁离子等金属离子被认为是影响活性氧自由基产生的重要因素之一,亚铁离子越多,促进产生的自由基越多.通过对比COS与C-COS螯合亚铁离子的能力大小,可进一步对其螯合作用官能团进行判断.COS与 C-COS螯合亚铁离子能力如图8所示.由图8可见:在 1~5mg/mL质量浓度范围间,随样品溶液浓度的升高,COS与C-COS对亚铁离子的螯合能力逐渐增强.在质量浓度为 5mg/mL时,COS与 C-COS对亚铁离子的螯合能力分别为 25%和58%,C-COS较 COS螯合亚铁离子能力增强 33%.由于C-COS与COS的唯一区别是C6位官能团的变化,推测出螯合能力的增强可能与 C-COS中 C6位羧基的出现有关.
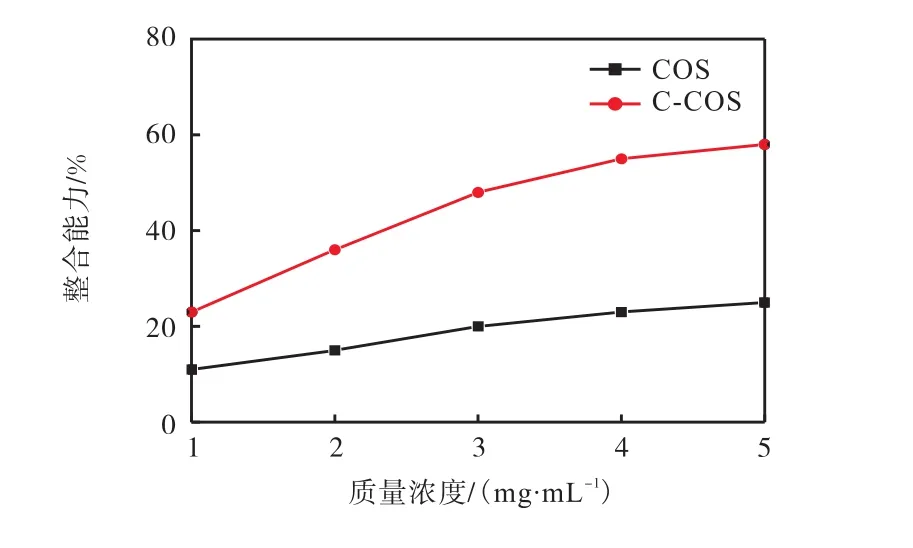
图8 COS与C-COS螯合亚铁离子的能力Fig.8 Ability of COS and C-COS chelating ferrous ions
3 清除自由基机理
自由基的生成为一系列连锁反应,包括引发、增值、终止3个阶段,因此对应有3种清除自由基的途径.一是尽可能避免紫外线、辐射等自由基引发条件;二是减少 Fe2+等可以促进自由基生成的金属离子;三是促使带电子物质与自由基结合生成稳定大分子自由基[25-26].通过对比 6-羧基壳寡糖和壳寡糖清除活性氧(ROS)实验,发现 6-羧基壳寡糖清除活性氧的能力相比壳寡糖均有不同程度的提高,即壳寡糖C6位羟基氧化为羧基后,清除活性氧能力增强.结合2.3节螯合亚铁离子实验结果,推测机理如图9所示.图9(a)、(b)为COS清除ROS机理,作用基团为C6位羟基、C3位羟基和 C2氨基,作用基团结合自由基(R·),生成稳定大分子物质;同时溶液中氨基发生质子化过程,所以氨基清除 ROS能力减弱,此过程羟基清除占主导地位.图9(c)、(d)、(e)为 C-COS清除 ROS机理,作用基团为 C3位羟基、C2氨基和C6羧酸根.由于C-COS的C6位有羧酸根(—COO-)的存在,羧酸根质子化抑制氨基(—NH2)形成,进而更多氨基的孤电子对提供电子给自由基(R·),生成稳定的自由基大分子;同时羧酸根本身具有螯合金属离子能力[29],多组 6-羧基壳寡糖的—COO-与 F e2+等金属离子螯合,进而阻止金属离子催化氧化生成ROS.所以,此过程氨基清除和羧酸根清除起主要作用,两者共同作用大于 COS羟基的清除效果,所以整体评价C-COS清除ROS效果强于COS清除ROS效果.综上所述,可看作6-羧基壳寡糖抑制氨基质子化与螯合金属离子两者协同作用,即通过第二、第三途径提高了清除ROS的能力.
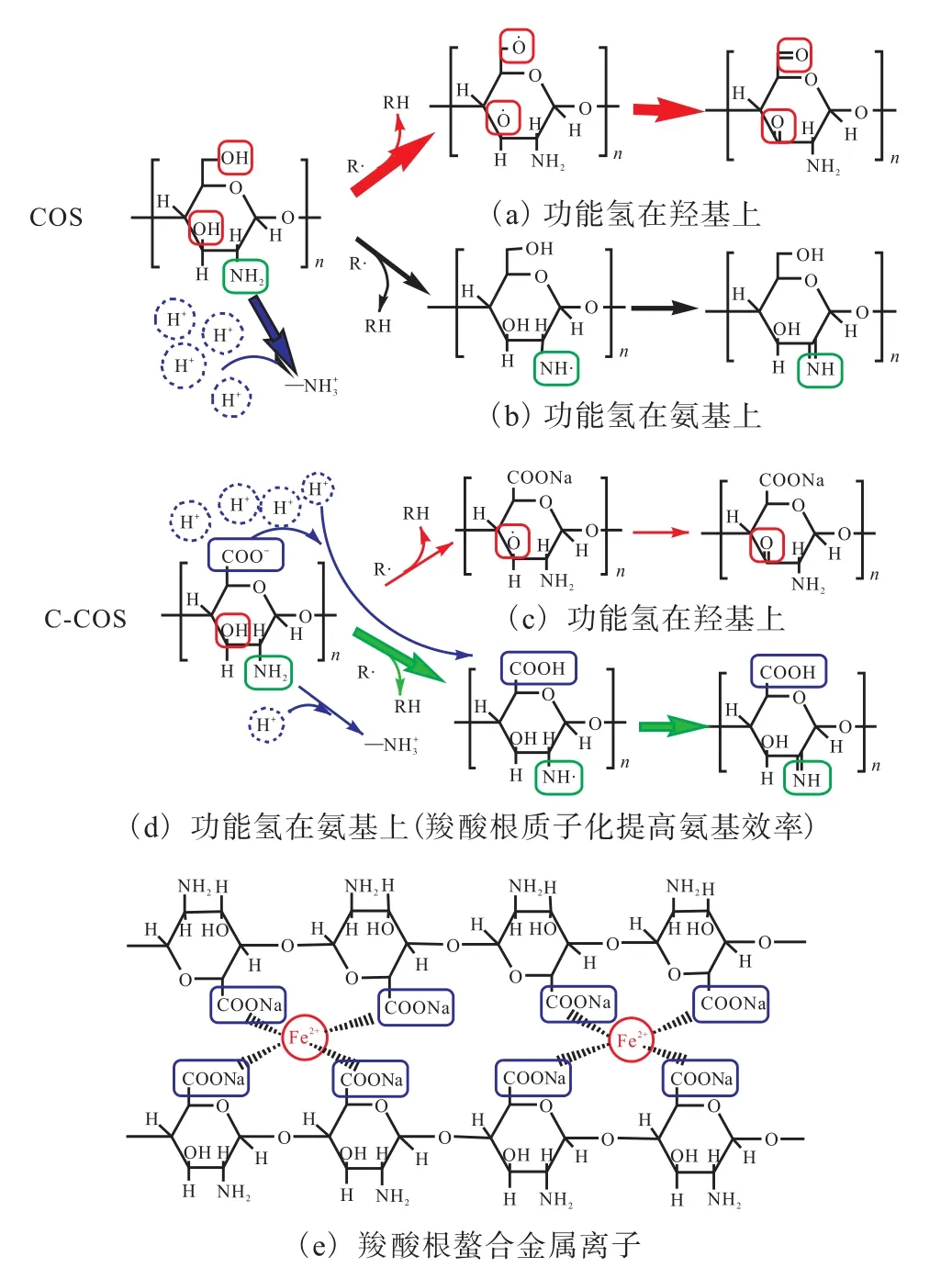
图9 COS和C-COS清除ROS机理图Fig.9 ROS scavenging mechanism diagram of COS and C-COS
4 结 论
(1)利用漆酶/TEMPO 体系对壳寡糖(COS)分子结构的C6位进行氧化修饰,成功制备出6-羧基壳寡糖(C-COS).
(2)通过体外实验法发现 6-羧基壳寡糖(CCOS)较壳寡糖(COS)具有更高的清除 ROS能力,并且随浓度的升高清除率逐渐提高,表明羧酸根的加入和浓度的大小可以影响清除活性氧的能力.其中不同氧自由基清除效果不一,清除能力大小为H2O2≥·OH>RO·>,清除自由基能力不同可能与自由基产生机制不同有关.
(3)羟基自由基(·OH)作为最常见、最活跃、高流动性的自由基,6-羧基壳寡糖对其和过氧化氢的清除效果最佳,清除率可达 98%以上,最接近天然抗氧化剂 VC的清除效果,说明 6-羧基壳寡糖在抗氧化方面也有较大的应用价值.
(4)根据羧酸根具有质子化和螯合金属离子的特点,结合自由基产生的机理,可进一步分析 6-羧基壳寡糖提高清除活性氧的原因,说明 C6位羧基和 C2氨基在清除自由基方面起积极作用,这也为壳寡糖类似结构物质的改性及应用提供了重要思路.
