miR-27a及其靶标PPAR-γ与冠心病合并2型糖尿病的相关性分析*
2021-08-26黄昌志许学忠刘小菁
黄昌志,许学忠,刘小菁
1.海南省万宁市人民医院急诊内分泌科,海南万宁572000;2.海南省万宁市妇幼保健院药剂科,海南万宁571500
2型糖尿病(T2DM)是冠心病(CAD)的高风险因素之一[1]。微小RNA(miRNA)已经成为多种疾病预测或诊断中最具潜力的生物学分子[2]。CHEN等[3]研究发现,miR-27a能够通过靶向抑制过氧化物酶体增殖物激活受体-γ(PPAR-γ)表达促进胰岛素抵抗并影响糖脂代谢。PPAR-γ属于一类配体激活转录因子,在控制糖脂代谢过程中发挥关键作用[4]。目前,已知PPAR-γ与多种代谢性疾病有关,如高脂血症、糖尿病和CAD[5]。为了明确miR-27a在预测CAD合并T2DM方面的作用,本研究分析了CAD、T2DM及CAD合并T2DM患者中循环miR-27a及其靶点PPAR-γ的表达差异。
1 资料与方法
1.1一般资料 经万宁市人民医院医学伦理委员会批准,并提供书面知情同意书。选取万宁市人民医院2018年12月至2019年12月的147例受试者作为研究对象,男89例,女58例,年龄37~82岁,平均(54.39±12.95)岁。男选取36例健康人群作为对照组,空腹血糖(FBG)、糖化血红蛋白(HbA1c)、血生化指标均正常;既往无T2DM、高血压、CAD或其他心血管疾病史,入组前3个月未因任何慢性疾病服用药物。选取38例单纯T2DM患者作为T2DM组,根据美国糖尿病协会指南[7],患者HbA1c水平≥6.5%,无其他糖尿病并发症,且排除不稳定型心绞痛患者、无创心功能检查阳性、脑血管疾病、冠状动脉疾病、外周动脉疾病、急性冠状动脉综合征者。选取36例单纯CAD患者作为CAD组,根据阳性病史(心肌梗死、心绞痛和冠状动脉旁路移植术)和/或常规12导联心电图上的缺血性变化(包括ST段压低或Q波改变)和/或血管造影结果(至少有1根冠状动脉狭窄>70%)诊断。选取37例CAD合并T2DM患者作为CAD-T2DM组,诊断为CAD,且患者HbA1c水平≥6.5%,具有T2DM病史。除上述以外,所有研究对象还需排除1型糖尿病、脑卒中、心肌梗死、恶性肿瘤、肝肾功能障碍、慢性炎症、自身免疫性疾病。
1.2方法
1.2.1人体测量学和生物化学测量 采用标准公式[体质量(kg)/身高2(m2)]计算体质量指数(BMI)。此外,使用标准血压计测量研究对象休息15 min后的收缩压(SBP)和舒张压(DBP)。禁食8 h以上收集所有研究对象的静脉血,检测FBG、三酰甘油(TG)、总胆固醇(TC)、低密度脂蛋白胆固醇(LDL-C)、高密度脂蛋白胆固醇(HDL)、丙氨酸氨基转移酶(ALT)、天门冬氨酸氨基转移酶(AST)和肌酐(Cr)。另外采用酶联免疫吸附试验(ELISA)测定空腹胰岛素(Fins)水平。胰岛素抵抗指数(HOMA-IR)的计算公式如下:HOMA-Ir=[FBG(mg/dL)]×[Fins(μU/mL)]/405。
1.2.2采用实时荧光定量PCR检测血清miR-27a表达水平 抽取静脉血10 mL,使用750 μL TRIzol®LS试剂(美国Invitrogen公司)从250 μL血清中提取循环RNA,并用35 μL预热(65 ℃)洗脱液进行洗脱。血清与三唑醇混合后,加入10 μL秀丽隐杆线虫miR-39(0.05 μmol/L,由中国上海基因公司合成)。使用NanoDrop 1000(美国Thermo Fisher Scientific公司)进行RNA定量。用Taqman MicroRNA反转录试剂盒(美国Applied Biosystems公司)进行反转录。qPCR在20 μL体积反应中进行,并用Bio Rad IQ5热循环仪(美国Bio Rad Laboratories公司)进行热循环处理:94 ℃ 1 min,然后94 ℃ 15 s+60 ℃30 s循环40次。使用2-ΔΔCq方法计算miR-27a相对于其内参的表达水平。引物序列如下:miR-27a正向为5′-GCG GAA CTT AGC CAC TGT GA-3′;反向为5′-TGA GGA GCA GGG CTT AGC TG-3′。
1.2.3血清PPAR-γ水平检测 根据制造商说明书,采用人PPAR-γ ELISA试剂盒(美国Protein Tech公司)检测血清PPAR-γ水平,在450 nm波长处测定吸光度(A值)。根据拟合的标准浓度A值曲线计算血清样本中PPAR-γ水平(pg/mL)。
1.2.4双荧光素酶报告基因分析 经在线软件TargetScan Human7.2预测血清miR-27a及靶基因PPAR-γ的结合位点,采用Genecreate设计并构建报告基因 pmirGLO-PPARγ-3′UTR-WT、pmirGLO-PPARγ-3′UTR-MUT。荧光素酶试验是采用双荧光素酶报告分析系统(美国Promega公司),根据产品说明执行。HEK293T细胞分别与miR-27a、 miR-NC、 ppmirGLO-PPARγ-3′UTR-WT、pmirGLO-PPARγ-3′UTR-MUT共转染36 h。将细胞溶解并测量荧光素酶活性。
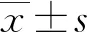
2 结 果
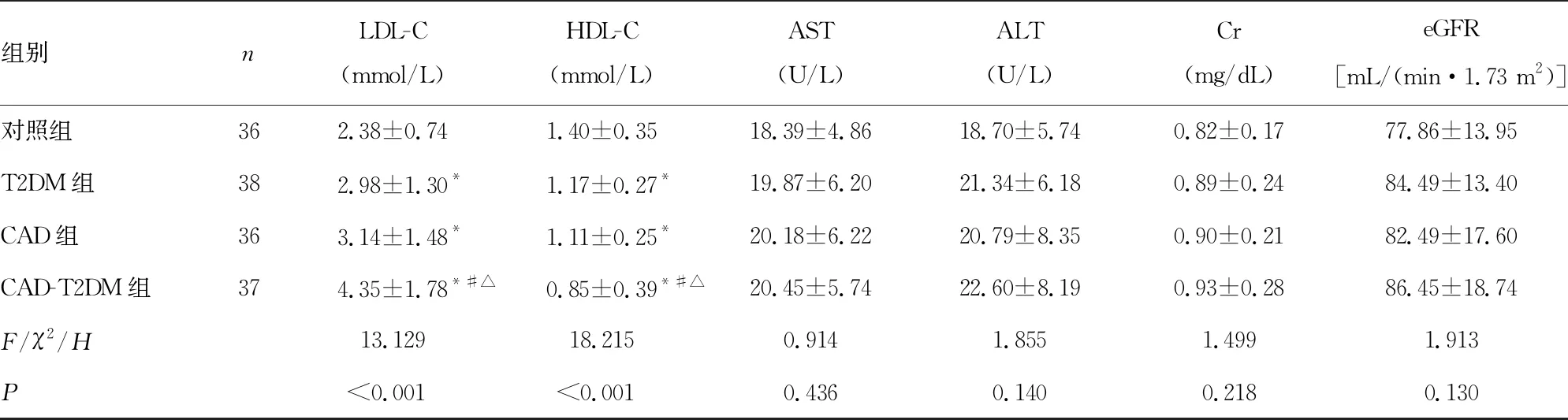
2.14组研究对象一般资料及生化指标水平比较 与对照组比较,CAD-T2DM组患者SBP、HbA1c、FBG、HOMA-IR、TG、TC、LDL-C水平均明显升高,HDL-C水平明显降低,差异均有统计学意义(P<0.05);4组其他一般资料和生化指标比较,差异均无统计学意义(P>0.05)。见表1。
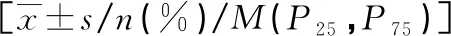
表1 4组研究对象一般资料及生化指标水平比较
组别nDBP(mm Hg)HbA1c(%)FBG(mg/dL)HOMA-IRTG(mmol/L)TC(mmol/L)对照组3678.44±5.605.42±0.4397.0(88.0,107.0)0.95±0.561.48±0.393.95±0.82T2DM组3881.61±8.957.95±1.03*189.0(156.0,239.2)*2.85±1.04*1.60±0.654.81±1.72*CAD组3682.36±11.275.54±0.35#97.5(82.7,109.5)#0.96±0.47#1.85±0.73*4.96±1.26*CAD-T2DM组3782.68±12.398.53±0.89*#△198.2(153.5,257.8)*△3.38±1.25*△2.34±1.01*#△5.74±1.63*#F/χ2/H1.389173.40847.25673.01210.0959.879P0.249<0.001<0.001<0.001<0.001<0.001
注:与对照组比较,*P<0.05;与T2DM组比较,#P<0.05;与CAD组比较,△P<0.05。
2.24组研究对象血清miR-27a、PPAR-γ水平比较 与对照组比较,T2DM组、CAD组、CAD-T2DM组患者血清miR-27a表达水平降低,血清PPAR-γ水平升高,差异均有统计学意义(P<0.05);与T2DM组、CAD组比较,CAD-T2DM组患者血清miR-27a表达水平进一步降低,血清PPAR-γ水平则进一步升高,差异均有统计学意义(P<0.05)。见表2。
表2 4组血清miR-27a、PPAR-γ水平比较
2.3多因素Logistic回归分析血清miR-27a与健康人群T2DM、CAD发生风险及T2DM患者CAD发生风险的相关性 分别以健康人群是否发生T2DM(赋值1=T2DM,0=对照组)、健康人群是否发生CAD(赋值1=CAD,0=对照组)、T2DM患者是否发生CAD(赋值1=CAD-T2DM,0=T2DM)作为因变量,校正各种混杂因素后,经多元线性回归模型分析,血清miR-27a低表达水平可增加健康人群发生T2DM、CAD的风险或T2DM发生CAD的风险(OR=0.870、0.912、0.738,P<0.05)。见表3。

表3 单因素和多因素Logistic回归分析血清miR-27a与及健康人群T2DM、CAD发生风险及T2DM患者CAD发生风险的相关性
2.4血清miR-27a表达水平对T2DM、CAD、CAD-T2DM的辅助诊断价值 经ROC曲线分析发现,血清miR-27a辅助诊断健康人群发生T2DM、CAD及T2DM发生CAD的AUC分别为0.755(95%CI:0.646~0.864,P<0.05)、0.759(95%CI:0.646~0.872,P<0.05)、0.850(95%CI:0.766~0.934,P<0.05),cut off值分别为0.835、0.870、0.555,灵敏度分别为94.4%、88.9%、84.2%,特异度分别为44.7%、52.8%、70.3%。见图1。
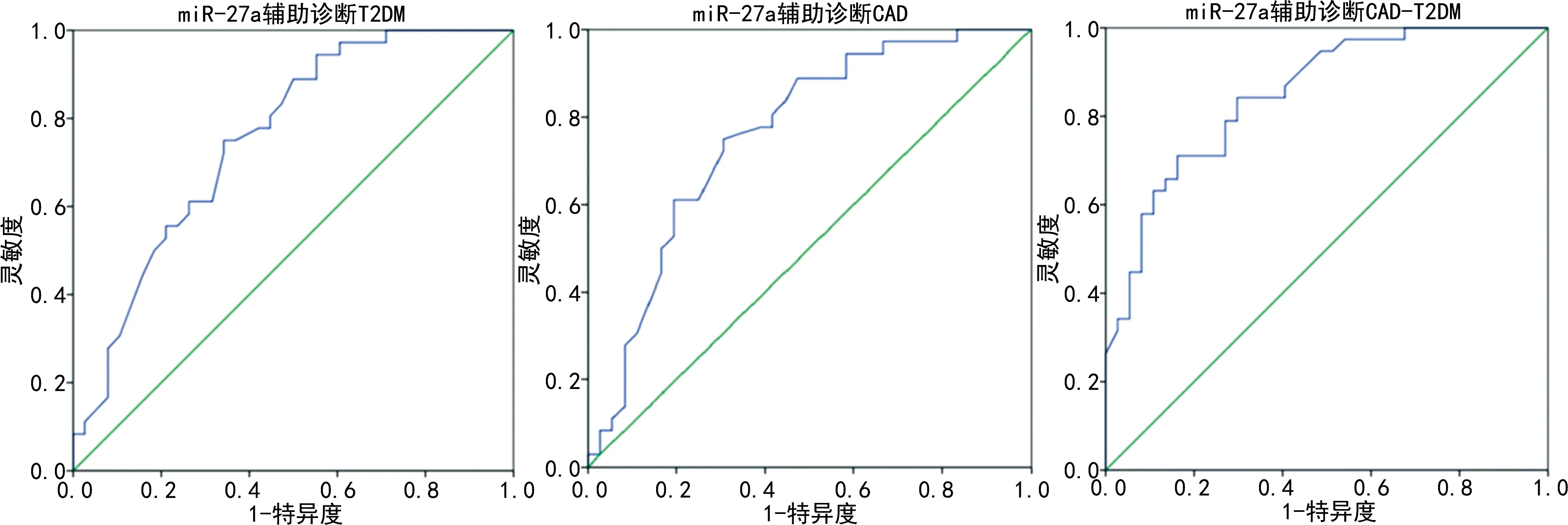
图1 血清miR-27a用于辅助诊断T2DM、CAD、CAD-T2DM的ROC曲线
2.5血清miR-27a和PPAR-γ靶向调控关系 经TargetScan数据库分析,miR-27a存在与PPAR-γ mRNA相结合的互补序列。经双荧光素酶报告基因分析,miR-27a mimics和PPARγ-3′UTR-WT共转染后,可降低荧光素酶活性(P<0.05),但是与PPARγ-3′UTR-MUT共转染后,荧光素酶活性无明显变化(P>0.05)。见图2。
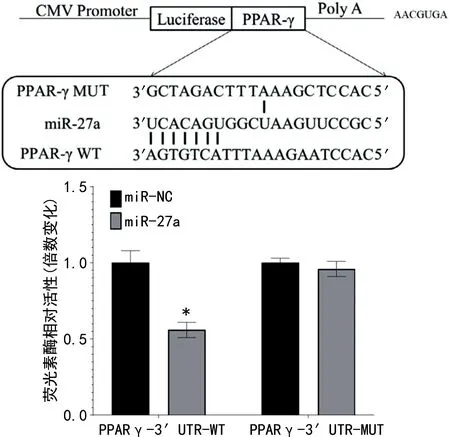
注:与miR-NC比较,*P<0.05。
2.6CAD-T2DM组患者血清miR-27a和PPAR-γ水平的关系 经Pearson分析发现,CAD-T2DM组患者miR-27a表达水平与血液PPAR-γ水平呈负相关(r=-0.808,P<0.05)。见图3。
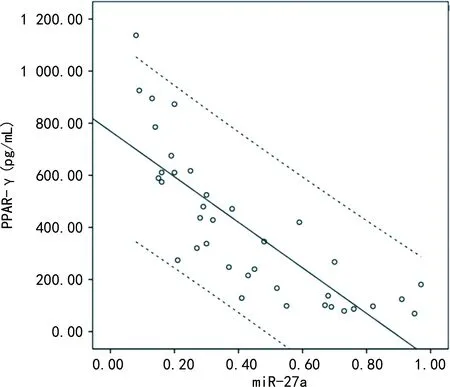
图3 CAD-T2DM组患者血清miR-27a和PPAR-γ水平的关系
3 讨 论
CAD是严重威胁人类健康和生命的心血管疾病,多发于40岁以上人群,受高血压、高血脂和T2DM等多种因素影响[6]。流行病学调查结果显示,我国CAD患者合并 T2DM呈逐年升高趋势[7]。与单纯T2DM或单纯CAD患者比较,CAD-T2DM患者病情更加严重,且会出现弥漫性改变征象,因而具有较高的病死率和致残率。及时采取有效的治疗和控制措施,对CAD-T2DM患者有重要意义。
本研究结果显示,与对照组、T2DM组和CAD组比较,CAD-T2DM组患者血清miR-27a表达水平明显降低,而且经单因素和多因素Logistic回归分析显示,血清miR-27a低表达水平是增加健康人群发生T2DM、CAD及T2DM发生CAD的独立危险因素。在ROC曲线分析中,血清miR-27a可以用来分析健康人群与CAD患者或T2DM患者及T2DM患者与CAD-T2DM患者之间的区别。经Pearson相关分析显示,CAD-T2DM组患者血清miR-27a和PPAR-γ水平呈负相关。生物信息学和荧光素酶报告基因证明,miR-27a可以直接靶向PPAR-γ基因的3′UTR并介导其相关转录。上述研究数据表明,miR-27a与T2DM和CAD的发生均有关,可能是两种疾病的共病机制之一,而且miR-27a与PPAR-γ基因存在靶向调控关系,miR-27a低表达可能是引起PPAR-γ表达上调的重要原因。
CAD合并T2DM的发生是环境与多种基因联合作用进而影响相关通路活性改变的复杂疾病[8]。PPAR-γ基因位于3号染色体,其编码的PPAR-γ是核激素受体家族成员之一,主要在脂肪组织、造血细胞和大肠中表达。PPAR-γ控制着大量基因的表达,这些基因涉及代谢稳态、脂质、葡萄糖和能量代谢、脂肪形成和炎症等[9]。有研究证实,PPARs调节大量代谢通路,与代谢综合征、T2DM、非酒精性脂肪肝和心血管疾病等代谢性疾病的发病机制有关[10]。例如PPAR-γ可通过减少基质金属肽酶9的表达来降低斑块的稳定性,并通过刺激氧化低密度脂蛋白的摄入来促进泡沫细胞形成,这也可能被PPAR-γ依赖或独立的反调节机制所抵消[11]。QIAN等[12]研究发现,PPAR-γ基因外显子中C161T的多态性可能会影响促炎细胞因子的分泌,并影响对CAD的易感性。HASAN等[13]研究证实,埃及人群中PPAR-γ基因rs1801282位点单核苷酸多态性可以增加T2DM发生CAD的风险。PPAR-γ可以将脂质和糖代谢的改变与CAD的发展联系起来,尤其是在CAD合并T2DM中。有研究证实,PPAR-γ在CAD-T2DM患者血清中呈高表达,而通过PPAR-γ激动剂(如噻唑烷二酮类)诱导PPAR-γ活化后,导致PPAR-γ构象发生改变,血清PPAR-γ表达水平下降[14]。目前,很多人工合成的PPAR-γ 激动剂,如曲格列酮、吡格列酮、罗格列酮被证实可以降低T2DM发生CAD的风险,并且能够改善CAD-T2DM的预后,但是其具体调控机制有待进一步研究。
miRNA是一种内源性非编码RNA,可以调控靶基因转录后翻译过程,其中miR-27a被证实与胰岛素抵抗及血脂代谢途径有关。YU等[15]研究证实,miR-27a可能参与了糖尿病的病理机制,如脂质代谢紊乱、氧化应激、细胞外基质沉积、肾纤维化等。本研究结果显示,与对照组、CAD组和T2DM组比较,CAD-T2DM组患者血清miR-27a水平明显下降,这表明与冠状动脉事件的风险呈负相关,该结果与之前的基础研究结论基本一致。PPAR-γ为单亚基,具有N端区(A/B区)、居中高度保守的DNA结合区(C区)和C端的激素结合区(E区)。本研究通过TargetScan在线数据库预测,PPAR-γ mRNA可能含有与miR-27a结合的靶向位点。通过双荧光素酶报告基因分析,miR-27a mimics和PPARγ-3′UTR-WT共转染后,可降低荧光素酶活性,说明miR-27a可以直接靶向PPARγ-3′UTR并介导相关转录。进一步通过Pearson相关分析显示,在CAD-T2DM患者miR-27a和PPAR-γ之间存在明显负相关,说明miR-27a低表达可能是影响PPAR-γ基因转录的重要上游机制之一。另外,ROC曲线分析显示,血清miR-27a用于辅助诊断T2DM、CAD、CAD-T2DM发生的灵敏度较高,说明血清miR-27a不仅可以作为一项潜在的风险预测参数,而且还可以作为1项生物标志物来区分发生CAD的T2DM患者和未发生CAD的T2DM患者。本研究纳入的样本量相对较小,miR-27a用于鉴别的实用性还需要进一步确认。
综上所述,CAD合并T2DM患者表现为血清miR-27a表达水平降低,这可能是导致血清PPAR-γ水平升高的重要原因之一。检测血清miR-27a表达水平对于辅助诊断T2DM并发CAD有一定临床价值,而且miR-27a和PPAR-γ也有望成为未来预防或治疗CAD合并T2DM的新靶点。
