人脐带来源的间充质干细胞运载3型呼肠孤病毒在杀伤K562细胞过程中相关细胞因子表达分析*
2021-08-26宋晓梅刘雨思赵书利赵砚驰舒莉萍
宋晓梅,刘雨思,赵书利,李 晨,赵砚驰,李 化,舒莉萍△
1.贵州医科大学细胞工程生物医药技术国家地方联合工程实验室/贵州省再生医学重点实验室/贵州医科大学基础医学院免疫学教研室,贵州贵阳 550004;2.贵州省贵阳市妇幼保健院检验科,贵州贵阳 550004;3.延安大学基础医学院,陕西延安 716000;4.长江航运总医院肿瘤科,湖北武汉 430014;5.中国医学科学院成体干细胞转化研究重点实验室,贵州贵阳 550004
慢性粒细胞白血病(CML)是一种起源于多能造血干细胞的异常增生性肿瘤,虽然病程发展较慢,但发病率较高,约占新发白血病病例的10%[1]。CML的传统疗法治疗后不良反应多、易复发,分子靶向药物酪氨酸激酶抑制剂的出现虽然使CML的治疗效果与以往比较取得了重要进展[2],但是酪氨酸激酶抑制剂不能清除静止期的白血病干细胞,因此,停药后复发是目前酪氨酸激酶抑制剂治疗CML难以克服的一个瓶颈[3],这些困难仍困扰着众多临床医生及患者。异基因造血干细胞移植虽有望治愈CML,但是由于配型相合的干细胞来源有限、并发症多及费用高昂使这种治疗方案难以普及,为此有必要探索治疗CML的新方法,比如免疫疗法。K562细胞是来源于CML急性病变患者的异常细胞,具有Ph染色体, K562细胞可以作为构建CML的细胞模型。溶瘤病毒是指能够感染肿瘤细胞并致其死亡而对正常组织没有影响的非致病性病毒颗粒,它可以通过在宿主细胞内进行自我复制来增加病毒载量杀死肿瘤细胞,实现肿瘤靶向治疗的目标,是恶性肿瘤治疗领域中的新治疗方式[4-5]。呼肠孤病毒(Reovirus)作为一种天然存在的溶瘤病毒,不仅可以通过选择性杀死肿瘤细胞直接发挥溶瘤作用,还能诱导机体的免疫活性介导优异的抗肿瘤作用[6]。利用天然的肿瘤归巢细胞(如干细胞)作为细胞载体将Reovirus递送到肿瘤,能帮助病毒逃避机体的免疫清除,使溶瘤病毒能够到达肿瘤细胞并进行复制来杀伤肿瘤细胞成为可能[7]。人脐带来源的间充质干细胞(MSCs)有较强的自我更新能力及多向分化潜能,来源较为广泛且不损伤供者的身体,易于转染外源基因,因此,已被众多研究证实是细胞替代治疗的理想来源。“归巢”最早是指淋巴细胞在体内依靠归巢受体倾向于由定居地经淋巴循环及血液循环不断往返于外周免疫器官、外周淋巴组织及全身器官组织,最终再回到外周免疫器官及外周淋巴组织的过程,后来这一概念逐渐引申至循环系统中特定的细胞类群,如干细胞、免疫细胞在多种因素的作用下能定向趋向性迁移至机体组织或器官微环境,维持或重塑其细胞命运的生命过程,类似于人体局部炎性反应后大量白细胞迁移至炎性反应周围。2002年,SAITO等[8]证明了MSCs的归巢能力,有研究表明,利用MSCs的肿瘤归巢能力可将抗癌基因产物直接递送至肿瘤病灶[9]。单独的溶瘤病毒Reovirus3进入机体有可能被体内针对Reovirus3产生的抗体中和,所以本研究选用具有肿瘤归巢能力的MSCs作为运载Reovirus3的载体可使之躲过体内抗体的攻击,使Reovirus3能够到达肿瘤病灶并进行复制来杀伤肿瘤细胞。本研究探讨细胞培养体系中相关细胞因子对MSCs运载Reovirus3杀伤K562细胞的影响,为利用细胞因子治疗或者辅助MSCs运载Reovirus3治疗CML提供一定依据。
1 材料与方法
1.1材料与仪器 K562细胞株(美国ATCC公司);Reovirus3病毒株(贵州医科大学组织工程与干细胞中心);DMEM培养基、RPMI1640培养基(Gibco公司);胎牛血清(FBS , BI公司);磷酸盐缓冲液(PBS,Solarbio公司);ELISA细胞因子检测试剂盒(安徽巧伊生物科技有限公司);CO2培养箱(Thermo公司)。
1.2方法与步骤
1.2.1细胞的分离与培养 参照刘雨思[10]及《细胞培养技术》,通过体外实验从脐带中分离培养MSCs,取第3代处于对数生长期的MSCs进行实验。K562细胞在含有10%FBS的RPMI1640培养基,于37 ℃,5%CO2条件下进行传代培养,取对数生长期的K562细胞进行实验。
1.2.2分组 对照组:K562细胞;MSCs组:K562细胞+MSCs; Reovirus3组(阳性对照组):K562细胞+Reovirus3;实验组:K562细胞+Reovirus3+MSCs。
1.2.3检测方法 分别收集共培养24、48、72 h各组细胞培养上清液,1 000 r/min离心5 min,采用ELISA双抗体夹心法,按照试剂说明书检测肿瘤坏死因子-α(TNF-α)、干扰素-γ(IFN-γ)、转化生长因子-β(TGF-β)、白细胞介素(IL)-2、IL-4、IL-5、IL-6和IL-17水平。培养24、48、72 h后培养体系中的K562细胞由本课题组刘雨思[10]进行K562细胞增殖抑制能力检测。
2 结 果
2.1培养24 h时4组细胞培养上清液细胞因子水平比较 培养24 h时4组细胞培养上清液均未检测出TNF-α、IFN-γ、IL-2、IL-4、IL-5及IL-17。见表1。
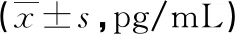
表1 培养24 h时4组细胞培养上清液细胞因子水平比较
2.2培养48 h时4组细胞培养上清液细胞因子水平比较 培养48 h 时MSCs组、Reovirus3组和实验组TNF-α、IFN-γ、IL-2、IL-4水平虽然均高于对照组,但差异均无统计学意义(P>0.05)。培养48 h时4组细胞培养上清液均未检测出IL-5和IL-17。见表2。
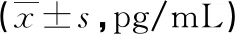
表2 培养48 h时4组细胞培养上清液细胞因子水平比较
2.3培养72 h时4组细胞培养上清液细胞因子水平比较 培养72 h时 MSCs组和实验组TGF-β、IL-6水平均高于对照组,差异均有统计学意义(P<0.05),Reovirus3组比对照组TGF-β、IL-6水平虽有所升高,但差异无统计学意义(P>0.05)。培养72 h时4组细胞培养上清液均未检测出TNF-α、IFN-γ、IL-2、IL-4、IL-5及IL-17。见表3。
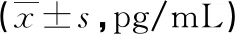
表3 72 h时4组细胞培养上清液细胞因子水平比较
3 讨 论
细胞因子是由免疫细胞和某些非免疫细胞经刺激而合成并分泌的具有多种生物学活性的小分子蛋白质,在免疫应答与调节、细胞分化和发育、炎性反应、组织修复及造血中发挥重要作用。MSCs可分泌多种细胞因子,包括IL-6、IL-7、IL-8、白血病抑制因子、IFN-γ及TNF-α,MSCs具有抗肿瘤免疫调节功能,它的免疫调节功能是通过细胞分泌的可溶性细胞因子,还有细胞与细胞之间受体与配体的相互作用或者两种机制的组合来实现。因此,可以通过检测相应的细胞因子来评价抑瘤体系对白血病细胞溶瘤作用的效果和可行程度。有研究显示,MSCs分泌的细胞因子可促进细胞凋亡,改变K562细胞的细胞周期分布,这些细胞因子可通过BAX和Caspace-3级联途径抑制K562细胞增殖[11]。此外,MSCs分泌的细胞因子IFN可以激活双链RNA依赖性蛋白激酶(PKR)途径,Reovirus3感染K562细胞后,转录过程中的小基因片段编码的σ3蛋白也可以引起PKR的活化,经IFN及σ3蛋白激活的PKR可引起细胞凋亡来抑制K562细胞的增殖[12]。
本课题组刘雨思[10]采用流式细胞仪检测了MSCs与K562细胞表面Reovirus3易感受体重组人连接黏附分子-A(JAM-A)的表达量分别为11%和99%,JAM-A在K562细胞表面高表达。K562细胞增殖抑制能力检测结果显示,对照组和Reovirus3组(阳性对照组)K562细胞随着时间延长细胞存活率始终最高和最低, MSCs组在24 h时发现MSCs有一定促进肿瘤生长的作用,但随着共培养时间的延长这种促瘤作用转为抑瘤作用。实验组与MSCs组相似,在24 h时发现MSCs有一定促进肿瘤生长的作用,随着共培养时间延长至72 h时,实验组K562细胞存活率与Reovirus3组(阳性对照组)接近。在Reovirus3存在的Reovirus3组和实验组K562细胞存活率明显低于对照组,可能是因为Reovirus3感染K562细胞后激活了PKR途径,引起细胞凋亡。而MSCs组和实验组在24 h时发现MSCs有一定促进肿瘤生长的作用,但随着共培养时间的延长这种促瘤作用转为抑瘤作用,可能是因为随着共培养时间的延长,培养体系中产生的细胞因子对抗肿瘤的作用得以发挥,由促瘤作用转为抑瘤作用。通过检测细胞培养上清液细胞因子,48 h时在MSCs存在的情况下,细胞培养上清液TNF-α、IFN-γ水平比并没有MSCs存在的Reovirus3组和对照组高,培养体系中的IFN-γ可能激活了PKR途径引起细胞凋亡,TNF-α可能是通过启动Caspase信号通路使肿瘤细胞发生凋亡。4组IL-2、IL-4水平较为接近,差异无统计学意义(P>0.05),可能是因为培养体系中IL-2、IL-4主要由K562细胞自分泌产生参与免疫应答。24、72 h时细胞培养上清液均未检测出TNF-α、IFN-γ、IL-2及IL-4,可能是因为这2个时间点的这4种细胞因子水平较低,采用ELISA双抗体夹心法没有检测出来。IL-4能以自分泌的方式促进Th2细胞分化,参与变态反应,在肿瘤免疫中起抑制肿瘤免疫应答的作用。IL-2可由CD4+和CD8+T细胞产生,另外转化的B细胞、白血病细胞亦可产生,是对免疫系统具有重要作用的细胞因子之一,可以使细胞毒性T细胞、自然杀伤细胞(NK细胞)增殖,并使它们的杀伤活性增强,还可促进淋巴细胞分泌抗体和IFN,具有抗病毒、抗肿瘤和增强机体免疫功能等作用,已经被批准用于治疗转移性肾细胞癌和转移性黑色素瘤,改进的IL-2制剂可单独使用,与其他的抗癌免疫疗法结合有望治疗转移性癌症[13]。培养24、48、72 h时MSCs组和实验组TGF-β、IL-6水平均高于对照组,差异均有统计学意义(P<0.05),而Reovirus3组TGF-β、IL-6水平虽有所升高,但差异无统计学意义(P>0.05)。4组TGF-β水平随着时间的推移不断降低,可能是因为TGF-β对肿瘤具有双重作用,随着时间的推移被逐渐消耗及不断降解而减少,还可能与K562细胞死亡率逐渐增加及培养体系中的营养逐渐消耗有关。48 h时IL-6水平最高,之后降低可能与IL-6随着时间的推移不断降解,以及培养体系中营养逐渐消耗及K562细胞死亡率逐渐增加有关。有研究表明,肿瘤(如卵巢癌、乳腺癌等恶性肿瘤)处于旺盛时期均出现了IL-6的高表达[14-15],作为促炎因子的IL-6可通过自分泌和旁分泌方式促进肿瘤发生,在肿瘤血管生成、肿瘤微环境的免疫调节及疾病进展中起重要作用。此外,在肿瘤微环境中,TGF-β、IL-6和IL-10可以直接抑制NK细胞活性,还可以通过影响免疫抑制细胞和拮抗刺激细胞因子的作用间接抑制NK细胞活性,从而抑制NK细胞的抗肿瘤反应,使肿瘤细胞有机会逃避免疫系统的攻击[16]。培养48 h时细胞培养上清液未检测出IL-5、IL-17,可能是因为IL-5主要由Th2细胞和活化的肥大细胞产生,IL-17主要由Th17细胞产生,因此,细胞培养体系中未检测到IL-5、IL-17存在,也有可能是这两种细胞因子水平过低,采用ELISA双抗体夹心法没有检测出来。本研究采用ELISA双抗体夹心法检测细胞因子,检测的是可溶性细胞因子的免疫反应性即细胞因子的蛋白水平,因此,检测结果与细胞因子的生物活性不一定呈正比。并且测定结果与所用的抗体来源及亲和力有关,样本中存在的各种细胞因子结合蛋白也可能对细胞因子免疫测定产生干扰。
MSCs运载Reovirus3在体外实验的细胞培养体系中可以有效抑制K562细胞增殖,除了溶瘤病毒Reovirus3的溶瘤作用外,可能还与培养体系中细胞因子促进细胞凋亡从而抑制K562细胞的增殖有关。本课题组荷瘤小鼠体内细胞因子的检测结果提示细胞因子在体内对抑制K562细胞的增殖有一定作用[17]。细胞因子对肿瘤的作用十分复杂,随着人们对各种细胞因子的来源、生物学功能、分子结构、相应受体和受体介导的信号转导等多方面研究取得的进展,采用细胞因子治疗或者辅助治疗CML受到临床关注。
