油茶果壳原花青素的纯化及对α-淀粉酶活性抑制作用
2021-08-25刘承毅吴雪辉
刘承毅,吴雪辉,
1. 华南农业大学食品学院(广州 510642);2. 广东省油茶工程技术研究中心(广州 510642)
油茶(Camellia oleifera),是我国重要的木本油料作物。目前,我国油茶种植面积已达到440万 hm2,并且有逐年增长的趋势[1]。油茶果壳是油茶果去仁后留下的外种皮,在制油过程中,1 t的油茶果实能产生大约0.54 t的果壳[2],然而在实际中,果壳常常被当作废料处理或者冬天取暖用的燃料,利用率极低[3]。
原花青素(Proanthocyanidins),由一类黃烷醇单体聚合形成的多酚类物质[4],是一种天然的强抗氧化剂[5],同时还具有降血糖、抗肿瘤、抗衰老等作用[6-8],应用前景广阔。近年来,研究发现油茶果壳中含有丰富的原花青素,含量在2%~5%左右[9-10]。目前对果壳中原花青素的研究主要集中在提取上,但获得的粗提物中含有较多杂质,需要进一步纯化。大孔树脂法因其具有易操作、选择性强等优点,常被应用于原花青素吸附纯化研究[11-12]。
通过抑制体内α-淀粉酶的活性,可以阻断淀粉等碳水化合物在体内转变糊精和寡糖的过程,减少碳水化合物的摄入,避免餐后血糖的快速升高,对控制血糖及治疗糖尿病有着重要意义[13]。研究表明,从植物中提取的原花青素可以通过抑制碳水化合物水解酶如α-淀粉酶的活性来预防高血糖[14]。
目前,关于油茶果壳中原花青素的纯化及其对α-淀粉酶活性抑制作用的研究均未见报道。因此,利用大孔树脂对油茶果壳中原花青素进行纯化,同时考察纯化后原花青素对α-淀粉酶活性的抑制作用,以期为油茶果壳的高值化利用和原花青素的研究开发提供参考。
1 材料与方法
1.1 材料与仪器
油茶果(采自东莞樟木头林场);大孔树脂S-8、HPD-600、AB-8、D-101、XDA-6、LSA-12、LX-213(西安蓝晓科技新材料股份有限公司);原花青素标准品(纯度≥95%,上海如吉生物科技发展有限公司);阿卡波糖(上海伊卡生物技术有限公司);猪胰α-淀粉酶(10 U/mg,美国Sigma-Aldrich公司);其他试剂均为国产分析纯。
UV-5200型紫外可见分光光度计(上海元析仪器有限公司);JJ1000型电子天平(常熟市双杰测试仪器厂);HWS24型电热恒温水浴锅(广州航信科学仪器有限公司);LRH-150B恒温培养箱(广东泰宏君科学仪器股份有限公司);HY-5回旋式振荡器(常州澳华仪器有限公司)。
1.2 试验方法
1.2.1 油茶果壳原花青素的提取
油茶果壳于45 ℃烘干,粉碎后过0.425 mm筛,备用。准确称取10.00 g样品,加入500 mL 43%(V/V,下同)乙醇溶液,于70 ℃提取13 min,抽滤,真空浓缩,得到原花青素粗提液。
1.2.2 原花青素标准曲线的制作及纯度的测定
原花青素质量浓度的测定参考孙芸等[15]的方法,以原花青素质量浓度为横坐标,吸光度为纵坐标,得到标准曲线y=2.63x+0.0394,R2=0.9991。

式中:C为测得的原花青素质量浓度,mg/mL;V为样液体积,mL;n为样品稀释倍数;m为原花青素纯化物干基质量,mg。
1.2.3 树脂的预处理
树脂于95%乙醇浸泡24 h,用蒸馏水洗至无醇味。依次用4倍体积的5% HCl溶液和4倍体积的5% NaOH溶液各浸泡4 h,用蒸馏水洗至中性,滤干,备用。
1.2.4 静态吸附和解吸实验
分别称取1.00 g不同型号的大孔树脂(S-8、HPD-600、LSA-12、XDA-6、AB-8、LX-213、D-101)置于锥形瓶中,加入40 mL质量浓度为1.24 mg/mL的原花青素粗提液,置于恒温摇床(25 ℃,120 r/min)中振荡24 h,测定吸附饱和后溶液中原花青素质量浓度。于上述饱和树脂加入40 mL 95%乙醇,振荡解吸24 h(25 ℃,120 r/min),测定解吸液中原花青素质量浓度。按式(2)~(4)计算吸附率、解吸率和回收率。
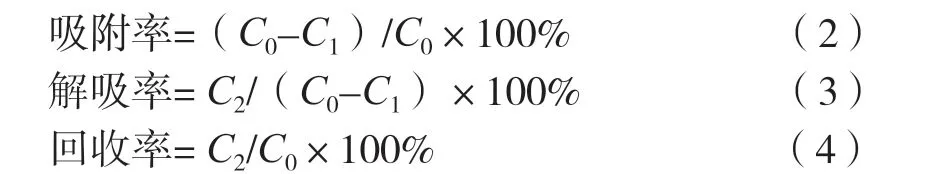
式中:C0、C1和C2分别为提取液原花青素质量浓度、吸附平衡原花青素质量浓度和解吸平衡原花青素质量浓度,mg/mL。
1.2.5 动态吸附与解吸试验
称取7.00 g树脂湿法装柱,固定上样质量浓度0.95 mg/mL,分别以0.25,0.50,0.75,1.00和1.25 mL/min的流速加入150 mL待上样液进行吸附,收集流出液并测定原花青素质量浓度,绘制不同流速下树脂的动态吸附曲线,计算吸附率和泄漏时间。在最佳上样流速条件下,分别考察乙醇洗脱体积分数(10%,30%,50%,70%和90%)、上样质量浓度(0.50,1.00,1.50,2.00和2.50 mg/mL)和洗脱流速(0.50,1.00,1.50,2.00和2.50 mL/min)对原花青素解吸效果的影响,收集流出液并测定原花青素质量浓度,绘制不同条件下树脂动态解吸曲线并计算回收率。真空干燥洗脱液,得原花青素纯化物,测定纯化物纯度。
1.2.6 油茶果壳原花青素对α-淀粉酶活性的抑制作用
1.2.6.1 原花青素对α-淀粉酶活性的抑制曲线
参考钟英英等[16]的方法,以阿卡波糖为阳性对照,测定不同质量浓度抑制剂对α-淀粉酶活性的抑制率。基于抑制剂质量浓度和抑制率回归方程计算IC50值(半抑制质量浓度)。
1.2.6.2 原花青素对α-淀粉酶抑制类型的研究
配制0.40,0.80,1.20,1.60和2.00 mg/mLα-淀粉酶溶液,抑制组原花青素质量浓度为0.30 mg/mL,非抑制剂组用缓冲液代替原花青素溶液,按照1.2.6.1的方法测定反应后溶液吸光度,以酶质量浓度对反应速率作图,判断原花青素对α-淀粉酶的抑制类型。
配制0.20%,0.60%,1.00%,1.40%和1.80%淀粉溶液,抑制组原花青素质量浓度为0.30 mg/mL,非抑制剂组用缓冲液代替原花青素溶液,按照1.2.6.1方法测定反应后溶液吸光度,作Lineweaver-Burk双倒数图,确定原花青素对α-淀粉酶可逆抑制类型。
1.3 数据处理
采用Excel 2019进行数据分析,Origin 2018软件进行作图及方程拟合。
2 结果与分析
2.1 静态吸附和解吸实验
图1为7种型号大孔树脂静态吸附和解吸试验结果。吸附率较高的树脂型号有S-8、XDA-6、AB-8,其中:S-8树脂吸附率最高,但解吸率和回收率很低;XDA-6树脂吸附率其次,且回收率最高;AB-8解吸率较高,但吸附率和回收率较差。综合考虑,选择XDA-6型号树脂作为纯化树脂。
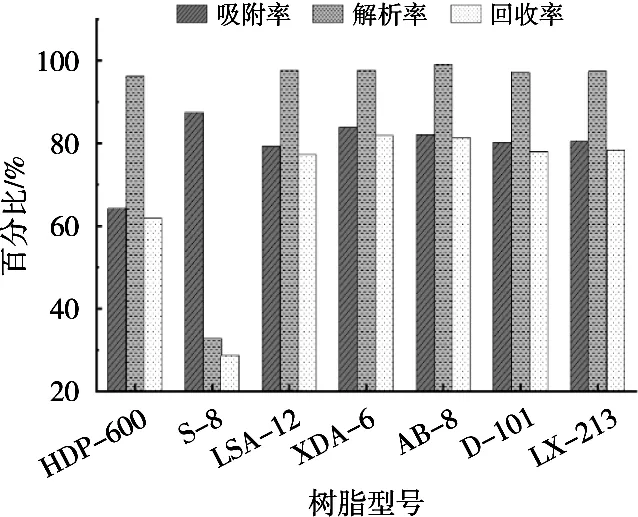
图1 不同型号树脂对原花青素静态吸附与解吸结果
2.2 动态吸附与解吸试验
2.2.1 上样流速对树脂吸附原花青素的影响
图2为上样流速对树脂吸附原花青素的影响,泄露时间和回收率均随着上样流速的增大而减小。当流出液质量浓度达到上样液质量浓度的10%时,该质量浓度称为树脂吸附泄露点[17]。上样流速过快,会使目标产物与树脂接触不充分,容易造成树脂过载而泄露[18];上样流速过慢,会造成上样时间过长。相比于0.25 mL/min,以0.5 mL/min流速上样时,泄露时间从520 min减小到180 min,而回收率仅减少4.11%,因此选择上样流速0.5 mL/min。
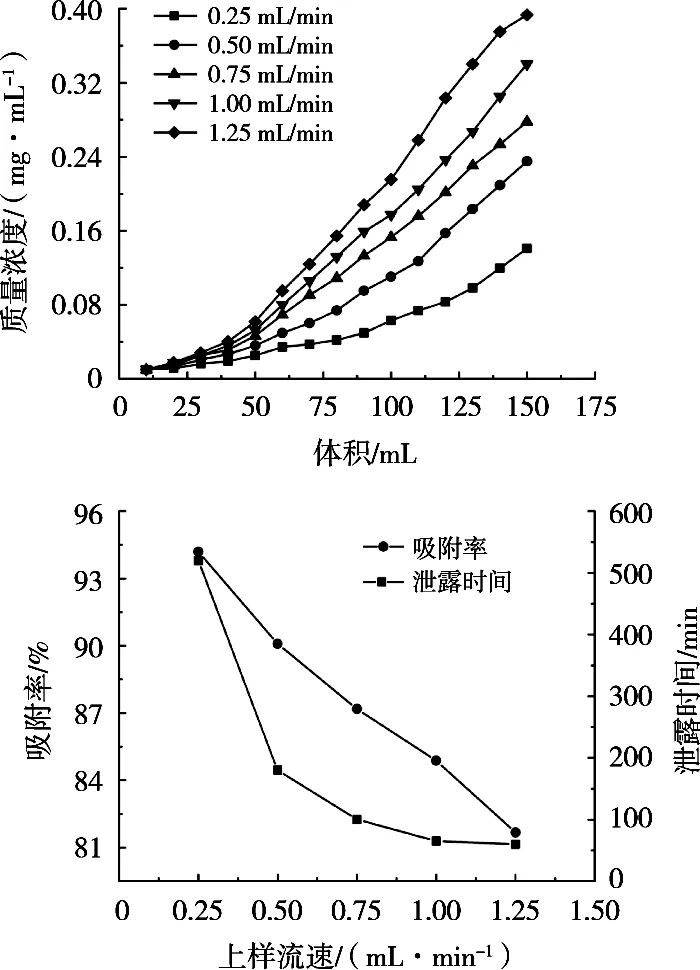
图2 上样流速对树脂吸附原花青素的影响
2.2.2 洗脱体积分数对树脂解吸原花青素的影响
图3为洗脱体积分数对树脂解吸原花青素的影响。10%乙醇洗脱时,原花青素的回收率和纯度均较低,表明10%乙醇对原花青素的选择性不强。原因是10%乙醇极性较大,而原花青素极性较低[19],10%乙醇无法将原花青素从树脂中洗脱出来,洗脱物中多是极性较大的杂质。30%乙醇洗脱物,纯度较高,但会出现拖尾现象,50%~90%乙醇洗脱峰型较窄,成分集中,且回收率和纯度均较高,表明乙醇体积分数超过50%后,均能较好地洗脱出树脂中原花青素。综合成本考虑,选择50%乙醇作为洗脱剂。
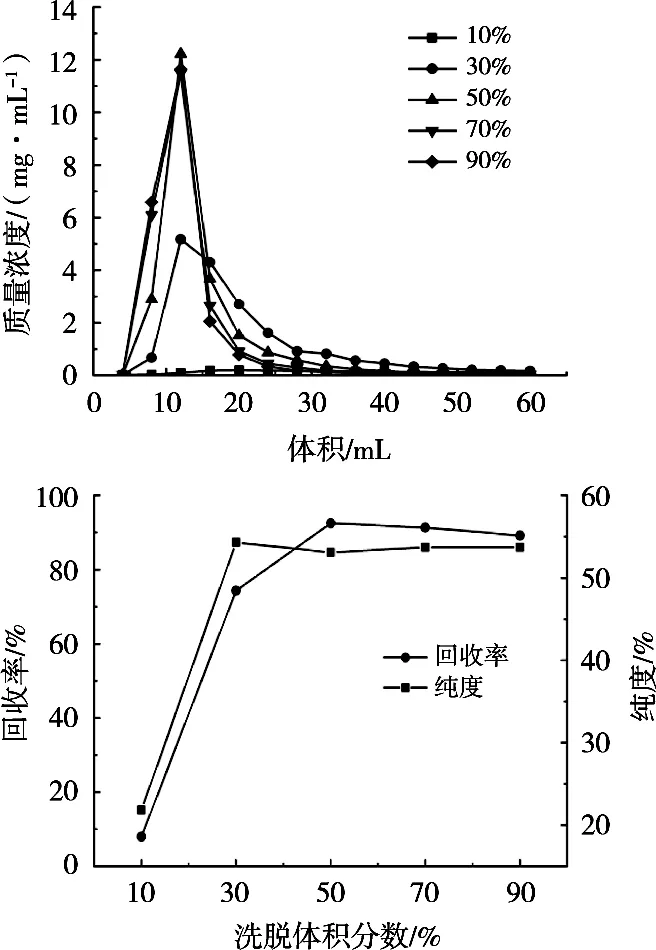
图3 洗脱体积分数对树脂解吸原花青素的影响
2.2.3 上样质量浓度对树脂吸附原花青素的影响
图4为上样质量浓度对树脂吸附原花青素的影响。在不同上样质量浓度下,原花青素洗脱曲线变化相似,且随上样质量浓度的增大,峰尖浓度依次增大。上样质量浓度在0.5~1.5 mg/mL范围内时,回收率缓慢下降,超过1.5 mg/mL后急速下降,原因是原花青素浓度增大,树脂表面基团逐渐饱和,传质速度变慢[20],上样质量浓度超过1.5 mg/mL后,部分原花青素未被吸附就流出,回收率快速降低。原花青素纯度先上升后降低,在上样质量浓度为1.5 mg/mL时达到最大,与郑洪亮[21]研究中红皮云杉球果原花青素纯度随上样质量浓度的变化趋势相同。最终选择上样质量浓度1.5 mg/mL。
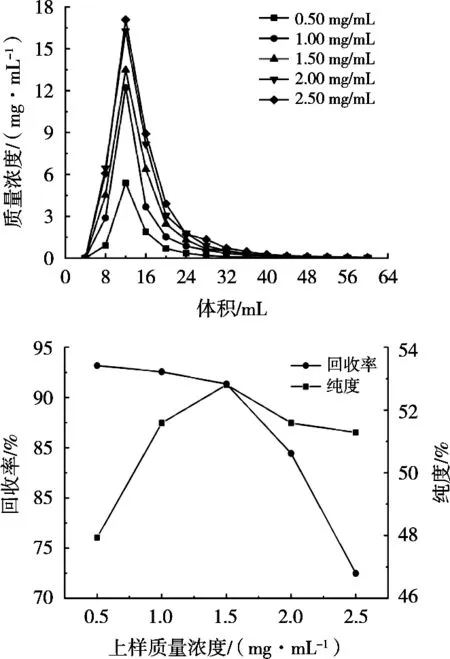
图4 上样质量浓度对树脂吸附原花青素的影响
2.2.4 洗脱流速对树脂解吸原花青素的影响
图5为洗脱流速对树脂解吸原花青素的影响。随着洗脱流速的增大,峰尖浓度减小;纯度随洗脱流速的增大,持续减小,在流速超过1.00 mL/min后快速下降;回收率先增大后减小,并在1.5 mL/min时达到最大值。流速从1.00 mL/min到1.50 mL/min,纯度相对下降较多,而回收率增加不多。综合考虑,最佳洗脱流速选择1.0 mL/min,在此条件下,原花青素纯度达到53.41%,相比于粗提物纯度14.82%,纯化物纯度提高了3.6倍。
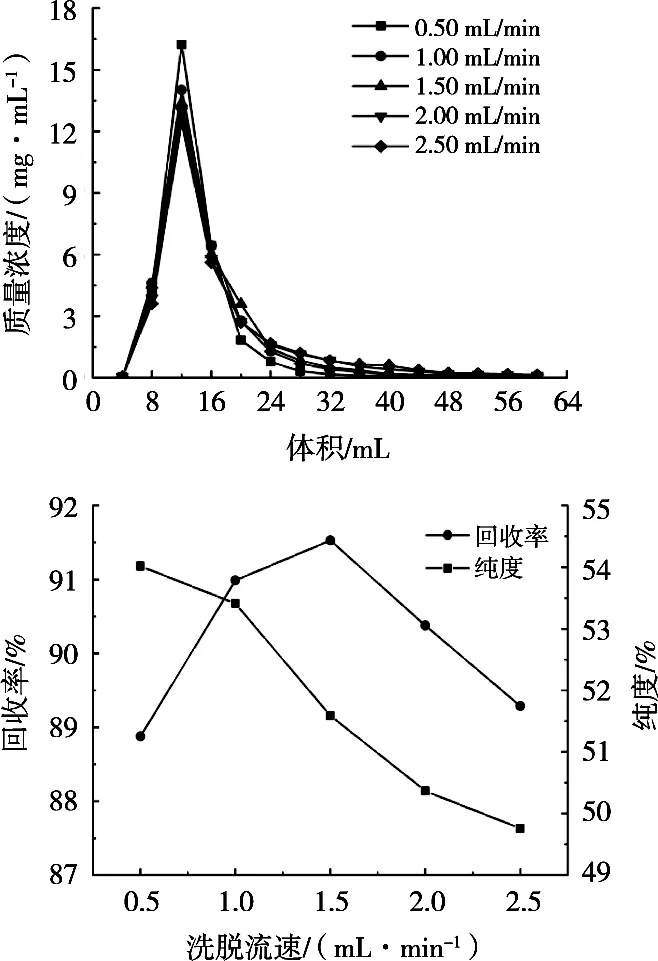
图5 洗脱流速对树脂解吸原花青素的影响
2.3 油茶果壳原花青素抑制α-淀粉酶活性试验
2.3.1 原花青素对α-淀粉酶活性的抑制曲线
图6为油茶果壳原花青素对α-淀粉酶活性的抑制曲线。原花青素质量浓度为0.08~0.40 mg/mL时,抑制率迅速上升;0.40~1.00 mg/mL范围内,抑制率上升速度变缓;质量浓度超过1.00 mg/mL后,抑制率趋于稳定,并在2.00 mg/mL达到最大值95.36%,高于对照物阿卡波糖(90.93%)。通过对图中抑制剂浓度和抑制率的关系进行拟合,计算得到原花青素IC50值为0.24 mg/mL,低于对照物阿卡波糖IC50值(0.27 mg/mL)。图6显示,油茶果壳原花青素对α-淀粉酶活性的抑制效果与质量浓度呈现正量效关系。最大抑制率和IC50值均表明油茶果壳原花青素比阿卡波糖有更好的抑制效果。
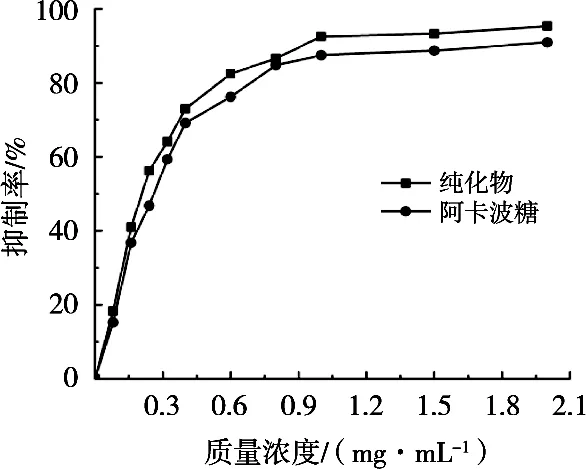
图6 原花青素对α-淀粉酶活性的抑制曲线
2.3.2 原花青素对α-淀粉酶抑制类型的研究
图7为原花青素对α-淀粉酶活性的抑制动力学曲线。在酶质量浓度与反应速率相互关系中可以发现,抑制剂组的直线斜率低于非抑制组,并且抑制组和非抑制组直线均经过原点。根据酶反应动力学曲线特征[22],油茶果壳原花青素对α-淀粉酶活性的抑制作用为可逆性抑制。

图7 原花青素对α-淀粉酶的抑制动力学曲线
图8为原花青素对α-淀粉酶抑制作用的双倒数图。结果发现,抑制剂组和非抑制剂组两条直线相较于Y轴,在有抑制剂存在时,Km值增大,Vmax值不变,表明原花青素对α-淀粉酶的可逆抑制类型属于竞争性抑制。此时,酶抑制剂和底物在结构上有相似之处,酶抑制剂与酶的结合阻断了底物与酶的结合,降低了酶和底物的亲和能力,酶反应的速率减慢[23],与刘睿等[22]研究的高粱原花青素对α-淀粉酶的抑制类型一致。
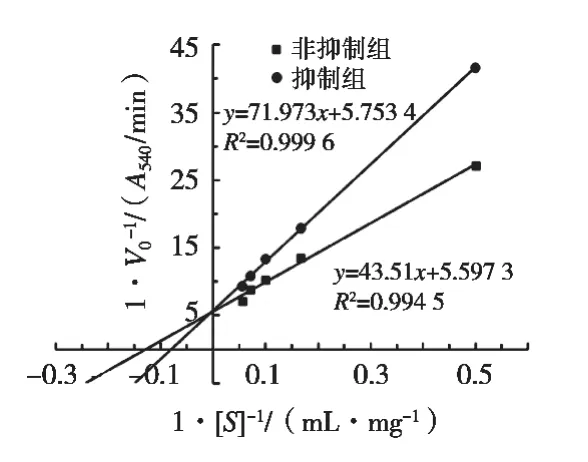
图8 原花青素对α-淀粉酶抑制作用的双倒数图(Lineweaver-Burk)
3 结论
探究了油茶果壳中原花青素的纯化工艺条件,并考察纯化后的原花青素对α-淀粉酶活性的抑制作用。采用XDA-6大孔树脂树脂,在上样流速0.50 mL/min、洗脱乙醇体积分数50%、上样质量浓度1.50 mg/mL、洗脱流速1.00 mL/min条件下进行纯化,原花青素纯度达到53.41%,纯度相比于粗提物(14.82%)提高了3.6倍。油茶果壳原花青素对α-淀粉酶活性的抑制率可达到95.36%,IC50值为0.24 mg/mL,原花青素通过可逆的竞争性作用实现对α-淀粉酶活性的抑制。研究纯化的原花青素能够有效抑制α-淀粉酶的活性,抑制效果超过阿卡波糖,有望作为膳食补充剂应用于血糖控制及糖尿病的防治。
