利妥昔单抗注射液联合CEOP方案治疗非霍奇金淋巴瘤(NHL)复发的临床疗效及其安全性
2021-08-25谢凤玲
谢凤玲
单县中心医院血液内科,山东单县 274300
恶性淋巴瘤起源于淋巴网状系统恶性肿瘤,多发生于淋巴结、结外部位淋巴组织,为我国常见恶性肿瘤疾病;近年发病率呈逐步提升趋势,发病年龄一般40岁左右,病死年龄为45岁,严重危害人类身体健康。非霍奇金淋巴瘤即为常见恶性淋巴肿瘤疾病,肿瘤对于放化疗较为敏感,但易于出现耐药性,再次治疗时缓解率较低。CEOP方案为常见根治化疗方式,虽然可控制疾病发展,但患者长期控制有效率仅为50%。利妥昔单抗注射液为CD20特异性嵌合单克隆抗体,其中约95%B细胞淋巴瘤可表达CD20,也可和B细胞抗原结合,进而产生免疫反应,有效清除B细胞。有学者认为,联合利妥昔单抗注射液、CEOP方案治疗时可有效提升治疗总有效率[1-2]。现方便选取该院2017年1月—2020年1月收治的80例非霍奇金淋巴瘤(NHL)复发患者为研究对象,探究利妥昔单抗注射液联合CEOP方案不同治疗方式效果。现报道如下。
1 资料与方法
1.1 一般资料
方便选取该院收治的80例非霍奇金淋巴瘤(NHL)复发患者,对照组40例,男22例,女18例;年龄23~46岁,平均(35.19±1.87)岁;病灶直径<10 cm者25例,≥10 cm者15例。观察组40例,男23例,女17例;年龄22~48岁,平均(35.25±1.62)岁;病灶直径<10 cm者26例,≥10 cm者14例。两组患者基础资料对比差异无统计学意义(P>0.05),具有可比性。该次研究通过医学伦理委员会批准。
纳入标准:①患者通过病理学分析确诊;②患者治疗前肝肾功能正常;③患者外周血白细胞≥3.0×109L,X血小板≥80×109L;④患者签署知情同意书。排除标准:①近期接受其他药物治疗患者;②骨髓穿刺检查未见淋巴瘤浸润患者;③临床病例数据不全患者。
1.2 方法
对照组为CEOP方案治疗。其中环磷酰胺(国药准字H32020857)第一天750 mg/m2;表阿霉素(批准文号:X19990296)第一天25 mg/m2;长春新碱 (国药准字H20065857)1.4 mg/(m2/d); 强 的 松 ( 国 药 准 字H33020824)60 mg/(m2/d)。第1~5天,每21天重复。治疗时间1个月。
观察组为对照组基础上采用利妥昔单抗注射液(国药准字J20120020)375 mg/m2静脉滴注。稀释方式为药物于0.9%生理盐水溶液稀释至1 mg/mL。首次输注速度为50 mg/h,当无不良反应时可每隔30 min提升50 mg/h,最大剂量为300 mg/h,同时也许进行心电监护。治疗时间1个月。
1.3 观察指标
①患者治疗总有效率。依据张之南《血液病诊断及疗效标准》内评价标准[3]。完全缓解:患者肿瘤完全消失时间超过1个月;部分缓解:病灶最大直径和最大垂直直径乘积降低50%之上,其他病灶也并未增大,持续超过1个月;稳定:患者病灶直径减少低于50%持续一个月;进展:患者病灶两径乘积增大超过25%,或者出现新型病灶。总有效率=(完全缓解+部分缓解+稳定)例数/总例数×100.00%。②对比患者治疗后肿瘤标志物变化。其中主要分析患者的TK-1(T淋巴细胞)、VEGF(血管内皮生长因子)。③患者治疗前后免疫功能对比。其中主要对比IgA(免疫球蛋白A)、补体成分:C3、C4变化。④患者不良反应率。发热、皮疹、低血压、恶心、呕吐。不良反应发生率=不良反应例数/总例数×100.00%。⑤对比患者生存期,治疗后1年内复发概率。
1.4 统计方法
采用SPSS 23.0统计学软件予以数据处理,计量资料用(±s)表示,组间差异比较采用t检验;计数资料以频数和百分比(%)表示,组间差异比较采用χ2检验,P<0.05为差异有统计学意义。
2 结果
2.1 两组患者治疗总有效率对比
观察组患者治疗后总有效率高于对照组,差异有统计学意义(P<0.05)。 见表1。
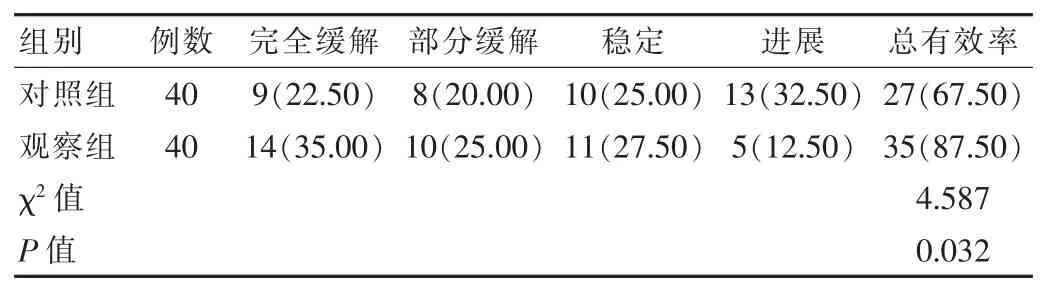
表1 两组患者治疗总有效率对比[n(%)]
2.2 两组患者肿瘤标志物变化对比
治疗前两组患者VEGF以及TK-1肿瘤标志物差异无统计学意义(P>0.05);治疗后观察组患者肿瘤标志物水平低于对照组,差异有统计学意义(P<0.05)。见表2。
表2 两组患者肿瘤标志物变化对比[(±s),pg/mL]
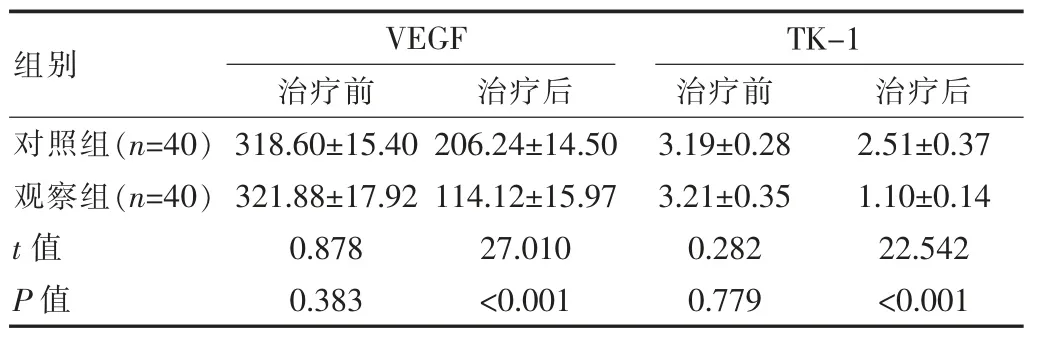
表2 两组患者肿瘤标志物变化对比[(±s),pg/mL]
组别VEGF治疗前 治疗后TK-1治疗前 治疗后对照组(n=40)观察组(n=40)t值P值318.60±15.40 321.88±17.92 0.878 0.383 206.24±14.50 114.12±15.97 27.010<0.001 3.19±0.28 3.21±0.35 0.282 0.779 2.51±0.37 1.10±0.14 22.542<0.001
2.3 两组患者免疫功能指标对比
治疗前两组患者IgA免疫功能指标以及C3、C4差异无统计学意义(P>0.05);治疗后两组患者IgA差异无统计学意义(P>0.05);治疗后观察组患者C3、C4指标低于对照组,差异有统计学意义(P<0.05)。见表3。
表3 两组患者免疫功能指标对比[(±s),g/L]
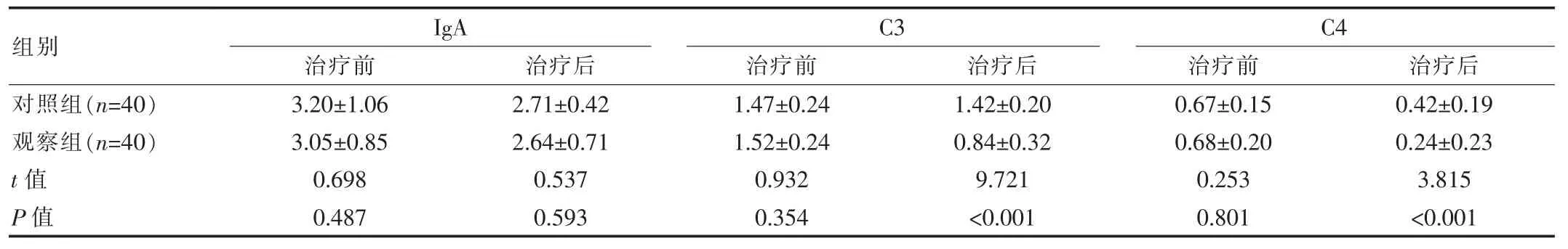
表3 两组患者免疫功能指标对比[(±s),g/L]
组别对照组(n=40)观察组(n=40)t值P值IgA治疗前 治疗后C3治疗前 治疗后3.20±1.06 3.05±0.85 0.698 0.487 2.71±0.42 2.64±0.71 0.537 0.593 1.47±0.24 1.52±0.24 0.932 0.354 1.42±0.20 0.84±0.32 9.721<0.001 C4治疗前 治疗后0.67±0.15 0.68±0.20 0.253 0.801 0.42±0.19 0.24±0.23 3.815<0.001
2.4 两组患者不良反应发生率率对比
观察组患者不良反应发生率和对照组对比差异无统计学意义(P>0.05)。见表4。

表4 两组患者不良反应率对比
2.5 两组患者生存期和复发概率对比
对照组:生存期(14.50±1.06)个月、1年复发率8例(20.00%);观察组:生存期(16.24±1.13)个月、1年复发率2例(5.00%)。观察组患者生存期更长,且疾病复发率更低,差异有统计学意义(t=4.114,χ2=7.103,P<0.05)。
3 讨论
非霍奇金淋巴瘤为全世界范围内常见恶性肿瘤疾病,近年发病率有持续提升趋势,传统治疗方式主要为CEOP方案,此种治疗方式虽然可有效破坏肿瘤细胞,但也会损伤患者身体以及健康组织,且有疾病复发率高的问题[3-4]。为有效解决单纯CEOP方案治疗的问题,该次提出利妥昔单抗注射液治疗,此种治疗方式不仅可提升治疗效果,也可降低患者抗药敏性。
CEOP治疗时主要包括:①环磷酰胺,此种药物属于免疫抑制剂可通过多个途径有效控制细胞基因合成,抑制细胞增殖。且药物有较高免疫抑制作用,因此可改善患者肾脏功能[5]。②长春新碱则为常用抗肿瘤药物,主要用于急性淋巴细胞白血病治疗,也可控制小细胞肺癌,有效控制淋巴肉瘤发展,提升疾病控制效果。③表阿霉素为常见抗生素类肿瘤抗生素,也可有效抑制基因合成,抗肿瘤谱相对较广,相比于阿霉素心脏毒性较小可有效控制肿瘤细胞生长,因此也被广泛应用于肿瘤控制[6-7]。④强的松则为肾上腺皮质激素类药物,主要用于过敏性和免疫性炎症疾病,也可有效控制恶性淋巴瘤和肾上腺皮质类激素病症,可有效抑制组胺和毒性物质形成和释放。以上药物联合使用即为CEOP方案,可有效控制肿瘤生长,但也有复发率高的问题[8-9]。为有效降低复发率提升长期治疗效果,该次研究便联合利妥昔单抗注射液,此为基因工程内人鼠嵌合单克隆抗体,主要包含IgG以及k恒定区、鼠源可变区,为美国FDA首个批准的肿瘤治疗单抗药物。此种药物可定向作用于B细胞表面CD20抗原,其中B细胞淋巴瘤占各种淋巴瘤90%左右,其中CD20抗原主要表达于95%之上B淋巴以及正常B淋巴细胞,且不表达造血干细胞和原始B细胞[10-11]。即便杀伤各种表达CD20淋巴瘤细胞、正常细胞,B细胞依然可不受到影响,同时也可继续成熟同时建立B细胞群,剩余血浆细胞则可继续维持正常免疫防护工作。CD20主要于B细胞表面表达稳定,和CD20抗体进行结合之后并不会轻易脱落、内化,也可保证抗体杀伤B细胞的高效性。此种药物主要作用机制为:抗体较为依赖细胞毒作用;也有补体介导细胞毒性作用;当抗体和CD20分子相互结合之后可引发更为直接的效应,其中主要为抑制细胞生长,改变细胞凋亡;此种药物也可通过致敏肿瘤细胞协助,有效提升传统细胞毒性疗效[12-13]。对比该次治疗效果,观察组患者治疗后总有效率87.50%高于对照组67.50%(P<0.05)。因此可知当联合利妥昔单抗注射液进行治疗时,细胞毒效应可直接作用于细胞Fc受体上并和肿瘤细胞抗体Fc作用有效杀伤细胞;且抗体和肿瘤细胞结合之后Fc段补体结合位点可激活补体系统,进而形成攻膜复合体,引发细胞裂解死亡;同时也可通过和致敏肿瘤细胞协作,有效提升疾病治疗效果。对比谈琴[14]研究结果,观察组患者接受利妥昔单抗注射液联合CEOP方案治疗后总有效率可达75%之上,和该次研究结果87.50%相比并无较大差异,因此可知该治疗方式效果显著。
免疫功能变化为患者肿瘤发展的重要原因,免疫功能指标可有效判定患者疾病治疗效果。该次研究发现观察组患者接受治疗后C3以及C4等指标均优于对照组(P<0.05)。其中补体作为机体免疫重要组成部分,可有效协同患者K细胞以及抗体杀伤免疫系统重组重要成分,也可协同K细胞以及抗体杀伤肿瘤细胞[15]。当患者接受利妥昔单抗注射液联合CEOP方案联合治疗时可有效提升免疫功能进而提升补体水平。
肿瘤标志物作为判定治疗效果的重要指标,该次研究提出观察组患者接受联合治疗后VEGF、TK-1水平低于对照组(P<0.05)。此种状况和联合治疗后患者免疫功能得到提升且总有效率更高有关,因此患者肿瘤标志物得到有效控制。
患者接受化疗后常会出现各种不良反应,此为治疗后常见问题。采用利妥昔单抗注射治疗时主要不良反应为寒战、恶心以及皮疹等问题,不良反应可由轻至重,逐步恶化,也有部分患者会出现支气管痉挛,血压降低等问题,此时需立即停止用药,为患者进行抗过敏或吸氧治疗[16-18]。但在该次研究过程中,观察组患者不良反应率37.50%和对照组30.00%相比差异无统计学意义(P>0.05)。因此可知联合治疗时并不会提升不良反应。主要原因为利妥昔单抗注射液为单克隆抗体生物制剂,自身含有较多异体蛋白成分,治疗过程中尤其为首次治疗时易于出现心律失常和寒战等不良反应。但此种不良反应在治疗过程中均通过放缓滴注速度、抗过敏药物均可得到有效缓解,再次使用时各种不良反应即可消失。对相关学者[19]研究结果,CEOP方案治疗后患者不良反应率为32.16%,联合利妥昔单抗注射液治疗时患者不良反应35.60%和该次研究结果37.50%相比并无显著提升。
由于疾病易于复发且病死率较高,因此探究不同治疗方式下患者复发率和生存时间十分重要。该次研究结果提出,观察组患者生存期更长,且疾病复发率更低(P<0.05)。出现此种情况主要原因为,联合利妥昔单抗治疗后患者耐药性有所降低,同时疾病治疗总有效率更高,患者不良反应也并无显著提升,因此治疗过程相对平稳,治疗对于患者机体所产生的损伤也较少,因此生存率较高[20-21]。
综上所述,为非霍奇金淋巴瘤(NHL)患者采用利妥昔单抗注射液联合CEOP方案治疗时不仅可提升患者疾病治疗总有效率,控制肿瘤标志物和免疫指标,提升生存时间,无严重不良反应。
