维生素B7 和B12 对细菌生物被膜形成及厚壳贻贝幼虫变态的影响*
2021-08-25杨金龙段志鸿丁文扬徐嘉康顾忠旗
杨金龙 段志鸿 丁文扬 徐嘉康 顾忠旗 梁 箫①
(1. 上海海洋大学 国家海洋生物科学国际联合研究中心 上海 201306;2. 上海海洋大学 水产种质资源发掘与利用教育部重点实验室 上海 201306;3. 南方海洋科学与工程广东省实验室 广东 广州 511458;4. 浙江省嵊泗县海洋科技研究所 浙江 舟山 202450)
厚壳贻贝(Mytilus coruscus)为一种具备较高营养的经济贝类(Wanget al, 2012; 徐嘉康等, 2017),常见于东海、黄海和渤海沿岸海域,主产区为浙江舟山东海海域,其养殖生产已发展了十几年,年度平均养殖数目高达50~60 亿粒以上(王如才等, 1998; 罗友声等,2003)。但近年来,由于贻贝养殖区域划分不规范、各级管理存在缺陷、贻贝灾害频发等问题,造成厚壳贻贝资源衰退(王靖陶等, 2010)。为了恢复和发展厚壳贻贝的野生资源,陆地工厂化人工育苗、海区增殖放流、贻贝海洋牧场养殖示范区建设等技术与产业迅速发展起来(张义浩等, 2003; 常抗美, 2007; 罗海忠等, 2016)。厚壳贻贝在其生活史中必须经历从浮游生活阶段过渡到附着生活阶段的变态发育过程,才可长成成贝(Wanget al, 2012)。附着变态后的贻贝也可通过切断其足丝的方式,寻找新的适宜环境进行二次附着(李太武, 2013)。因此,如何提高厚壳贻贝幼虫的附着变态率就成为其增养殖相关产业发展的核心技术问题。
研究表明,由海洋细菌所形成的生物被膜可以实现对大部分海洋无脊椎动物幼虫附着变态情况的调节(杨金龙等, 2012)。例如,假交替单胞菌属(Pseudoalteromonas)的某些细菌(Uhlingeret al, 1983;Holmströmet al, 1999)可形成对厚壳贻贝(Yanget al,2013)和华美盘管虫(Hydroides elegans) (Shikumaet al,2014)等幼虫附着变态具有显著诱导作用的生物被膜。生物被膜的形成受许多因素的影响(Yanget al,2014、2016a、2016b)。其中,对生物机体生理生化有影响的钙、铁离子等营养素会导致海洋细菌形成的生物被膜的形态结构、分布和蛋白含量具有差异,并影响厚壳贻贝的附着(孙俊杰等, 2016; 常睿珩等,2020)。
B 族维生素作为一类有机物质,广泛存在于自然环境中,是维持生物体生命活动的重要活性物质(Degnanet al, 2014)。它能够调控大多数细菌的生理和生化反应,例如糖代谢、脂代谢、蛋白代谢和DNA合成等,从而影响生物体生长发育(Woodset al, 1953;王春华等, 2011; 王雅平等, 2019; 周莹等, 2020)。研究表明,B 族维生素通过影响布鲁杆菌属(Brucella)和沙门菌属(Salmonella)细菌的主要营养物质代谢等生理生化反应进而调控细菌生物量(Matras, 1973);B族维生素可显著促进海蠕虫(Capitella teleta)幼虫附着变态(Burnset al, 2018)。其中,维生素B7(VB7)和B12(VB12)以辅基或辅酶的形式参与机体的生理生化反应,调节新陈代谢并维持细胞、器官和组织结构和功能的完整,确保生命活动正常运行(Brown, 1989;Knowleset al, 1989; Ekhardet al, 1998)。但B 族维生素对海洋细菌生物被膜形成及海洋贝类幼虫变态的影响尚不清楚。
本研究通过将厚壳贻贝眼点幼虫直接暴露于VB7 和VB12 中,以及在对厚壳贻贝幼虫附着变态具有高诱导活性的海假交替单胞菌(Pseudoalteromonas marina)生物被膜形成过程中添加VB7 和VB12,明确其对厚壳贻贝幼虫附着变态的影响,探索B 族维生素、海洋细菌生物被膜形成和海洋贝类幼虫变态三者间的相互关系,为解析厚壳贻贝附着变态分子机制提供新思路和理论依据。同时,也为B 族维生素应用于海洋牧场建设中人工鱼礁礁体构造和厚壳贻贝人工养殖行业技术的完善提供科学依据。
1 材料与方法
1.1 实验菌株
实验所用的海假交替单胞菌分离自浙江省舟山市嵊泗县海域(30°72′N、122°76′E)挂板形成的自然生物被膜,并储存于-80℃超低温冰箱中(Penget al,2020)。
1.2 实验材料
实验所用的VB7 和VB12 购于西格玛奥德里奇(上海)贸易有限公司。实验中使用的厚壳贻贝幼虫在2019 年中旬在浙江省某县(30°69′N、122°46′E)采集。在实验室环境中,以10 ind./mL 密度于盐度30 的自然海水中暂养,每2 d 换水,每天投喂1×104cells/mL湛江等鞭金藻(Isochrysis zhanjiangensis)藻液,避光18℃充气培养7 d 后进行实验(梁箫等, 2020a)。
1.2.1 VB7 和VB12 直接诱导 将VB7、VB12 和通过杀菌处理过的海水相溶(autoclaved filtered seawater, AFSW),并在此基础上形成pH=7.6 的母液,将母液加入无菌培养皿(规格为64 mm×19 mm)中,并加适量AFSW 定容至20 mL,设立空白对照组和B族维生素终浓度为0.02、0.2、2 和20 mmol/L 的不同实验组,每组设置9 个生物学重复。将20 只眼点幼虫添加到无菌培养皿中,置于18℃避光环境中培养96 h。记录12、24、48 及96 h 的幼虫附着变态数量,通过运算获得幼虫附着变态率。
1.2.2 VB7和VB12 处理后海假交替单胞菌生长曲线绘制 参照朱艳蕾等(2016)方法测定处理后海假交替单胞菌生长曲线,取菌液(OD600nm约为1),按1%接种量转接至盛有300 mL 2216E 液体培养基的圆底烧瓶内连续培养,封瓶膜封口,不同培养时间取培养液,立即测定OD600nm值,每个时间点设置3 个生物学重复,以OD 值为纵坐标、培养时间为横坐标,绘制生长曲线。
1.2.3 VB7和VB12 处理后海假交替单胞菌生物被膜制备 参照杨金龙等(2015)方法制备生物被膜,取储存的海假交替单胞菌划线于2216E 平板上,25℃培养12 h 后,挑取单菌落接种到2216E 液体培养基中,置于25℃避光条件下扩大培养。以3500 r/min 离心15 min,去除上清液,用AFSW 洗涤细菌沉淀3 次,最后定容至50 mL 制成细菌悬浊液,取1 mL 稀释(细菌悬浊液∶AFSW=1∶99)后的菌液过滤至0.22 μm滤膜上,0.1%吖啶橙染色5 min,然后在荧光倒置显微镜(Olympus BX51)下观察,计算细菌浓度。在装有无菌载玻片的无菌培养皿中分别加入适量的菌液与VB7 和VB12 的混合物,加适量AFSW 定容至20 mL,并使细菌的初始浓度为5×108cells/mL,VB7 和VB12最终浓度为0 (对照)和0.02 mmol/L,每组设9 个生物学重复,避光18℃下培养48 h,以制备生物被膜。
1.2.4 幼虫附着变态实验 将附有生物被膜的载玻片转移至20 mL AFSW 无菌培养皿中,并向培养皿中添加20 只眼点幼虫,该实验由空白(Blank, 无菌玻片)、肾上腺素(Epinephrine, EPI)、自然生物被膜(Bacterial biofilm, BF)这3 种对照组和实验组(生物被膜)组成(Satuitoet al, 1999; Yanget al, 2008)。每组设置9 个生物学重复,避光18℃条件下记录12、24、48 和96 h 幼虫附着变态率(梁箫等, 2020b)。
1.2.5 生物被膜细菌密度计数 借鉴杨娜等(2017)提出的方法,记录细菌密度值,并把生物被膜在5%的福尔马林试剂内浸泡48 h,0.1%吖啶橙染色5 min,之后放到荧光显微镜(Olympus BX51)下计数细菌密度,每片生物被膜中随机选择10 个视野,每组设置3 个生物学重复。
1.2.6 生物被膜膜厚度分析 参照杨娜等(2017)的方法分析膜厚度,将生物被膜在5%的甲醛溶液中固定24 h,避光条件下5 μg/mL 碘化丙啶(PI)浸染处理20 min,之后通过1×PBS 进行多次清洗。并借助激光共聚焦显微镜(confocal laser scanning microscopy, CLSM)展开详细观察,针对每组设置3 个生物学重复,并自由挑选出10 个视野进行成像分析,以确定生物被膜膜厚度。
1.2.7 生物被膜胞外产物分析 参照 González-Machado 等(2018)方法分析胞外产物。用0.9%生理盐水清洗培养好的生物被膜3 次,通过相关试剂(表1)进行染色处理,该步骤需要在没有光线的环境下操作20 min。之后通过0.9%的盐水进行漂洗,并放在同样没有光线的环境中,待其干燥之后通过CLSM 显微镜详细观察,并自由挑选出10 个视野对其成像效果予以分析。每组设置3 个生物学重复。

表1 生物被膜胞外产物染色试剂Tab.1 Staining reagent of biofilm EPS composition
1.2.8 生物被膜可拉酸染色 参照杨金龙等(2015)的方法制备生物被膜,从载玻片刮下生物被膜,涂布在玻璃片上,然后风干、染色。可拉酸染色参考Ren等(2016)的方法,将0.3 g 碱性品红、90 mL 含5%苯酚和10 mL 95%乙醇混合制成品红溶液,将玻璃片染色3 min。用媒染剂溶液[2.0 g/L KAl(SO4)2∶0.3 g/L FeCl3∶1.5 g/L 丹宁酸=5∶2∶2]染色3 min。最后,1%亚甲基蓝溶液染色30 s。在每次染色之前,蒸馏水冲洗生物被膜以去除上一种染色液。细菌细胞染成红色,可拉酸染成蓝色。每组设置3 个生物学重复。
1.2.9 可拉酸定量 参考Obadia 等(2007)的方法定量可拉酸。从12 个生物被膜中收集细菌细胞,并将其悬浮在1 mL 蒸馏水中。100℃煮沸细菌10 min,13,000g离心15 min,弃去沉淀,收集上清液,定量可拉酸。加入4.5 mL H2SO4/H2O 溶液(6∶1),于1 mL上清液中制成混合液,100℃反应20 min。冷却至25℃,将2 mL 混合液用于检测396 nm (A396co)和427 nm(A427co)吸光度。将100 μL 的3%(m/v)半胱氨酸盐酸溶液与剩余混合液在25℃下避光孵育1 h 后,在396 nm (A396cy)和427 nm (A427cy)测吸光度。将(A396cy-A396co)-(A427cy-A427co)的值代入L-岩藻糖浓度标准曲线(10~100 μg/mL)计算可拉酸浓度。
1.3 数据统计与分析
使用JMP 软件(ver.10.0.0)进行统计分析和相关性检验(Lianget al, 2020)。将幼虫的变态率百分比转化为反正弦以观察正态分布情况,如果符合该现象,则需要通过单因素方法对其中的差异进行分析。反之,便需要进行Kruskal-Wallis 检验分析。Spearman多元分析方法用于幼虫变态率与B 族维生素浓度及细菌密度之间的相关性分析,采用P为检验值,r为相关系数,显著性水平设置为0.05。生物被膜胞外产物含量分析使用image 软件。
2 结果
2.1 VB7 和VB12 对幼虫变态的直接影响
图1 显示,0.02、0.2 mmol/L VB7 诱导幼虫变态率分别为(28.33±0.83)%和(11.67±0.83)%,VB12 诱导幼虫变态率分别为(13.89±1.39)%和(1.67±0.83)%,与空白对照组相比,均可显著提高诱导厚壳贻贝幼虫变态(P<0.05),其中以0.02 mmol/L 的诱导效果最好。而2、20 mmol/L VB7 的变态率分别为(5.56±1.30)%和(1.67±0.83)%,VB12 的变态率分别为(1.67±0.83)%和0%,与空白对照组相比,均出现显著抑制作用(P<0.05),其中以20 mmol/L 浓度的抑制作用最强。
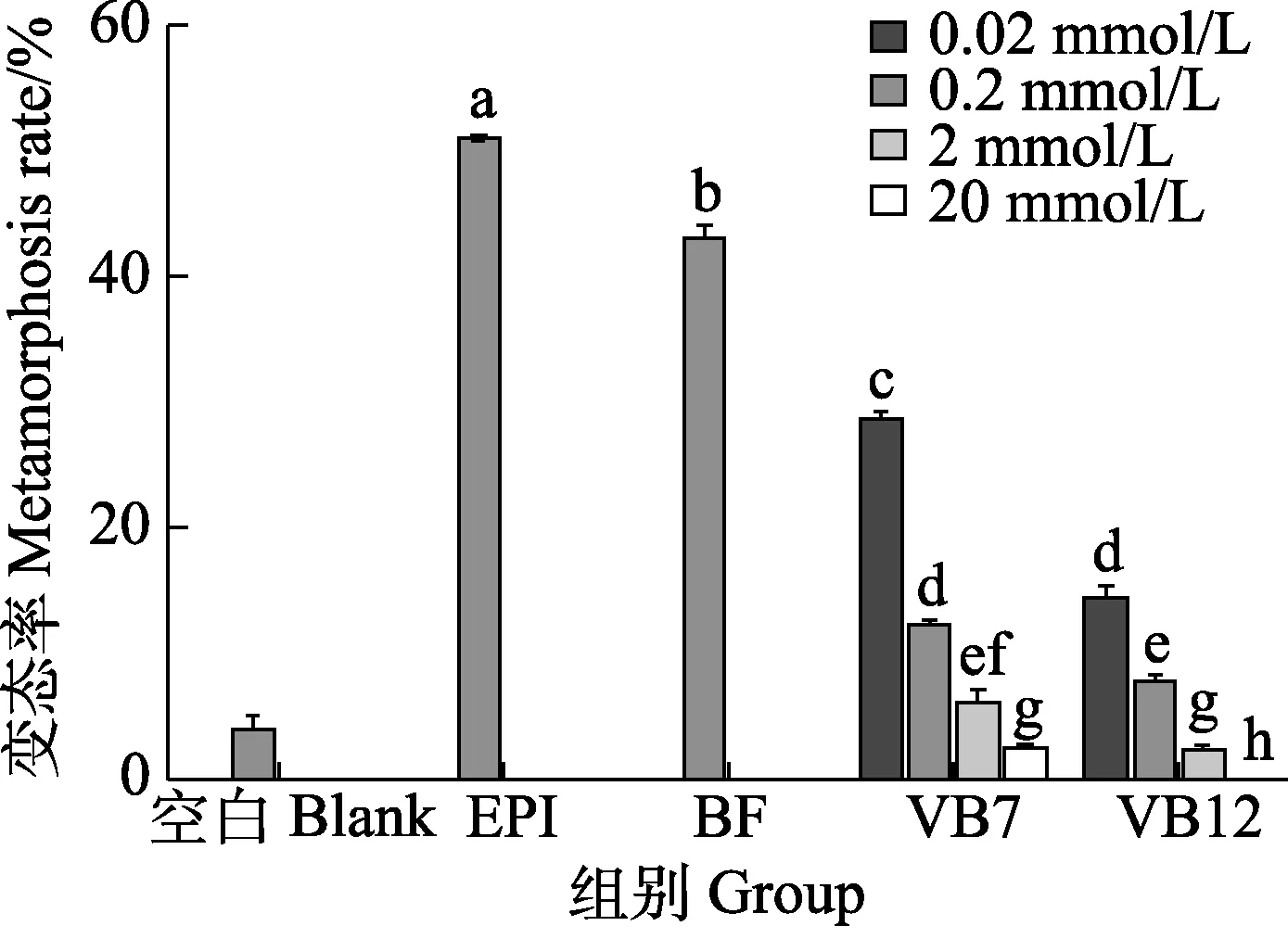
图1 VB7 和VB12 对厚壳贻贝幼虫变态的影响(72 h)Fig.1 Effects of VB7 and VB12 on larval metamorphosis in the mussel M. coruscus at 72 h
2.2 VB7 和VB12 对海假交替单胞菌生长的影响
对照组和处理组海假交替单胞菌在培养1 h 后进入生长对数期,6 h 后进入稳定期(图2)。培养6 h时,OD600nm值分别为OD(P. marina)=0.9543、OD(P. marina+0.02mmol/LVB7)=1.0607 和OD(P. marina+0.02mmol/LVB12)=0.9923,相比于单一细菌的对照组,0.02 mmol/L 的VB7 和VB12在生长对数期对细菌生长均具有显著影响(P<0.05)。其中,VB7 对细菌生长的促进作用持续至稳定期,而VB12 在细菌生长9 h 后无明显作用。
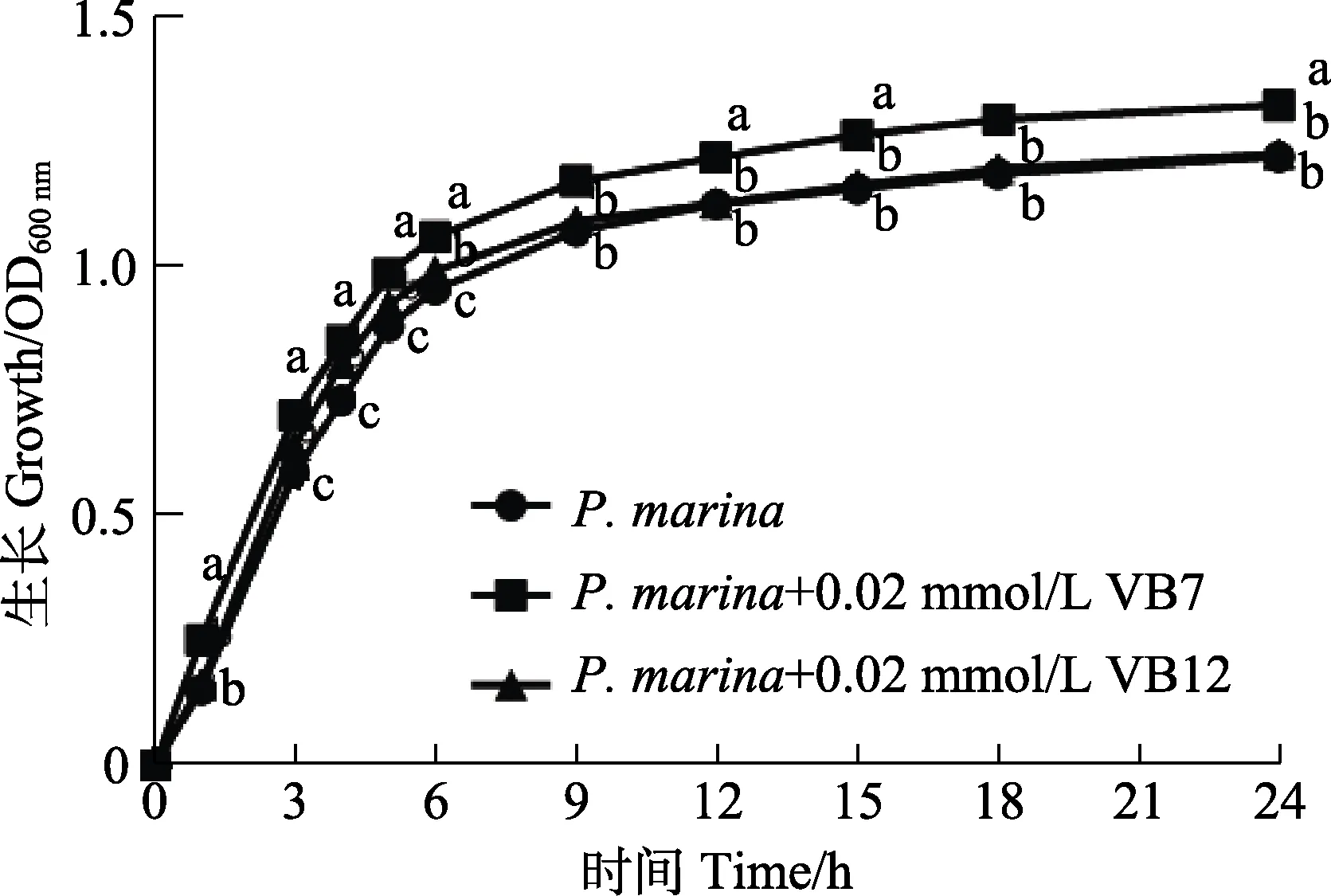
图2 VB7 和VB12 处理后的海假交替单胞菌生长曲线Fig.2 Growth curve of P. marina after treatment with VB7 or VB12
2.3 VB7 和VB12 处理后海假交替单胞菌生物被膜对幼虫变态的影响
图3 显示,由VB7 和VB12 与海假交替单胞菌形成的生物被膜诱导的幼虫附着变态率显著高于细菌单一生物被膜(P<0.05)。0.02 mmol/L 浓度VB7 处理后,海假交替单胞菌生物被膜诱导幼虫附着变态率为(71.0±3.9)%;0.02 mmol/L 浓度VB12 处理后的幼虫附着变态率为(60.1±3.3)%,二者均显著高于细菌单一生物被膜附着变态率(38.8±3.09)% (P<0.05)。
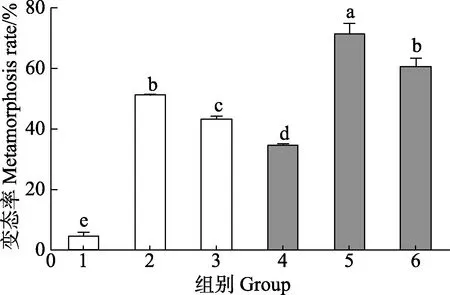
图3 VB7 和VB12 处理后的海假交替单胞菌生物被膜对厚壳贻贝幼虫变态的影响(48 h)Fig.3 Effects on metamorphosis of post-larvae on the P.marina biofilms after treatment with VB7 or VB12 at 48 h
2.4 VB7 和VB12 处理后海假交替单胞菌生物被膜生物量的变化
图4 显示,初始浓度为5×108cells/mL 的海假交替单胞菌分别与VB7 和VB12 共同形成生物被膜,其细菌密度明显高于细菌单一生物被膜(P<0.05),VB7 和VB12 处理后的生物被细菌聚集性增强(图5),且膜厚度显著提高(P<0.05)(图6)。相关分析结果显示,生物被膜所具备的细菌密度和膜厚度均与诱导活性具有极显著相关性(P<0.05)(表2)。
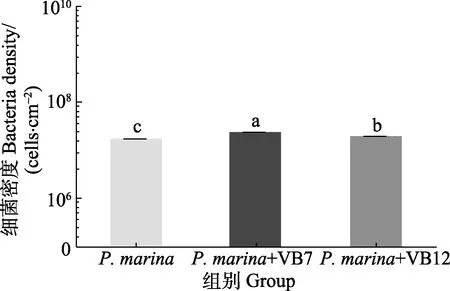
图4 VB7 和VB12 处理后的海假交替单胞菌生物被膜细菌密度Fig.4 Density of P. marina biofilms after treatment with VB7 or VB12

图5 激光共聚焦扫描电镜下VB7 和VB12 处理后的海假交替单胞菌生物被膜形态Fig.5 CLSM reveals morphology of P. marina biofilms after VB7 or VB12 treatment
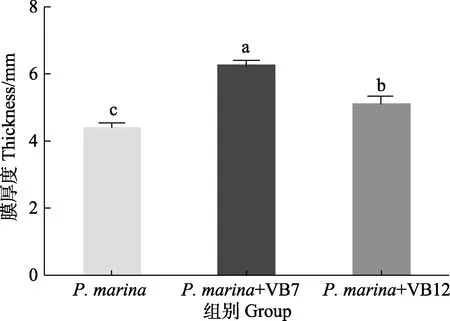
图6 激光共聚焦扫描电镜下VB7 和VB12 处理后的海假交替单胞菌生物被膜厚度Fig.6 CLSM reveals thickness of P. marina biofilms after treatment with VB7 or VB12
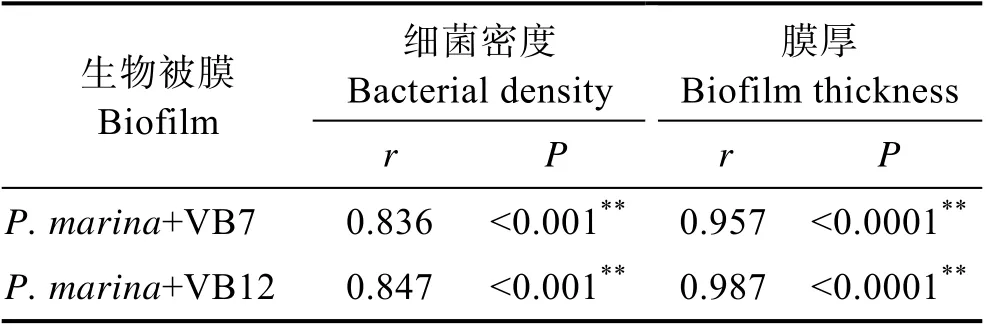
表2 生物被膜厚度和细菌密度与诱导活性的相关性分析Tab.2 Correlation analysis between biofilm thickness,bacterial density and inducing activity
2.5 海假交替单胞菌生物被膜胞外产物的变化
荧光染色显示(图7),海假交替单胞菌单一生物被膜细菌呈颗粒状分布,胞外产物分布较为均匀,而VB7 和VB12 处理后的生物被膜细菌多聚集状态,胞外产物含量明显升高,且多呈块状分布。
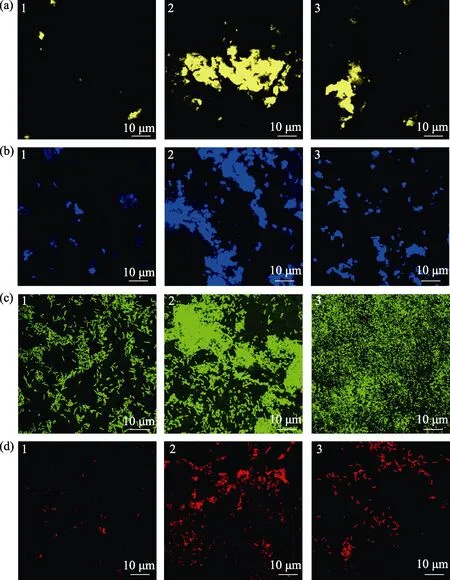
图7 激光共聚焦扫描电镜下VB7 和VB12 处理后的海假交替单胞菌生物被膜胞外产物Fig.7 CLSM reveals extracellular products of P. marina bacterial biofilms after VB7 or VB12 treatment
3 组生物被膜α 多糖、β 多糖、蛋白质和脂质含量见图8。与单一生物被膜相比,VB7 处理后具有更高含量的α 多糖、β 多糖、蛋白质和脂质。其中,单一生物被膜的α 多糖含量仅为(1536.50±57.36) μm3,而VB7 处理后生物被膜的α 多糖含量为(800,590.25±46,499.65) μm3,上调了520 倍(P<0.05)(图8)。
2.6 处理后海假交替单胞菌生物被膜的可拉酸含量
染色结果显示,相比于单一细菌生物被膜,VB7和VB12 处理后生物被膜可拉酸分布更密集(图8),且含量明显提高(图9)。单一细菌生物被膜可拉酸含量为(30.46±6.03) μg/mL,而VB7 和VB12 处理后含量分别为(215.78±24.18)和(158.27±23.27) μg/mL,升高了7.08 倍和5.20 倍(P<0.05) (图9)。
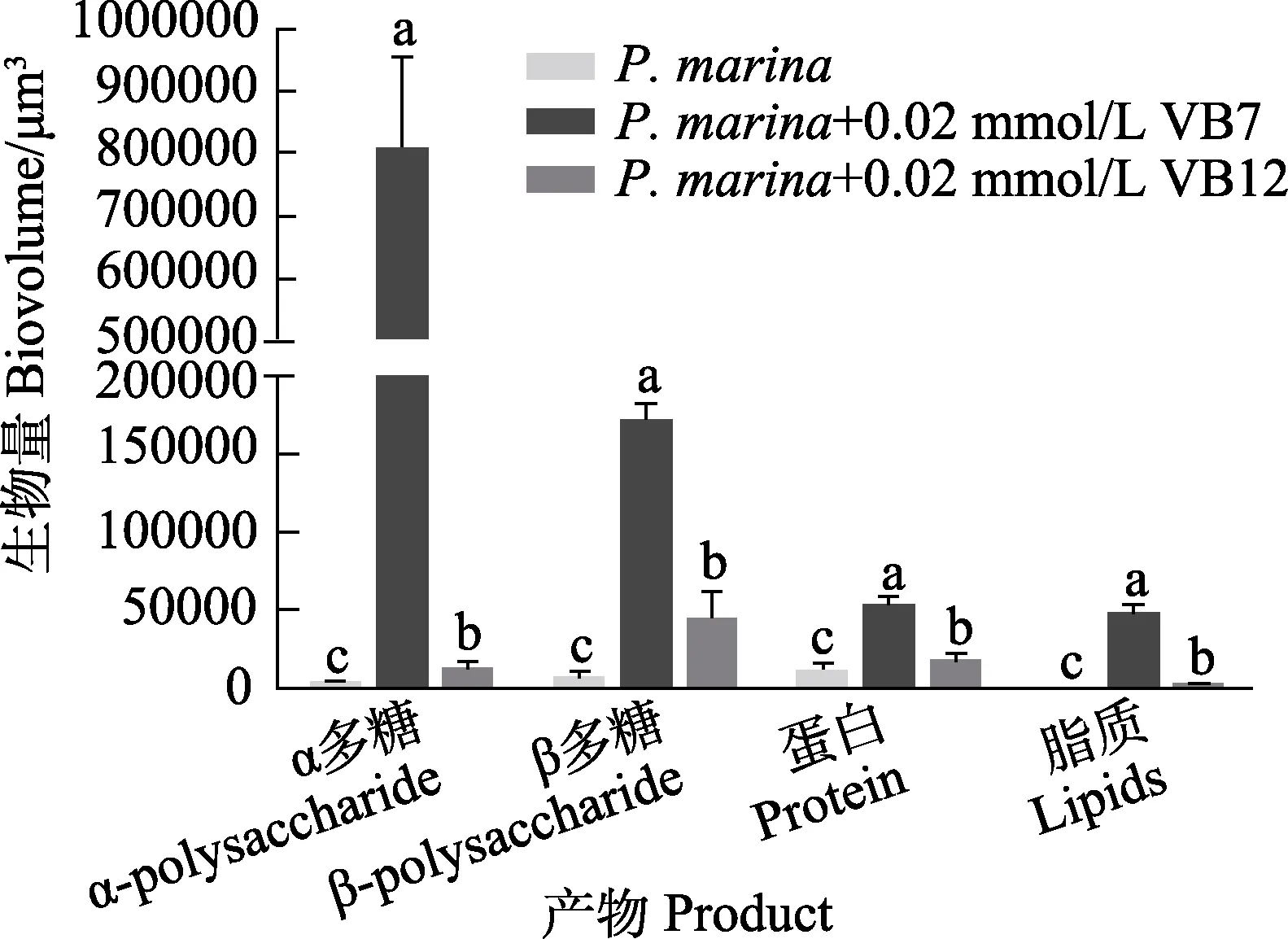
图8 激光共聚焦扫描电镜下VB7 和VB12 处理后的P. marina 生物被膜胞外产物含量Fig.8 CLSM reveals extracellular products of P. marina biofilms after VB7 or VB12 treatment
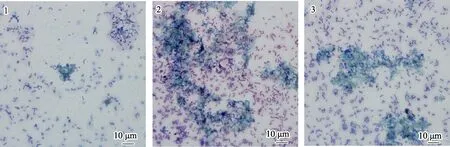
图9 媒染剂染色生物被膜光学显微镜的观察Fig.9 Light microscopic observation of mordant-stained biofilms
3 讨论
3.1 B 族维生素对生物被膜形成的影响
B 族维生素作为生长辅助因子,以辅基或辅酶的形式参与机体的生理生化反应,调节新陈代谢,并维持细胞、器官和组织结构和功能的完整,是确保所有生命活动正常运行的重要营养物质(Brownet al, 1989;Knowleset al, 1989; Ekhardet al, 1998)。本研究的结果显示,0.02 mmol/L 浓度下VB7 和VB12 与初始细菌浓度为5×108cells/mL 的P. marina共同形成生物被膜,与P. marina单一生物被膜相比,细菌密度和膜厚度显著增加,细菌成聚集状态,并产生大量的多糖等胞外产物。Matras(1973)研究表明,B 族维生素可通过影响布鲁杆菌属和沙门菌属细菌的主要营养物质代谢等生理生化反应来调节细菌生物量。因此,推测B 族维生素的加入可以提高生物被膜的生物量和胞外产物含量,进而促进生物被膜的形成。
3.2 B 族维生素对幼虫变态的影响
3.2.1 B 族维生素对幼虫变态的直接影响 许多海洋无脊椎动物在发育为成体前处于浮游幼虫阶段。幼虫的浮游阶段可以短则几分钟,也可以长达几个月。通常,海洋无脊椎动物幼虫的附着变态主要受外界环境和内源性因素控制(Crisp, 1974; Pawlik,1992),特别是外界环境因子对于幼虫的附着变态至关重要(Morse, 1990; McClintocket al, 2001)。B 族维生素广泛存在于自然环境中,并作为营养物质参与幼虫的附着变态过程。Burns 等(2018)研究表明,B族维生素可通过影响海蠕虫幼虫的主要营养物质代谢水平进而提高幼虫附着变态率。然而,关于B 族维生素与海洋贝类附着二者间的相互作用关系仍有待研究。

图10 VB7 和VB12 处理后的P. marina生物被膜可拉酸含量Fig.10 Colanic acid production in P. marina biofilms after VB7 or VB12 treatment
研究结果显示,0.02、0.2 mmol/L 浓度下VB7和VB12 的孵育均可以显著诱导厚壳贻贝幼虫变态。其中以0.02 mmol/L 浓度下的诱导作用较强,但2、20 mmol/L 浓度下VB7 和VB12 对幼虫变态起抑制作用。因此,推测在一定浓度的条件下,B 族维生素可能通过增强幼虫糖类、脂类和蛋白质代谢及免疫系统功能进而促进厚壳贻贝等海洋贝类幼虫的附着变态。
3.2.2 生物被膜与幼虫变态的关系 生物被膜生物量和胞外产物(胞外多糖、蛋白、脂质等)含量是影响海洋无脊椎动物附着的关键因素(Kirchmanet al,1981; Hadfieldet al, 2011)。研究表明,厚壳贻贝幼虫附着变态和稚贝附着都受到细菌密度的影响(Wanget al, 2012; 杨金龙等, 2013; Yanget al, 2014)。厚壳贻贝与生物被膜相关性研究证实,细菌密度与附着变态呈显著相关;自然生物被膜和胞外产物的群落结构对合浦珠母贝(Pinctada fucata)幼虫附着具有十分关键的诱导功能(Yuet al, 2010);海洋假单胞菌Strain S9所对应的生物被膜胞外多糖大幅度加快了海鞘(Cionaintestinalis)幼虫附着变态(Szewzyket al,1991)。因此,推测厚壳贻贝幼虫附着变态除了与B族维生素的直接诱导作用有关外,还可能与生物被膜的生物量和胞外产物含量有关。研究结果显示,VB7和VB12 处理后的生物被膜显著提高了厚壳贻贝幼虫的附着变态率,其生物被膜的生物量和胞外产物含量显著高于P. marina单一生物被膜,其中,胞外多糖含量升高520 倍。前期研究发现,多糖能够诱导许多海洋无脊椎动物幼虫附着变态(Kirchmanet al, 1982;Szewzyket al, 1991; Matsumuraet al, 1998;Khandeparkeret al, 2003; Baoet al, 2007; Zenget al,2015),其中,最具代表性的是由生物学重复单元(葡萄糖、岩藻糖、半乳糖和葡萄糖醛酸)与α 键和β 键相连所组成的可拉酸(Whitfield, 2006; Schmidet al,2015),可拉酸能在细菌周围产生高度负电荷胶囊(Goebel, 1963; Allenet al, 1987),并将吸附细菌周围的矿物质和营养物质(Ophiret al, 1994),促进具有诱导海洋无脊椎动物幼虫附着变态活性的附着基的形成。实验证明,P. marina细菌多糖相关基因缺失后,可拉酸的产生量增多,细胞内c-di-GMP 水平升高,c-di-GMP 水平的升高导致细菌运动能力降低,进而促进细菌粘附和生物被膜的形成,从而提高厚壳贻贝幼虫的附着变态率(Whiteleyet al, 2015; Pérez-Mendozaet al, 2016; Penget al, 2020)。本研究结果显示,VB7 和VB12 处理后生物被膜的生物量和胞外产物(可拉酸)含量均显著升高,并均对厚壳贻贝幼虫的附着变态存在显著诱导作用。因此,推测B 族维生素可能通过协同c-di-GMP 调节可拉酸的产生,从而正调控生物被膜的形成和厚壳贻贝幼虫的附着变态,但B 族维生素对c-di-GMP 水平的影响尚需进一步研究。这一发现为阐明生物被膜与幼虫之间的相互作用提供了新的视角。
本研究首次发现,VB7、VB12 两种B 族维生素对厚壳贻贝幼虫变态具有直接诱导作用。同时,VB7和VB12 通过促进P. marina生物被膜的形成,增加生物被膜的细菌密度和膜厚度,提高生物被膜胞外产物含量,从而间接促进厚壳贻贝幼虫的附着变态。本研究为探究厚壳贻贝幼虫附着变态的分子机制提供了新的理论依据和创新思路,同时,为B 族维生素在提高厚壳贻贝人工育苗技术、改善厚壳贻贝养殖产业问题和海洋牧场建设等生态修复方面的应用提供了理论基础。
