小石岛刺参国家级水产种质资源保护区综合评价*
2021-08-25刘丽娟姜向阳高继庆宋秀凯张学超姜会超刘爱英邢红艳
刘丽娟 姜向阳 高继庆 宋秀凯 张学超 付 萍 姜会超 刘爱英 邢红艳①
(1. 山东省海洋资源与环境研究院 山东省海洋生态修复重点实验室 山东 烟台 264006;2. 威海市海洋与渔业监测减灾中心 山东 威海 264200)
近几十年来,受全球自然环境变化和人类活动的影响,我国水生生物资源严重衰退(郭子良等, 2019)。为保障渔业可持续发展,2007 年,农业部批准在具有较高经济价值和遗传育种价值的水产种质资源的主要生长繁育区域建立国家级水产种质资源保护区,于2011 年发布实施《水产种质资源保护区管理暂行办法》。至2018 年底,全国分11 批建立国家级水产种质资源保护区535 处,保护面积共1560.79 万hm2。2007 年以来,我国国家级水产种质资源保护区的数量和保护面积快速增长,但保护区重建设、轻管理的现象比较突出(杨璐等, 2014),相关研究较少,其中,淡水保护区主要集中于生物资源调查(禹真等, 2013;索维国等, 2018; 郝雅宾等, 2109),涉海保护区更关注水质 (崔毅等, 2013; 夏斌等, 2014; 滕瑶等, 2018;王珍珍等, 2019)和生物生态(于雯雯等, 2013; 袁健美等, 2013; 宁璇璇等, 2014)。
刺参(Apostichopus japonicus)是我国传统海珍品,主要分布于西北太平洋沿岸,国内自然分布于山东、辽宁、河北、江苏北部沿海(廖玉麟, 1997)。随着刺参的开发利用日益广泛,市场需求迅速增加,对野生刺参的过度捕捞导致其自然资源急剧下降,刺参增养殖业也迅猛发展。2017 年,我国刺参增养殖面积为21.916 3 万hm2,年产量为21.9907 万t (农业农村部渔业渔政管理局等, 2018),产值达数百亿元,刺参已成为我国海水增养殖产值最高的品种之一。为保护刺参种质资源,山东省先后获批建立了3 个刺参国家级水产种质资源保护区,小石岛刺参国家级水产种质资源保护区为其中之一。该保护区建立于2009 年,总面积为471 hm2,其中,核心区面积为165 hm2,实验区面积为306 hm2,特别保护期为全年。保护区位于山东省威海市东北海域,海岸线东起威海国际海水浴场烟墩山,西至小石岛渔码头,往西南至 -12 m等深线。主要保护对象为刺参,其他保护对象包括海胆、鲍鱼、大叶藻等(中华人民共和国农业部, 2010)。
为全面掌握保护区生态环境和资源状况,2012―2018 年,连续7 年对小石岛刺参国家级水产种质资源保护区保护生物状况进行调查,对水环境、沉积物环境、海洋生物生态开展全面监测与评价,并利用刺参线粒体DNA(mtDNA)控制区(D-loop)变异较快、适合于种内遗传分析的特点(李云峰等, 2013),采用PCR特异性扩增结合DNA 测序技术获得D-loop 全序列,对该保护区野生刺参种群遗传多样性进行研究。客观评价该保护区海洋生态环境、刺参遗传多样性和主要保护物种概况,分析保护区管理的经验和存在的问题,为更好地开展水产种质资源保护区评价和管理工作提供参考。
1 材料与方法
1.1 采样时间和方法
2012―2014 年,在保护区设置4 个站位,每年8月左右采样检测一次;2015―2018 年,在保护区设置5 个站位,每年5 月、8 月各采样检测一次。样品采集、 处理方法按照《 海洋监测规范》(GB17378.3-2007)相关规定执行。采样站位见图1。
图1 小石岛刺参国家级水产种质资源保护区采样站位Fig.1 The sampling stations of Xiaoshi Island A. japonicus national aquatic germplasm reserve
2012 年和2018 年,分别在保护区海底随机采集规格≥150 g 的刺参20 只以上,活体冷藏送至实验室。每只刺参解剖取纵肌约0.5 g 放于独立的1.5 ml 冻存管,-80℃冷冻保存。
1.2 监测参数与分析
水环境、沉积物环境、海洋生物监测与分析方法分别按照《海洋监测规范》(GB 17378.4-2007、GB 17378.5-2007 和GB 17378.7-2007)规定的方法执行。其中,重金属参数仅在2014―2018 年监测;沉积物和底栖生物每年8 月左右监测一次。
水环境pH、无机氮(DIN)、活性磷酸盐(PO4-P)、化学需氧量(COD)、溶解氧(DO)按《海水水质标准》(GB 3097-1997)Ⅰ类标准进行评价;重金属(Cu、Zn、Hg、Cd、Pb 和As)、石油类按《渔业水质标准》(GB 11607-1989)进行评价;海洋沉积物硫化物、有机碳、石油类、重金属(Cu、Zn、Hg、Cd、Pb 和As)均按《海洋沉积物质量》(GB 18668-2002)Ⅰ类标准进行评价。
刺参遗传多样性分析按以下方法进行。在NCBI GenBank 中查找并下载编号AB525437.1 的刺参mtDNA全序列,用Primer Premier 6.0 软件设计特异性引物并合成。引物序列为CS-F:TCGTAACATAGTAGGTGTA CC;CS-R:CAACCCATACTGCTGTAAAC。每只刺参取纵肌约100 mg,SDS 法提取刺参总DNA,无菌双蒸水溶解后作为模板进行 PCR 扩增(费来华等,2008)。PCR 产物双向测序、拼接,获得的mtDNA 序列与GenBank 编号AB 525437.1 中的D-loop 全序列经MEGA 4.0 比对,剪切得到刺参D-loop 全序列。2012 年和2018 年样品各作为一个群体,使用MEGA 4.0 和DnaSP 5.0 软件进行分析。
1.3 评价方法
1.3.1 单因子污染指数法评价水环境和沉积物环境理化参数 单个污染物的污染指数(iP)计算公式为:

式中,Pi为污染物的污染指数;Ci为污染物的实测浓度;Si为评价污染物的标准浓度。
1.3.2 有机污染指数法综合评价海水的有机物污染状况 有机污染指数(A)计算公式为(蒋国昌等, 1987):

式中,A为有机污染指数,CODi、DINi、DIPi和DOi为实际测试值,CODs、DINs、DIPs和DOs为上述各项评价指标所采用的标准浓度。
1.3.3 多样性指数法进行海洋生物多样性评价
Shannon-Weaver 多样性指数(H′) (Shannonet al,1963)计算公式为:
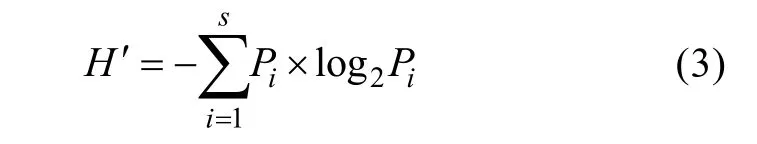
式中,H′为生物多样性指数;S为样品中的种类数量;Pi为第i种的个体数与总个体数的比值。
1.3.4 单倍型多样度、核苷酸多样度指数法进行遗传多样性评价 刺参D-loop 序列采用MEGA 4.0 和DnaSP 5.0 软件进行分析,分别计算2 个刺参群体的个体间遗传距离、平均遗传距离、单倍型多样度、核苷酸多样度、群体内序列间核苷酸差异的平均数和中性检验Tajima′sD值等遗传多样性指标。
2 结果与分析
2.1 水环境质量
2012―2018 年共计11 个航次的海水监测结果显示,保护区所有站位的pH 变化范围为7.99~8.38,DO 变化范围为6.11~10.2 mg/L,均达Ⅰ类水质标准;盐度变化范围为29.552~33.474;COD、DIP、DIN 和石油类的评价结果见图2。
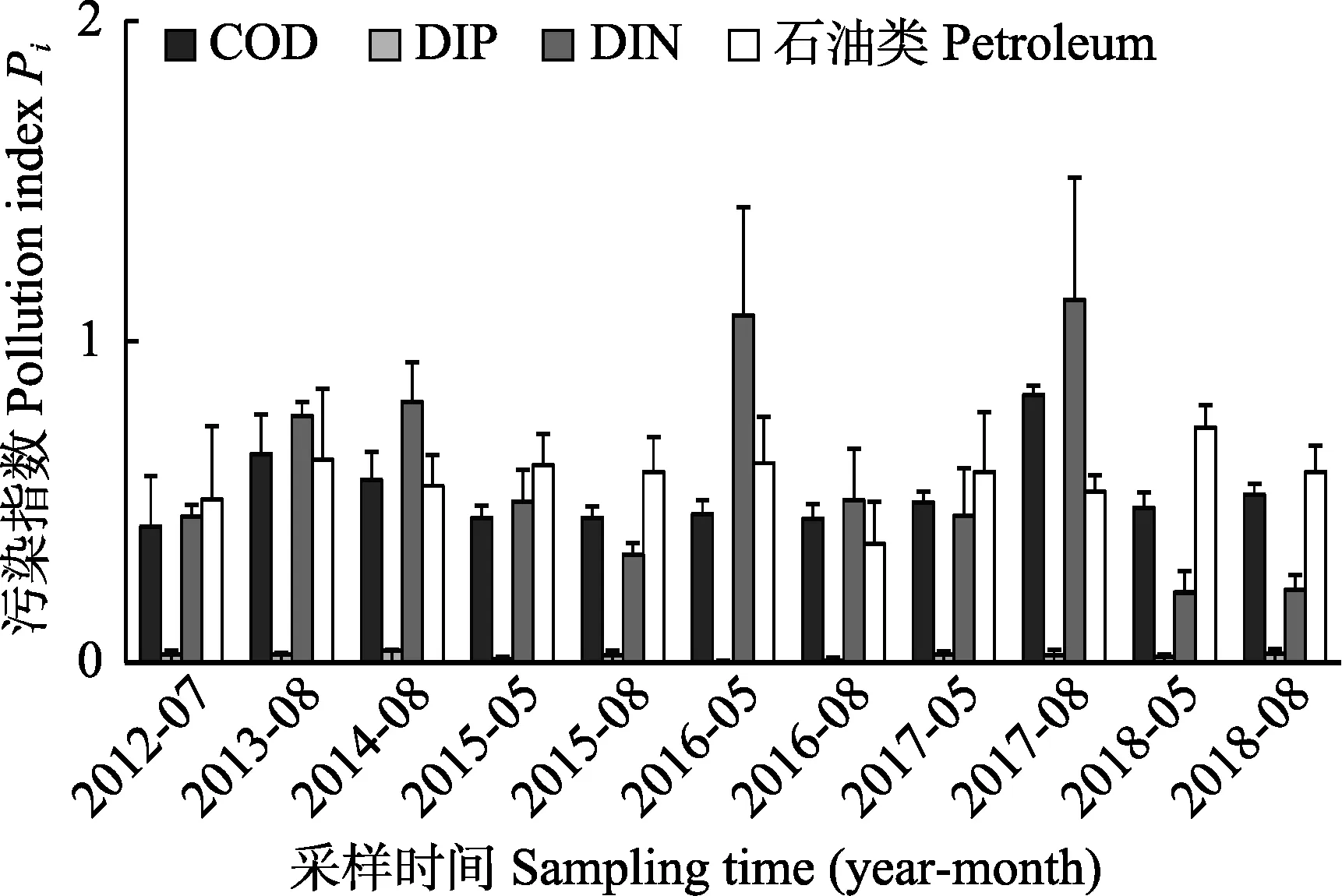
图2 海水COD、DIP、DIN 和石油类单因子评价结果Fig.2 Single factor evaluation results of COD,DIP, DIN and petroleum in sea water
所有航次的COD、DIP、石油类的污染指数Pi<1,均不存在污染。2016 年5 月和2017 年8 月监测中,DINPi>1,显示存在DIN 污染。分析发现,2016 年5 月监测5 个站位中,3 个站位DIN 达Ⅱ类海水水质标准,Pi分别为1.30、1.40 和1.42,1 个站位达Ⅲ类海水水质标准,Pi=1.56,平均Pi=1.08,80%站位超标;2017 年8 月监测5 个站位中,3 个站位达Ⅱ类海水水质标准,Pi分别为1.17、1.18 和1.23,1 个站位达Ⅳ类海水水质标准,Pi=2.05,平均Pi=1.13,80%站位超标;其他监测站位无DIN 超标现象。
2014―2018 年海水重金属的评价结果详见图3。所测Cu、Zn、Hg、Cd、Pb 和As 的污染指数Pi<1,显示该海区不存在6 种重金属污染。
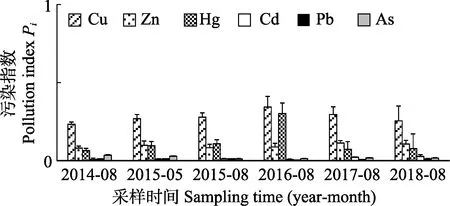
图3 海水Cu、Zn、Hg、Cd、Pb 和As 单因子评价结果Fig.3 Single factor evaluation results of Cu,Zn, Hg, Cd, Pb and As in sea water
2012―2018 年海水有机污染的评价结果详见图4。
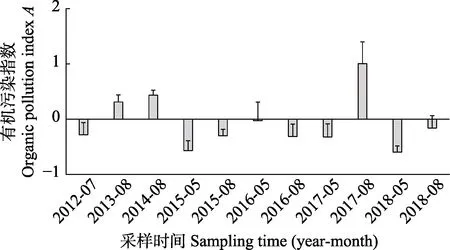
图4 海水有机污染指数评价结果Fig.4 Organic pollution index in sea water
按有机污染指数法(蒋国昌等, 1987)评价标准,2017 年8 月监测的5 个站位中,3 个站位有机污染指数A分别为1.34、1.75 和1.13,平均A=1.001,显示水质开始受到有机物污染;其他监测时间和站位水质良好(A≤0)或较好(0<A≤1)。该分析结果显示,小石岛刺参国家级水产种质资源保护区水环境质量总体较好,偶尔出现DIN 超标现象,证明该保护区主要潜在污染物为DIN。
2.2 沉积物环境质量
2012―2018 年,保护区沉积物所有9 个评价参数:硫化物、有机碳、石油类、重金属(Cu、Zn、Hg、Cd、Pb 和As)的污染指数Pi<1,满足保护区要求的海洋沉积物质量标准,显示保护区沉积物环境良好。
2.3 海洋生物群落特征
2012―2018 年,保护区所有监测站位的叶绿素含量为0.22~6.12 μg/L。2012 年7 月的平均值最低,为0.35 μg/L;2016 年5 月和2017 年5 月为最高,均为4.26 μg/L,叶绿素含量变化较大。浮游植物和浮游动物每航次采样,底栖生物每年8 月前后采样1 次。生物多样性指数见表1,生物多样性评价结果见图5。
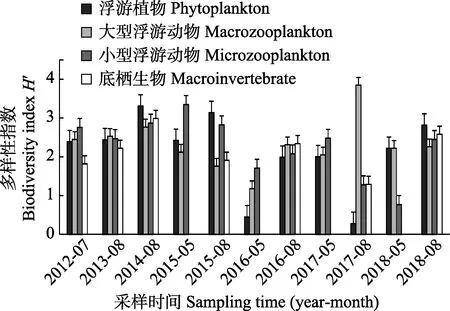
图5 海洋生物多样性评价Fig.5 Evaluation of marine biodiversity
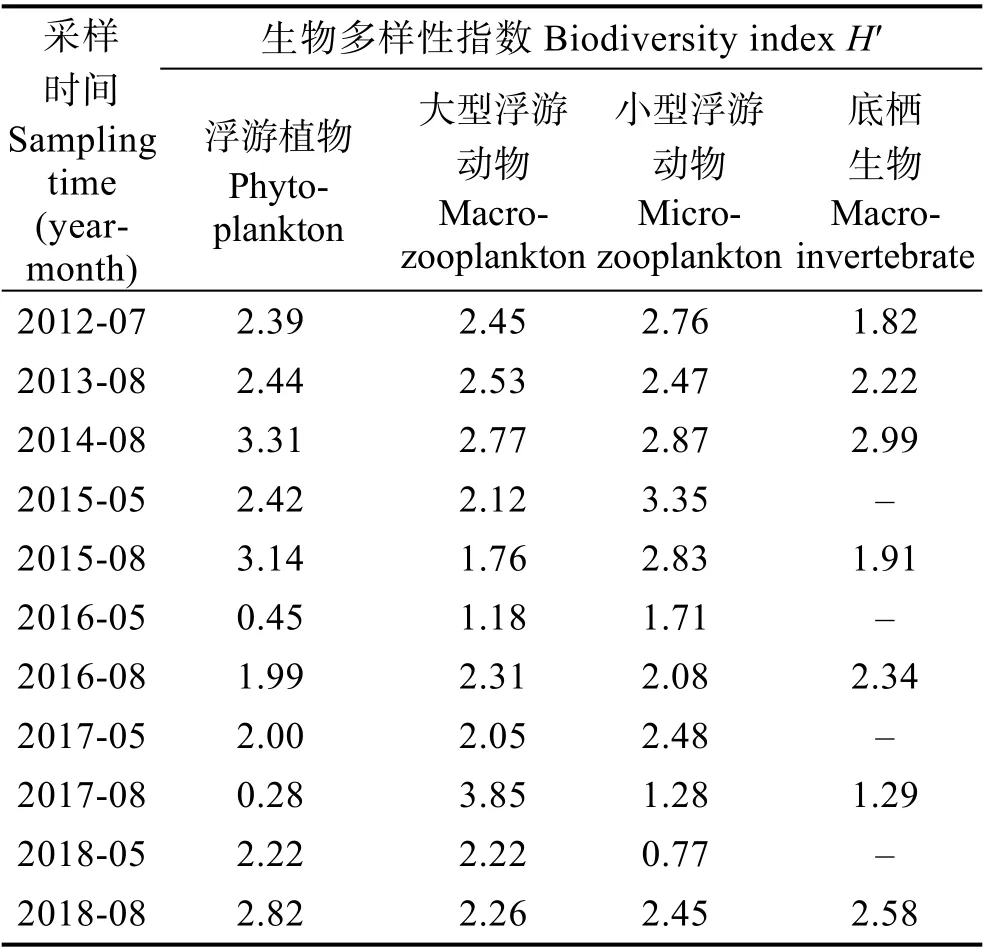
表1 生物多样性指数统计Tab.1 The statistics of biodiversity indices
保护区每航次检出浮游植物9~24 种不等,以硅藻(Diatom)为主,其中,角毛藻(Chaetocerossp.)、圆筛藻(Coscinodiscussp.)最常见,甲藻(Dinoflagellates)中最常见三角角藻(Ceratium tripos),未检出已知产毒藻。每航次监测的浮游植物密度差距很大,从2018 年5月的3.0×103cell/m3至2017 年8 月的3.3×107cell/m3不等。按生物多样性指数评价,2016 年5 月H′=0.45,2017 年8 月H′=0.28,多样性偏低。经分析发现,2016年5 月该海区柔弱几内亚藻(Guinardia delicatula)的优势度达91.8%,2017 年8 月该海区旋链角毛藻(Chaetoceros curvisetus)优势度高达96.8%,单一藻种的大量繁殖导致浮游植物生物多样性偏低,生态结构不稳定;2016 年8 月H′=1.99,浮游植物生物多样性一般,其他航次均≥2,显示该保护区浮游植物多样性较高,生态结构稳定。
每航次采集到6~15 种大型浮游动物,变化不大。最低密度出现在2012 年7 月,为11 ind./m3;最高密度出现于2015 年8 月,为188 ind./m3。除2015 年8月和2016 年5 月H′分别为1.76 和1.18 外,其他航次均≥2。每航次采集到的小型浮游动物种类数为8~25 种,最低密度出现于2014 年8 月,为141 ind./m3,最高密度出现于2016 年8 月,为14,258 ind./m3;2018年5 月H′=0.077,显示小型浮游动物多样性偏低,经分析发现,本航次该海域夜光虫(Noctiluca scintillans)大量繁殖,优势度达87.2%;2016 年5 月和2017 年8 月,多样性指数H′分别为1.71 和1.28;其他航次均≥2。显示通常该保护区浮游动物多样性较高,生态结构稳定。该海区最常见浮游动物为强壮箭虫(Sagitta crassa)、小拟哲水蚤(Paracalanus parvus)、中华哲水蚤(Calanus sinicus)、多毛类幼体(Polychaeta larva)、桡足类无节幼体(Copepoda nauplius),还发现刺参、海胆、海星、虾类、腹足类、双壳类等经济生物幼体,及鱼卵、仔稚鱼等,可见该海区生物多样性丰富,是多种经济生物的自然繁殖场所。
每年采集到的底栖生物种类数为6~10 种,密度为200~800 ind./m2,均比较稳定。最常见底栖生物为索 沙 蚕(Lumbrinerissp.) 和 不 倒 翁 虫(Sternaspisscutata)。2012、2015 和2017 年生物多样性指数H′分别为1.82、1.91 和1.29,多样性一般,其他年份均≥2,显示通常该保护区底栖生物多样性较高,生态结构稳定。
总之,小石岛刺参国家级水产种质资源保护区的海洋生物种类丰富,多样性指数以较高水平为主,偶尔出现单种浮游植物或浮游动物大量增殖导致多样性指数偏低现象。
2.4 刺参遗传多样性
2012 和2018 年分别在保护区采集野生刺参21和24 个,对每个刺参DNA 进行PCR 扩增,测序获得的mtDNA 序列经MEGA 4.0 比对、剪切后,获得453~459 bp 的mtDNA D-loop 全序列。MEGA 4.0、DnaSP 5.0 软件分析各遗传多样性数据,结果见表2。从表2 可以看出,2012 和2018 年采集的刺参单倍型多样度均达到0.99 以上,处于较高水平。核苷酸多样度分别为0.039 和0.037,与中国、韩国和俄罗斯沿海8 个刺参群体的D-loop 序列分析结果比较,仅次于取自韩国浦项的黄参(0.044 1),高于青岛太平角(0.034 5)和烟台长岛(0.010 9)的刺参,且远高于8 个刺参总体(0.015 9)(王锦锦等, 2020),也分别高于与大连、朝鲜罗津、俄罗斯海参崴刺参的D-loop 序列分析结果(姬南京等, 2014),表明小石岛刺参遗传多样性较高,与2007 年该海域野生刺参的遗传多样性研究结果一致(陶翠花, 2009)。中性检验结果Tajima'sD值2012 年为-1.31,2018 年为-1.65,均为负值,表明群体偏离了中性模式,可能受到群体扩张和自然选择的作用,但统计学上差异不显著(P>0.05)。2 个群体间遗传分化系数Fst= -0.000 97<0.05,认为2012 年和2018 年刺参群体间遗传差异很小,不存在分化(Wright, 1931)。
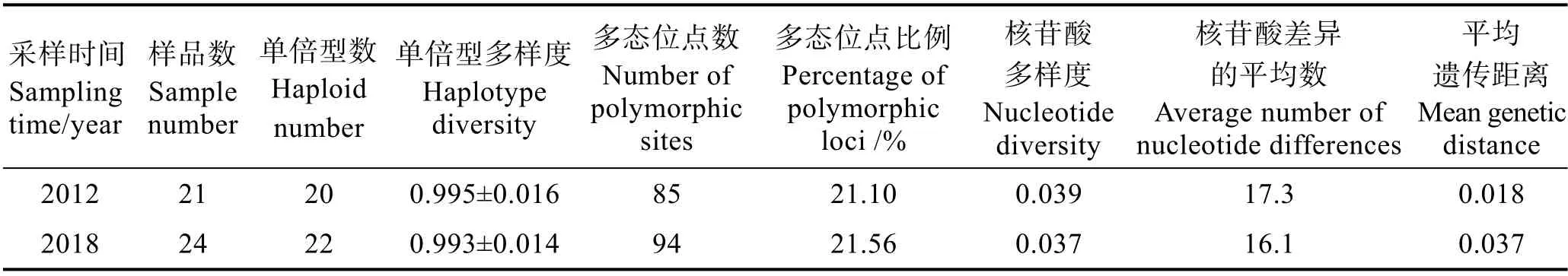
表2 刺参遗传多样性指数Tab.2 The genetic diversity indices of A. japonicus
2.5 保护生物资源概况
小石岛刺参国家级水产种质资源保护区出产的刺参具有个体大、出皮率高、品质优良等特点,是非常珍贵的种质资源。对当地海洋渔业主管部门及周边养殖企业、渔民的调查结果显示,保护区自然刺参资源量从2012 年约2 ind./m2逐渐增加至2018 年约3~5ind./m2,在秋季水温适合时,岸边刺参随处可见。该海域海胆资源较丰富,主要集中在保护区及邻近海区的威海影视城海域、小石岛海域、麻子港海域,包括光棘球海胆(Strongylocentrotus nudus)、马粪海胆(Hemicentrotus pulcherrimus)。保护区内同时有大量的皱 纹 盘 鲍(Haliotis discus hannai) 、 紫 石 房 蛤(Saxidomus purpuratus)等贝类资源,有些地方密度约为200 ind./m2。保护区还有丰富的藻类资源:鼠尾藻(Sargassum thunbergii)、大叶藻(Zostera marina)、海带(Thallus laminariae)、裙带菜(Undaria pinnatifida)、石花菜(Gelidium amansii)、条斑紫菜(Porphyra yezoensis)等,其中,鼠尾藻、大叶藻营养丰富,是刺参的优质天然饵料。
3 讨论
连续7 年的监测结果显示,小石岛刺参国家级水产种质资源保护区2012―2015 年水质一直保持良好;2016 年5 月和2017 年8 月水质下降,各有80%站位海水DIN 超标,个别站位DIN 达Ⅳ类海水水质标准,伴随着单一藻种大量繁殖和浮游植物生物多样性指数偏低;2018 年恢复至良好状态。调查发现,2016 年5 月和2017 年8 月监测采样前威海地区均经历降雨,推断由于雨水携带周边陆源污染物入海,导致保护区营养盐浓度增高,恰逢气象条件适宜,一种微藻大量繁殖,使浮游植物多样性偏低。与其他涉海水产种质资源保护区相比,小石岛保护区海水水质通常良好,与海州湾大竹蛏种质资源保护区(夏斌等,2014; 尚聪聪等, 2021)和前三岛海域国家级水产种质资源保护区(王珍珍等, 2019)一致,明显优于靖海湾松江鲈鱼种质资源保护区(崔毅等, 2013; 滕瑶等,2018)。分析认为,主要是由于地理位置影响,小石岛和海州湾、前三岛保护区均远离人类生活区,所在海域开阔,海水交换快,自净能力强,通常水质清洁,即使偶发污染现象也会很快恢复;而靖海湾湾形封闭,湾内海水与外界交换慢,自净能力较差,且湾内有淡水河流注入,水质受人类生产生活影响较大,水质富营养化程度高。
小石岛保护区海洋生态环境总体较好,生物多样性丰富,保护区内有多种经济生物自然繁殖,主要保护对象刺参资源量逐年增加,2012 和2018 年的刺参遗传多样性丰富且无明显分化,显示该保护区的保护效果良好,基本达到了保护水产种质资源及生存环境的目的。究其原因,一方面,保护区位于威海市西部海域,周边无大型工业,受人类活动影响较小,自然生态环境条件优越,对保护对象的生长和繁殖十分有利;另一方面,保护区建立了国家级威海刺参原种场,威海西港水产有限公司派专职人员保护、管理浅海的刺参资源,解决了多数保护区没有专人管理和缺乏管理经费的问题,使刺参资源得到有效的保护。该保护区管理也存在一些问题:一是近几年周边海水养殖设施增加,可能影响保护区海洋生态环境,养殖生物的逃逸也可能对保护区内海洋生物资源和保护对象的遗传多样性产生影响,需要引起重视;二是以企业为主进行管理,虽然暂时解决了保护区管理人员和经费的问题,但从长远来看,如何平衡水产种质资源的保护和利用的关系,充分发挥保护区天然种质资源库的作用,促进渔业可持续发展的问题还值得深入探讨。
