牙鲆头肾巨噬细胞的分离培养与鉴定*
2021-08-25王宣刚孔祥福王欣桐李恒顺刘金相王志刚于海洋
王宣刚 孔祥福 王欣桐 李恒顺 刘金相,2 王志刚 于海洋①
(1. 中国海洋大学海洋生命学院 海洋生物遗传学与育种教育部重点实验室 山东 青岛 266003;2. 青岛海洋科学与技术试点国家实验室海洋渔业科学与食物产出过程功能实验室 山东 青岛 266237)
巨噬细胞是一类由血液中的单核细胞迁移到组织中发育而来、在生物体免疫反应中具有重要意义的白细胞,它不仅在清除、呈递抗原中发挥重要作用,还能通过释放大量免疫因子参与宿主防御和炎症反应(Fujiwaraet al, 2005; Johnston, 1988)。近年来,研究人员发现多种病原菌能诱导巨噬细胞发生依赖于caspase-1的程序性死亡——细胞焦亡,以自我裂解的方式释放入侵到细胞中的病原体,使其被免疫细胞或因子清除(Broz, 2015; Jorgensenet al, 2015)。头肾是鱼类所特有的、由网状内皮系统和淋巴组织构成的重要免疫器官(蓝军南等, 2020),在使用鞭毛蛋白、LPS、poly I:C 对头肾细胞进行刺激后,头肾中与炎症相关的细胞因子如IL-1β、IL-10和TNF-α等均出现显著上调 (Chettriet al, 2011)。头肾中含有包括单核巨噬细胞、淋巴细胞等在内的众多白细胞,且获得方便、后续操作简便,是分离巨噬细胞的理想材料。
牙鲆(Paralichthys olivaceus)是我国重要的海水增养殖鱼类,近年来,牙鲆高密度集约化的养殖方式加速了细菌、病毒等病原体的传播速度,使得病害频发,严重限制了牙鲆养殖业的发展。对牙鲆的免疫系统及免疫反应机制进行细致深入的研究,可以针对不同病原体研制出相应的有效对策,从而对疾病进行预防与控制,减少养殖中的经济损失。荧光定量PCR及转录组数据分析结果显示,牙鲆感染迟缓爱德华氏菌(Edwardsiella tarda)前后肾脏中CD40基因表达量显著上调(Liuet al, 2017),而CD40是广泛表达在巨噬细胞中的基因(Machet al, 1997),提示巨噬细胞在牙鲆抵抗迟缓爱德华氏菌中可能发挥一定作用。巨噬细胞作为牙鲆先天性免疫的重要组成成分,在免疫学中一直是研究的热点,但巨噬细胞不能繁殖(Boltonet al, 2004),常用原代巨噬细胞进行实验,因此,建立其分离鉴定技术对于研究牙鲆先天性免疫具有重要意义。
近年来,鱼类巨噬细胞分离技术已趋于成熟,各组织巨噬细胞的分离方法相继建立,分别从鱼类的头肾、脾脏、外周血、肠和腹腔中成功分离得到了巨噬细胞(Ganassinet al, 1998; Olivieret al, 1986; Sørensenet al, 1997; Shaet al, 2017; 陶会竹等, 2018)。从半滑舌鳎(Cynoglossus semilaevis)的外周血中通过密度梯度离心获得单核细胞并培养至巨噬细胞,并对细胞的吞噬能力和部分基因的表达量进行了检测(Shaet al,2017)。陶会竹等(2018)从草鱼(Ctenopharyngodon idellus)的肠中分离得到了巨噬细胞,电镜及吉姆萨染色显示其具备巨噬细胞形态结构特征,并具备吞噬功能。但总体而言,关于海水硬骨鱼类,特别是鲆鲽类的巨噬细胞分离和鉴定的报道还比较匮乏。本研究使用牙鲆头肾为材料,分离巨噬细胞,并摸索细胞培养条件,确定适于牙鲆巨噬细胞生长的培养基成分,并使用巨噬细胞特异性标记分子mpeg1基因对细胞类型进行鉴定(Ellettet al, 2011),旨在为开展牙鲆巨噬细胞相关研究提供材料。
1 材料与方法
1.1 实验材料
本实验所用1 龄牙鲆(体重为550~1100 g)购自山东青岛南山市场,购回后所有牙鲆均养殖于18℃~20℃的海水中,每天饲喂商业饲料至实验使用。
牙鲆鳃细胞系(FG9307)和卵巢细胞系从中国海洋大学细胞工程实验室获得;淋巴细胞为使用外周血淋巴细胞分离液(北京索莱宝科技有限公司)按照说明书步骤从牙鲆外周血中分离得到。
青-链霉素与L-15 培养基购自美国Gibco 公司;吉姆萨染液、TRIzol 购自北京索莱宝科技有限公司,反转录试剂盒购自宝生物工程(大连)有限公司;胶回收试剂盒购自北京康为世纪生物科技有限公司;PCR试剂、p-EASY 连接体系及DH5α 感受态细胞购自北京全式金生物技术有限公司;单核细胞分离试剂盒购自天津市灏洋生物制品科技有限责任公司。
1.2 牙鲆头肾巨噬细胞的分离与培养
实验前,将牙鲆用MS-222 麻醉,将其转移到实验台上,用酒精擦拭鱼身进行消毒,随后用高温灭菌的手术剪从牙鲆的泄殖孔将其腹腔剪开,小心取出头肾,并将其立即放入含有3%双抗的PBS 缓冲液中。在超净台中用含1%双抗的PBS 将头肾反复冲洗5 遍以上,洗去头肾表面的血污及可能沾染的细菌。洗净的头肾用眼科剪无菌操作剪成1 mm3的小块,为防止此过程造成的组织干燥而影响下一步细胞的分离,可在剪的过程中添加少许PBS 缓冲液浸润组织。将剪碎的组织块转移到70 μm 的细胞筛上,一边轻轻按压组织块,一边少量多次地添加PBS,直至所有组织块都从筛网漏下,得到头肾的单细胞悬液。将单细胞悬液转移至15 mL 离心管中,20℃ 500g离心10 min,弃上清液。采用单核细胞分离试剂盒中附带的样本稀释液将离心后得到的细胞沉淀重悬,取一支干净的离心管,按3∶1 的比例分别加入试剂盒中的分离液1和分离液2,加样过程要避免破坏分层。在最上层加入重悬后的细胞悬液(与分离液1、2 体积之和的比为1∶2),随后在20℃ 500 g 条件下离心30 min。离心后吸取富含巨噬细胞的上层灰白色细胞层至新离心管,加入PBS 缓冲液轻轻吹打对细胞进行清洗,随后20℃ 200 g 离心10 min,弃上清液。使用PBS 重复对细胞清洗1 次。
分别使用DMEM/F12 (1∶1)、RPMI1640、L-15(Gibco)培养基和其他公司生产的L-15 培养基及1%、5%、10%浓度的胎牛血清配制成不同组分的培养基,各组均加入1%青-链霉素、1%非必需氨基酸、30%L929 细胞培养基,摸索适合牙鲆巨噬细胞生长的培养基及血清条件。得到的细胞沉淀用相应培养基重悬,将细胞密度调至5×106个/mL,使用台盼蓝统计细胞存活率。将调整密度后的细胞转移到6 孔细胞培养板中,24℃下培养4 h 后洗去未贴壁的细胞,即得到纯度较高的巨噬细胞。在光学显微镜及倒置显微镜下对细胞拍照,比较不同类型培养基及血清浓度对牙鲆巨噬细胞生长的影响。细胞在24℃不含CO2的培养箱中继续用生长培养基培养,直至取用。
1.3 牙鲆头肾巨噬细胞的吉姆萨染色
使用细胞刮小心刮取培养在6 孔板中的牙鲆巨噬细胞,用PBS 缓冲液清洗1 遍,200 g 离心10 min后弃上清液,加入PBS 缓冲液重悬,吸取部分细胞悬液制成血涂片,自然风干后滴加吉姆萨染液染色15 min,随后洗去染液,显微镜下观察染色结果。
1.4 细胞RNA 的提取和cDNA 的合成
使用TRIzol 对牙鲆巨噬细胞消化后按照说明书提取细胞中的RNA,使用gDNA Eraser 试剂盒对RNA反转录及合成cDNA。
1.5 牙鲆巨噬细胞中mpeg1 基因的扩增与鉴定
利用实验室已有的牙鲆基因组,通过本地blast获得牙鲆mpeg1基因序列,在IDT 网站(https://sg.idtdna.com/pages)在线设计该基因的特异性引物,扩增其ORF 区段,引物序列:mpeg1-Fw(5'-GTCATGAA GACAGCAGTG-3';mpeg1-Rv(5'-CTTGTGTCTGGGA CAAAC-3'),以上一步得到的cDNA 为模板,使用北京全式金生物的TransStart®FastPfu DNA Polymerase进行PCR 扩增,PCR 体系:5×TransStart®FastPfu buffer 5 μL,dNTP (10 mmol/L) 2 μL,模板1 μL,正、反向引物各0.5 μL,TransStart®FastPfu DNA polymerase 0.5 μL,ddH2O 15.5 μL,共25 μL。反应程序:95℃2 min;95℃ 20 s,52℃ 20 s,72℃ 45 s,40 个循环;72℃ 10 min,4℃保存。反应结束后,使用2%琼脂糖凝胶电泳对产物进行检测,切胶回收后与pEASY®-Blunt Simple 载体连接,转入DH5α 感受态细胞后培养,选取阳性克隆菌株送华大基因测序。
2 结果
2.1 牙鲆头肾巨噬细胞的分离与培养
将分离得到的牙鲆巨噬细胞经在6 孔细胞培养板中培养4 h,洗去未贴壁的细胞,显微镜镜检发现(图1),多数细胞呈贴壁状态,细胞多呈卵圆形、椭圆形等。台盼蓝染色显示细胞存活率为99.62%。培养7 d 后,大多数细胞仍保持贴壁状态,状态良好。

图1 倒置显微镜观察到的牙鲆头肾巨噬细胞Fig.1 Photomicrograph of macrophages derived from head kidney of Japanese flounder
2.2 牙鲆巨噬细胞培养条件的优化
为了确定适合体外培养牙鲆巨噬细胞的条件,使用不同培养基及不同浓度的血清对细胞进行培养,并统计了细胞在不同条件下培养的贴壁比率。在培养基选择上,比较了DMEM/F12 (1∶1)培养基、RPMI1640培养基、L-15(Gibco)培养基以及其他公司生产的L-15培养基;在血清浓度选择上,向相同的培养基中分别添加了1%、5%和10%的胎牛血清,以摸索合适的血清浓度。不同类型培养基及不同浓度血清培养的细胞均培养在24℃不含CO2的培养箱中。在使用不同条件培养细胞24 h 后,利用血球计数板统计每孔中贴壁细胞的数量,以探究不同条件对细胞贴壁程度的影响。胎牛血清浓度为5%时不同类型培养基对牙鲆巨噬细胞贴壁的影响见图2。为了使结果更为直观,定义贴壁最多组细胞的贴壁率为100%,用每组贴壁细胞的数量比贴壁最多组细胞的数量得到其余各组的贴壁率,通过折线图反映不同培养基及不同浓度血清对牙鲆巨噬细胞培养的影响(图3)。结果显示,L-15(Gibco)培养基比较适合用来培养牙鲆巨噬细胞,该条件下细胞贴壁数量较多。此外,与其他2 个浓度组相比,含5%血清的培养基中细胞生长状态最好,而含1%和10%血清的培养基中细胞贴壁数量较少。
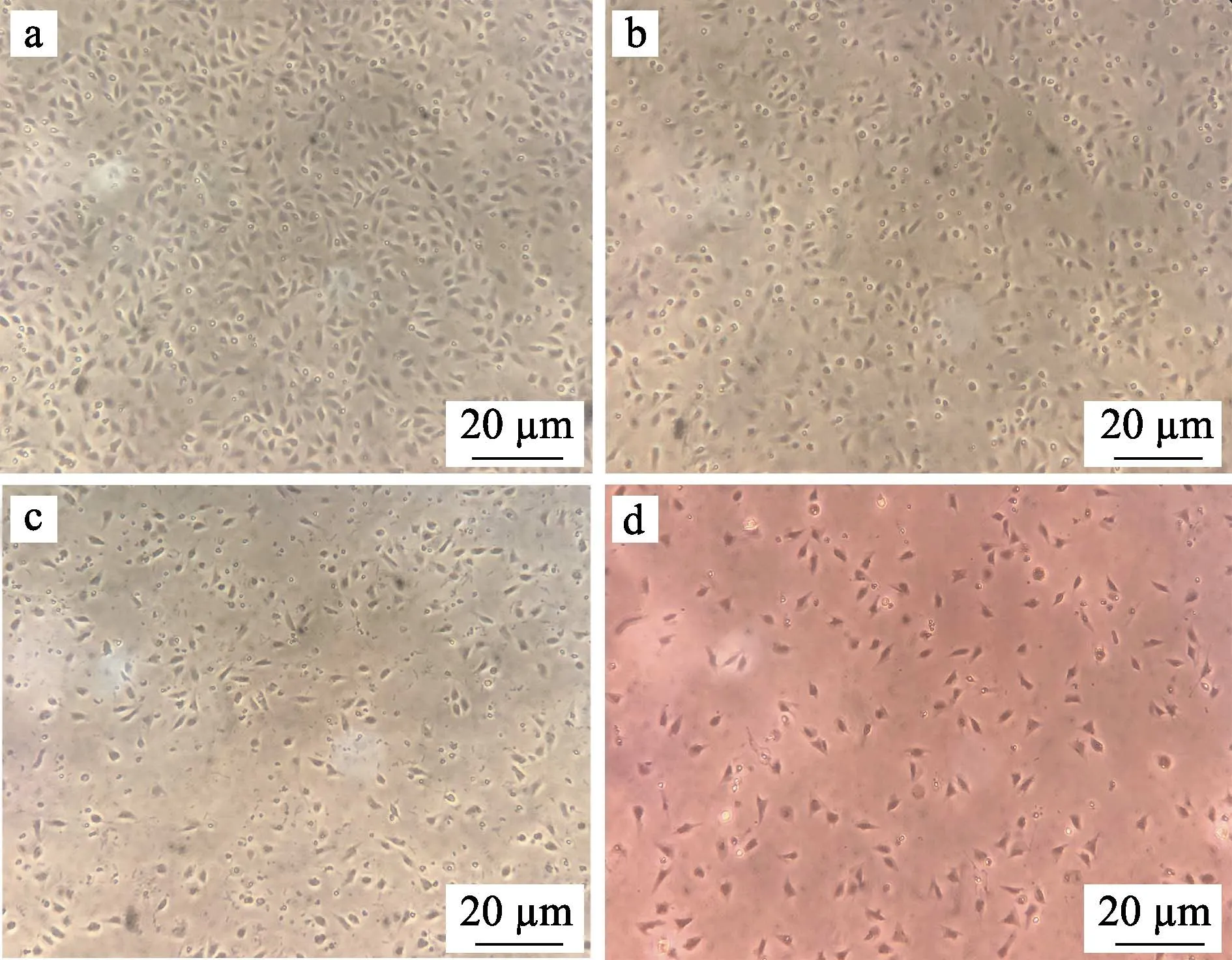
图2 使用不同类型培养基对牙鲆巨噬细胞培养的显微镜观察结果Fig.2 Photomicrograph of macrophages of Japanese flounder cultured with different types of medium
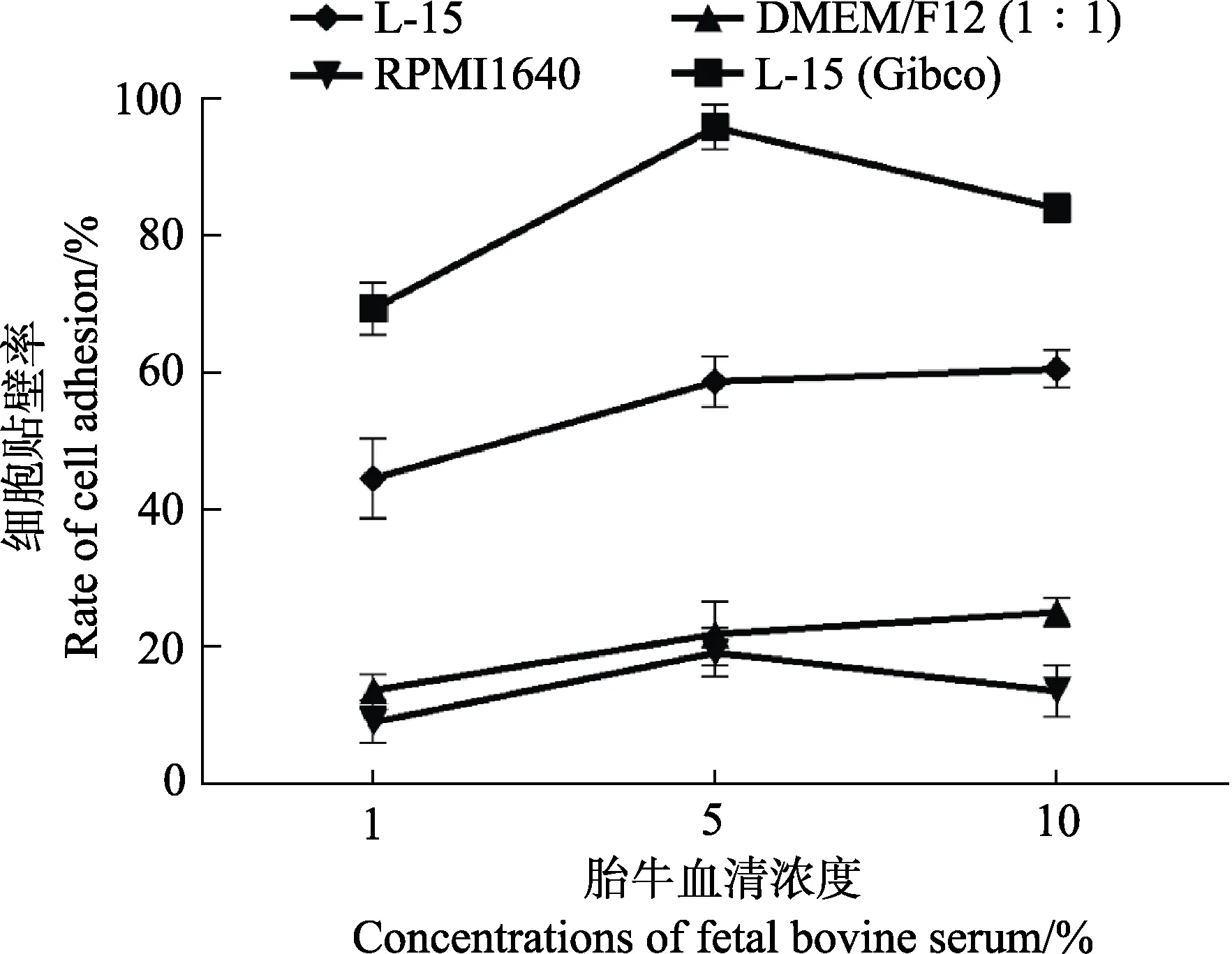
图3 使用不同类型培养基及不同浓度血清对牙鲆巨噬细胞培养24 h 后细胞的贴壁率Fig.3 Adhesion rate of macrophages of Japanese flounder cultured with different types of media and different concentrations of serum for 24 h
此外,贴壁效果较好的L-15 (Gibco)培养基培养细胞7 d 后的贴壁比率结果显示(图4),细胞状态较为平稳,直至培养7 d 时,贴壁率仍保持在80%以上。
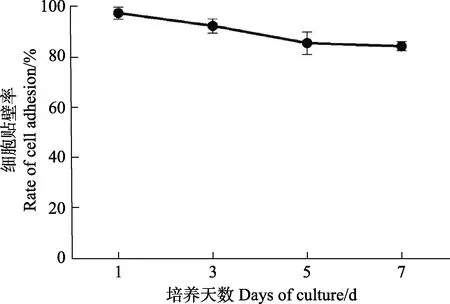
图4 使用L-15(Gibco)培养基培养的牙鲆巨噬细胞在不同时间点的贴壁率Fig.4 Adhesion rate of macrophages of Japanese flounder cultured with L-15(Gibco) media at different time points
2.3 牙鲆巨噬细胞的吉姆萨染色
如图5 所示,经吉姆萨染色后观察发现,分离得到的细胞体积较大,呈圆形或椭圆形,细胞核被染成紫红色,较大且偏向一侧,与报道中草鱼(陶会竹等,2018)、半滑舌鳎(Shaet al, 2017)巨噬细胞形态结构一致,符合巨噬细胞特征。
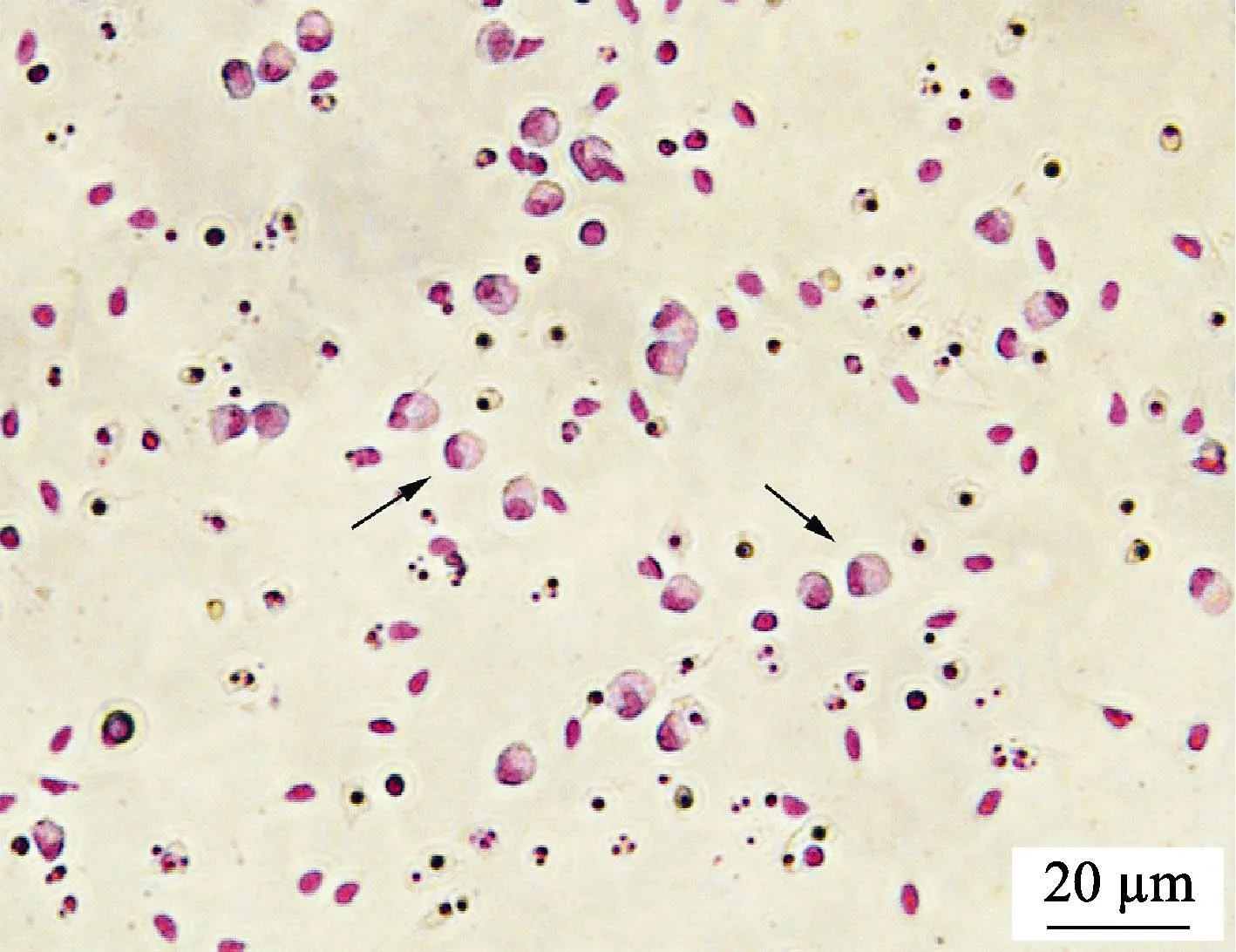
图5 牙鲆巨噬细胞的吉姆萨染色结果Fig.5 Macrophages of Japanese flounder stained by Giemsa
2.4 牙鲆巨噬细胞中mpeg1 基因的扩增
以牙鲆巨噬细胞cDNA 为模板,对mpeg1基因进行PCR 扩增,使用琼脂糖凝胶电泳检测扩增结果,并以牙鲆淋巴细胞、鳃细胞和卵巢细胞为阴性对照,使用各模板扩增了牙鲆的β-actin基因。如图6 所示,4 种模板均扩增出β-actin条带,而只有牙鲆巨噬细胞中扩增出与mpeg1的ORF 区段大小接近的条带,该条带的测序结果显示,此序列包含的ORF 序列与牙鲆mpeg1基因ORF 区相似度达99.86%,仅有3 个碱基发生突变,可认为分离得到的细胞中表达mpeg1基因。

图6 牙鲆巨噬细胞中mpeg1 基因的扩增结果Fig.6 Amplification of mpeg1 in macrophages of Japanese flounder
3 讨论
巨噬细胞在以先天性免疫为主的硬骨鱼中发挥重要作用,具有呈递抗原、杀灭和清除入侵病原体的功能,建立完备的巨噬细胞分离培养鉴定技术对于研究巨噬细胞的特性及其在免疫应答中的作用具有重要意义。头肾作为鱼类重要的免疫器官,富含巨噬细胞、淋巴细胞等多种免疫细胞,是分离巨噬细胞的良好材料。近年来,关于从硬骨鱼头肾中分离巨噬细胞的研究较多,Teles 等(2011)从虹鳟(Oncorhynchus mykiss)的头肾中获得了巨噬细胞,但单细胞悬液中红细胞的数量远高于巨噬细胞,不经离心分选便进行贴壁培养使获得的巨噬细胞数量较少,难以满足实验的需求;Li 等(2013)通过Percoll 法从大黄鱼(Larmichthys crocea)的头肾中分离到巨噬细胞,使用L-15 培养基培养,并利用差速贴壁法纯化细胞。此外,还有研究人员从红鲤(Cyprinus flammans) (Yanget al, 2015)、大西洋鳕鱼(Gadus morhua) (Sørensenet al, 1997)和鲤鱼(Cyprinus carpio) (Joerinket al, 2006)的头肾中分离出巨噬细胞。
本研究采用机械法获取了牙鲆头肾的单细胞悬液。常用的方法还有使用胰蛋白酶、胶原蛋白酶对组织进行解离的酶消化法,该方法对酶的浓度和消化时间要求较为严格,酶的浓度不够、消化时间过短容易造成组织无法消化成单个细胞,后续得到的细胞少,而酶浓度过高、消化时间过长则会对细胞造成伤害。对于不同物种的不同组织需要一系列的实验摸索才能确定合适的消化条件;而机械法是将剪碎的组织块轻轻按压,使其通过细胞滤网从而获得单细胞悬液,避免了因酶浓度不适宜而引起后续结果不理想的弊端,更为稳定简单。随后通过离心获得与巨噬细胞大小接近的细胞层,但这些细胞中仍含有少数淋巴细胞和红细胞。与哺乳动物不同,鱼类作为低等脊椎动物,成熟的红细胞中也含有细胞核,而红细胞裂解液是根据成熟红细胞无细胞核来对其进行裂解的,因此,无法使用红细胞裂解液来清除鱼类红细胞。根据Li 等(2013)的方法,利用巨噬细胞在短时间内贴壁而其他细胞不能贴壁的特性,在培养4 h 后,将未贴壁的细胞洗去,通过差速贴壁法分离,对得到的巨噬细胞进行一定程度的纯化。
本研究中,尝试使用不同方法培养细胞,并比较细胞生长状态以确定适于培养牙鲆巨噬细胞的培养基成分。统计结果显示,相较于其他类型的培养基,L-15(Gibco)培养基更适于牙鲆巨噬细胞的体外培养,主要表现为细胞贴壁率较高,且随着培养时间的延长,细胞状态保持良好。王秋华等(2011)在其他硬骨鱼中也使用L-15 培养基,考虑可能L-15 培养基中的成分更能满足硬骨鱼巨噬细胞生存的需求。关于罗非鱼(Oreochroms mossambcus)巨噬细胞培养的研究显示,使用10%胎牛血清培养的细胞仅少数贴壁,5%胎牛血清和5%鱼血清组的细胞部分贴壁,10%鱼血清组的细胞大部分贴壁,表明不同血清对罗非鱼巨噬细胞的体外培养有较大影响,鱼血清更有利于其巨噬细胞的体外培养(王秋华等, 2011)。本研究结果显示,仅添加胎牛血清便足以维持牙鲆巨噬细胞的体外正常生长,且5%浓度的血清比1%和10%浓度更适于细胞培养。Hume 等(2012)研究表明,巨噬细胞集落因子CSF-1 对促进单核细胞增殖分化及维持巨噬细胞存活具有重要作用,而小鼠成纤维细胞L929 在生长的过程中可向培养基中分泌巨噬细胞集落因子。因此,本研究添加L929 细胞的培养基来培养巨噬细胞以维持其正常状态。
此外,本研究从细胞形态及巨噬细胞特异性标记两方面对牙鲆巨噬细胞进行鉴定。吉姆萨染色显示,与半滑舌鳎及草鱼的巨噬细胞类似(Shaet al, 2017;陶会竹等, 2018),本研究分离得到的细胞呈圆形或椭圆形,细胞核染色较深,呈卵圆形或肾形,偏向细胞一侧,符合巨噬细胞形态特征;对于基因标记,常使用流式细胞仪来识别哺乳动物的特异性标记,从而鉴定细胞类型,但在硬骨鱼中较难实现。本研究选取mpeg1基因这一巨噬细胞特异性分子标记对细胞类型进行鉴定,在牙鲆巨噬细胞中成功扩增出该基因,且在阴性对照组中无法扩增,进一步证明本研究分离得到的细胞为巨噬细胞(Ellettet al, 2011)。
本研究建立了一种分离鉴定牙鲆巨噬细胞的方法,筛选得到了适合培养牙鲆巨噬细胞的条件,为下一步体外研究牙鲆免疫反应提供了良好的实验材料,为后续开展牙鲆免疫应答相关实验奠定了基础。
