嗜铬细胞瘤和副神经节瘤二次手术策略
2021-08-24秦艳春王国良张树栋侯小飞马潞林
刘 磊,秦艳春,王国良,张树栋,侯小飞,马潞林
(北京大学第三医院泌尿外科, 北京 100191)
嗜铬细胞瘤和副神经节瘤是一种比较少见的神经内分泌肿瘤,年发病率3~8/100万[1]。高儿茶酚胺的分泌和释放可对多个系统产生影响,如心脑血管事件风险明显增加,胃肠蠕动减慢、便秘、肠梗阻等消化系统症状,糖尿病或糖代谢异常,这些会严重损害患者健康,降低其预期寿命[2]。2%~13% 嗜铬细胞瘤和2.4%~50.0% 副神经节瘤会出现转移[3], 2017年, 世界卫生组织(World Health Organization, WHO)指出所有的嗜铬细胞瘤和副神经节瘤都是潜在的恶性肿瘤,但病理并不能准确预测哪些是转移性的肿瘤[4]。转移瘤的五年生存率差异很大,为12%~84%[3]。手术是唯一可以治愈嗜铬细胞瘤和副神经节瘤的方法,但由于此肿瘤血供丰富,手术操作可导致儿茶酚胺释放产生高血压危象,故手术风险高,对外科医生是一个很大的挑战[5],疑难的嗜铬细胞瘤和副神经节瘤经常会面临手术不成功的风险。此外,嗜铬细胞瘤和副神经节瘤的复发率6.5%~17.0%[6]。初次手术不成功或肿瘤复发都会使一些患者不得不面对二次手术,显然二次手术风险要远高于初次手术。目前关于嗜铬细胞瘤和副神经节瘤二次手术处理的策略,国内外报道并不多。本研究将回顾性分析北京大学第三医院泌尿外科近年来处理此类病例的结果,探讨嗜铬细胞瘤和副神经节瘤二次手术的策略,分享相应的经验和教训。
1 资料与方法
1.1 病例资料
2016年8月至2021年2月,北京大学第三医院泌尿外科共收治7例嗜铬细胞瘤和副神经节瘤二次手术病例,其中男性 4 例,女性 3 例,平均(44.1±11.5)岁(28~60岁), 右侧6例,左侧1例。二次手术的原因包括:(1)肿瘤切除复发病例2例(病例1、5);(2)肿瘤体积大并与血管关系密切,首次手术未能成功切除肿瘤病例3例(病例2~4),其中病例3、4首次手术都是先经后腹腔镜又中转经腹开放手术仍未完整切除;(3)术前未诊断出嗜铬细胞瘤和副神经节瘤而没有药物准备,首次手术中出现血压剧烈波动而中止手术病例2例(病例6、7)。所有病例都进行了CT或MR的影像学评估(图1), 同时完善了血儿茶酚胺检查。所有病例二次手术前都应用肾上腺素能α受体阻滞剂做了充分的药物准备,6例病例服用酚苄明20~80 mg 6周至6个月,病例1因不耐受酚苄明而每日服用坦索罗辛0.4 mg 6周,7例病例术前血压都位于正常范围。围手术期护理对二次手术也非常重要,入院后需密切监测血压,手术前禁食1 d,口服洗肠液做好肠道准备,以备因肠道粘连术中破损能及时修补,术前留置胃管。应用美国麻醉医师学会(American Society of Anesthesiologists, ASA)评分评估麻醉风险,手术采用了经腹开放、机器人辅助腹腔镜以及后腹腔镜三种方式,病例1~4采用了经腹开放手术,病例5采用了机器人辅助腹腔镜手术,病例6、7采用后腹腔镜手术。病例采用电话和门诊随访。
1.2 手术方法
1.2.1经腹开放手术 4 例病例皆为右侧肿瘤,选择 Chevron(上腹人字形)切口,使用Thompson自动拉钩充分牵拉暴露术野,如需游离肝脏,则将切口尖部向上延伸至剑突。二次手术最易粘连的部位是大网膜,注意胆囊的位置可能会有所变化,小心分离粘连带,找到并保护肝十二指肠韧带,使用Kocher手法将十二指肠及胰头向左侧游离,如果肿瘤在下腔静脉及双侧肾静脉后方,则需要游离出下腔静脉、左肾静脉、右肾静脉。在血管未遮挡的地方尽量分离出肿瘤的边缘,再使用橡皮筋牵拉血管。在下腔静脉远心端合适的位置套上血管阻断带以备分离过程中一旦出血能够及时阻断远端下腔静脉血液回流,有利于暴露和缝合修补血管破损。本组病例在开放手术中应用了翻肝技术和下腔静脉切断再吻合术两个创新技术。翻肝技术:病例1肿瘤主体在肝后下腔静脉后方,在肝下游离出下腔静脉后仅能暴露肿瘤下极的一部分,于是采用了处理Mayo Ⅲ级瘤栓时的翻肝技术。切断右侧肝肾韧带,打开肝右侧三角韧带、冠状韧带及镰状韧带。分离膈肌与肝脏之间的间隙,暴露肝脏背侧裸区,充分游离后可以将肝向左侧翻转,暴露下腔静脉背侧的肿瘤,再将肿瘤完整切除。下腔静脉切断再吻合术:病例3肿瘤体积大,位于下腔静脉后方,右肾静脉、左肾静脉与下腔静脉形成了一个“十”字压迫肿瘤。充分游离出下腔静脉及双肾静脉,先切断双肾静脉上方的下腔静脉,将两侧静脉断端使用血管阻断钳夹闭。将肿瘤完整切除后,再使用4-0血管线将下腔静脉重新进行端端吻合。因为下腔静脉之前受到肿瘤的挤压会有所延长,故肿瘤切除术后,下腔静脉吻合口并不会有明显的张力。病例3下腔静脉阻断时间为32 min。
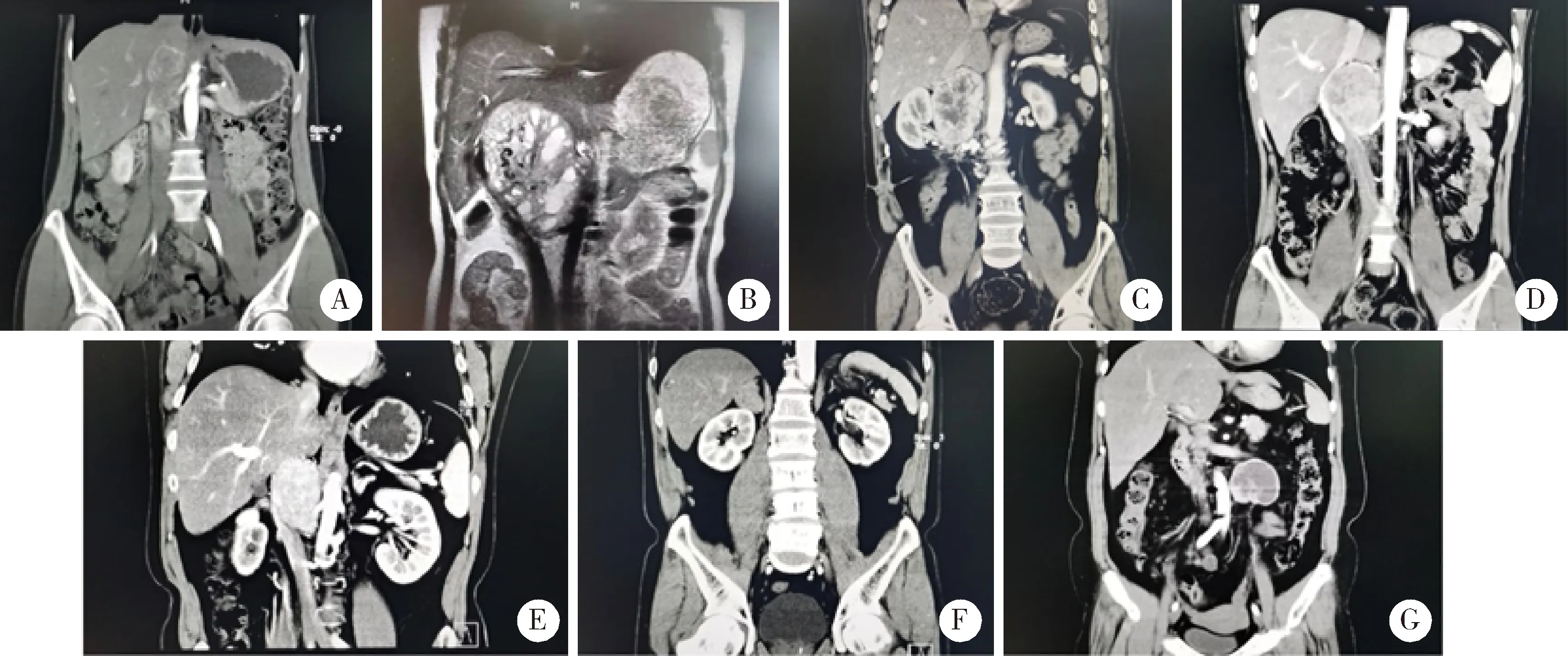
A-G, cases 1-7.图1 嗜铬细胞瘤和副神经节瘤病例二次手术前影像学表现Figure 1 Preoperative imaging of cases who underwent reoperation of pheochromocytoma and paraganglioma
1.2.2机器人辅助腹腔镜手术 采用经腹左侧卧位,腰部垫高,向背侧倾斜30度。在十一肋水平腹直肌旁穿刺置入8 mm Trocar,置入腹腔镜,监视器下分别于左侧腹直肌旁肋缘下、髂棘内侧穿刺置入两个8 mm Trocar,另在腹正中线脐上及脐上8 cm放入两枚12 mm的普通腹腔镜 Trocar,为助手提供术中普通腹腔镜器械的操作通道。与开放手术相比,由于体位采用侧仰位,机器人辅助腹腔镜的一个优点是手术野更不易受到横结肠和小肠的影响,打开结肠肝曲后很容易暴露十二指肠和其后方的下腔静脉。机器人辅助腹腔镜的操作步骤与开放手术基本类似,机器人腹腔镜下我们应用左肾静脉切断术,病例5肿瘤左侧受左肾静脉遮挡,肿瘤游离困难,在分离过程中左肾静脉汇入下腔静脉处出血,术中便直接切断左肾静脉,因左肾静脉内血液可以经生殖腺静脉、肾上腺静脉、腰静脉回流,此病例肾功能并未受到明显影响。
1.2.3后腹腔镜手术 后腹腔镜二次手术技术仍采用标准的后腹腔途径,右侧肿瘤难度略大,需先完全游离右肾及肾蒂,腹侧游离出下腔静脉。游离血液供应较丰富的肿瘤下极,用血管夹及双极电凝充分阻断肿瘤下极的血管,肿瘤内侧需沿着与下腔静脉的间隙自下而上仔细游离。对于左侧肿瘤,术中需要充分游离左肾暴露术野。另外,病例7左侧的副神经节瘤前方为肠系膜下静脉,后方为输尿管,术中需仔细辨识,避免损伤。
1.3 统计学分析
采用SPSS 19.0统计学软件,符合正态分布的数据使用均数±标准差表示,不符合正态分布的数据采用中位数(四分位数间距)表示。
2 结果
7例病例具体结果见表1。患者平均体重指数(25.9±3.9) kg/m2(20.9~32.8 kg/m2),肿瘤平均大小(8.0±3.2) cm (3.6~13.9 cm)。4例采用开放手术,1例采用机器人辅助腹腔镜手术,2例采用后腹腔镜手术。二次手术距第一次手术的中位时间间隔为9个月(四分位数间距:6,19个月)。术前麻醉ASA分级2级6例,3级1例。中位手术时间 407 min(四分位数间距:114,430 min), 中位出血量1 500 mL(四分位数间距:20,3 800 mL)。手术成功5例,1例术中仅做肿瘤探查,放弃了肿瘤切除,1例围手术期死亡。术中输血5例,中位输注悬浮红细胞800 mL(四分位数间距:0,2 000 mL),术后淋巴漏1例,保守治疗自愈。下腔静脉切除再吻合及切断左肾静脉病例,术后肾功能正常。术前平均血红蛋白(133.3±21.5)g/L(87.0~154 g/L),平均白蛋白(45.9±2.5)g/L(42.2~48.8 g/L),平均总蛋白(72.5±4.6)g/L(65.6~77.7 g/L)。术后血红蛋白(119.0±9.0)g/L(103~128 g/L), 术后平均住院天数(7.2±3.3) d (4~13 d)。存活6例病例中位随访时间33.5个月(四分位数间距:4.8,48个月),病例3带瘤生存,长期服用降压药,其他病例尚未见复发。

表1 病例的临床资料及围手术期数据Table 1 Clinical data of patients and operations
3 讨论
对于复发的或初次手术未能成功切除的嗜铬细胞瘤和副神经节瘤,再次手术是唯一可以治愈的方法[7]。影像学评估及充分肾上腺能α受体阻滞剂的药物准备对二次手术的成功实施非常重要。增强CT对嗜铬细胞瘤和副神经节瘤的空间分辨率最高,定位的敏感度可达88%~100%,是首选的影像学评估方式[8]。肿瘤的大小、部位、与静脉的关系、与肝的关系是评估手术难度的关键因素。具体来讲,肿瘤越大,手术风险越大,因为下腔静脉和肝脏的遮挡会严重影响肿瘤的暴露,右侧肿瘤手术要难于左侧,尤其是肿瘤主体位于下腔静脉后方以及肝后方的右侧肿瘤。右侧肿瘤更易复发[6],这与右侧手术困难包膜更易破损或肿瘤残留有关[9]。右侧较大的嗜铬细胞瘤容易向下腔静脉的后方和内侧生长延伸,故在术前的影像学评估中需要着重关注下腔静脉的走行,如本组病例2~5,如出现下腔静脉被右侧肿瘤挤向外侧,说明肿瘤是向下腔静脉的后方和向左侧延伸,尤其是肿瘤下极延伸至左肾静脉及右肾静脉的后方,会明显增加手术暴露的难度。二次手术前嗜铬细胞瘤和副神经节瘤一定要做好充分的药物准备[10],使用非选择性的酚苄明效果最好。本组病例1使用坦索罗辛进行准备,术中出现了严重的血压、心率剧烈波动,最高达240/150 mmHg,最低至60/40 mmHg,心率最快达160次/min,提示坦索罗辛并不适合做药物准备,而病例6初次手术因血压波动而中止,酚苄明准备半年后二次手术中血压十分平稳。
二次手术与初次手术最主要的不同在于解剖层次之间的粘连重,我们的经验是:(1)游离粘连的层次可更多地使用锐性分离,因为钝性分离更易使组织撕裂;(2)先游离相对容易分离层次,再沿着已分开的层次去游离粘连的不易分开的层次;(3)游离与肿瘤关系密切的下腔静脉、肾静脉等大血管时,使用橡皮筋牵拉血管,有助于血管和肿瘤层次之间的分离,也会使被肿瘤挤压后变宽变扁的静脉牵拉变窄;(4)下腔静脉在右侧肿瘤切除时可在远端留置血管阻断带,当上方的下腔静脉出血时,可迅速阻断下腔静脉远端血液的回流,为止血创造良好的条件。因为手术难度大,术前需要制定详细的手术计划,进行充分的药物准备,术中由丰富经验的手术团队和麻醉团队配合完成。本组病例共采用了经腹开放手术、机器人辅助腹腔镜手术、后腹腔镜手术三种手术方式,手术入路和方式选择的依据是,对于首次进行了开放手术而肿瘤未能成功切除或复发的病例(病例1~4)首选经腹开放手术,特别是体积较大的肿瘤,因为这一入路对手术野暴露的最充分。本组病例3、4在初次手术中还实施了经腹和经后腹腔两种入路的游离,这种情况下经腹开放手术更有优势,此入路术中可以随时根据需要扩大切口来增大暴露范围,缺点是切口大,术后恢复较慢。第二种入路和方法的选择方式是经腹机器人辅助腹腔镜手术,这一方法我们仅在病例5中使用,此病例肿瘤体积大小中等,机器人辅助腹腔镜具有灵活操作的机械臂和放大的视野,而且深部分离和缝合也更灵活,侧仰位使结肠和小肠对术野的影响小,与近期文献一致[11],机器人辅助腹腔镜手术获得了不错的结果。第三种常规的后腹腔镜入路可应用于误诊而初次手术中止的病例,本组病例6、7肿瘤偏小,初次手术由于游离少,二次手术后腹腔镜途径影响并不大。前面提到,右侧体积较大的嗜铬细胞瘤,如果受到了下腔静脉或肝脏遮挡,会使肿瘤完整暴露和切除都十分困难,可以考虑下面这些技术来摆脱手术中的困境。(1)翻肝技术:结合相关文献以及北京大学第三医院泌尿外科的经验积累[12],病例1肿瘤采用了此技术,适合肿瘤主体位于肝后下腔静脉后方的肿瘤。(2)下腔静脉切断再吻合技术:病例4应用了此项技术,此技术的应用源于总结病例2、3二次手术未成功的教训。这两例病例都是肿瘤体积大,位于下腔静脉后方,腹侧受到下腔静脉与右肾静脉、左肾静脉严重压迫。病例2手术中遇到了重大困难,下腔静脉对肿瘤的压迫重且有粘连,在分离的过程中有多处下腔静脉背侧破损,出血多,肿瘤未切除时,下腔静脉背侧破损不易缝合,遂术中使用多个阻断钳夹闭,但在肿瘤即将切下来时,患者出现心力衰竭和心脏骤停,而此时下腔静脉破损尚未缝合,但又必须进行心外按压,最终因为心功能衰竭及失血性休克而死亡。病例3与病例2类似,下腔静脉游离困难,遂放弃了肿瘤的切除。病例4出现同样情况后,我们设计了先切断下腔静脉切除肿瘤后再重新吻合的方法,获得了良好的手术效果。(3)左肾静脉切断术:病例5在机器人辅助腹腔镜手术中应用了此项技术,适合左肾静脉压迫肿瘤明显的病例,因左肾静脉阻断后回流血液也可以通过左侧肾上腺静脉、生殖腺静脉、腰静脉回流的代偿,对左肾功能的影响有限,故可将其切断,病例5术后肾功能正常,复查增强CT左肾显影良好。
从本组病例结果中我们可以看到,因复发或首次未成功切除的病例(病例1~5),二次手术的出血量大,手术风险极高,其中病例2术中死亡,病例3未能成功切除肿瘤,这些风险我们术前一定要充分沟通和告知,后面应用改进技术的病例获得了较好的手术效果。病例6、7的出血量和手术时间并不多,显示因未行药物准备而中断手术的病例进行二次手术并不复杂,药物准备充分后即可常规手术。
本文为回顾性研究,存在样本量小、随访时间短,缺乏准确的统计学比较数据等不足之处,需继续积累病例,以期得到更多、更科学的数据和经验。
