黄瓜果顶形状遗传与QTL定位
2021-08-23李毅宋晓飞李晓丽孙成振张美迪闫立英
李毅 宋晓飞 李晓丽 孙成振 张美迪 闫立英


摘 要:对黄瓜果顶形状进行QTL分析和候选基因预测,可为黄瓜新品种选育提供理论基础。以果顶平头形自交系玉女和果顶瘦尖形自交系R7构建的F2代分离群体为材料,对黄瓜果顶形状遗传及其QTL进行分析。结果表明,黄瓜果顶瘦尖形为不完全显性遗传的数量性状。基于QTL-Seq发现6个与黄瓜果顶形状有关的QTL,分别位于1号、2号、3号、4号、5号和6号染色体上,共包含108个SNP和InDel位点,含有12个变异基因。其中只有6号染色体上的CsaV3_6G005930.1基因在外显子上发生SNP替换(C-A)形成终止密码子,导致翻译提前终止,预测 CsaV3_6G005930.1是与果顶形状相关的候选基因,该基因编码一个未知蛋白。
关键词:黄瓜;果顶形状;QTL定位
中图分类号:S642.2 文献标志码:A 文章编号:1673-2871(2021)07-007-07
Inheritance and QTL mapping of fruit apex shape in cucumber
LI Yi, SONG Xiaofei, LI Xiaoli, SUN Chengzhen, ZHANG Meidi, YAN Liying
(College of Horticulture Science and Technology, Hebei Normal University of Science and Technology, Qinhuangdao 066600, Hebei, China)
Abstract: QTL analysis and candidate genes prediction of the fruit apex shape can provide a theoretical foundation for the breeding of new cucumber varieties.In this study, the genetic and QTL of fruit apex shape were analyzed by using F2 population which was constructed with an inbred line of flat fruit apex Yunü (P1) and an inbred line of sharp fruit apex R7 (P2) as parents.Genetic analysis showed that the fruit sharp apex of cucumber was a quantitative character with incomplete dominant inheritance. Six QTLs related to fruitapex shape of cucumber were located on chromosome 1, chromosome 2, chromosome 3, chromosome 4, chromosome 5 and chromosome 6 by QTL-Seq, respectively. A total of 108 SNP and InDel locus which related to the fruit apex shape were located,contained 12 mutation genes.Only the CsaV3_6G005930.1 gene on chromosome 6 happened a SNP replacement (C-A) to form the termination codon, and resulted in premature termination of translation. Therefore, CsaV3_6G005930.1 is a strong candidate gene for fruit apex shape, which encodes an unknown protein.
Key words: Cucumber; Fruit apex shape; QTL mapping
黃瓜是全球重要的经济作物,其果实大小和形状具有丰富的多样性[1]。不同黄瓜品种之间果实形状差异很大,如长棒形、短棒形、卵圆形、球形和指形黄瓜等。果实形状直接影响黄瓜的外观品质和商品价值,因此,培育符合消费者需求的果形品种已成为黄瓜新品种选育的重要方向之一[2]。果顶是黄瓜果实的重要组成部分,果顶形状的改变直接影响果实的形状。因此,定位果顶形状相关QTL可为黄瓜果形遗传改良提供理论依据。
辣椒、茄子和番茄作物的果顶形状均为数量性状且由多个QTL调控。Chaim等[3]通过QTL分析鉴定到55个与辣椒形状相关的QTL,其中有3个QTL与辣椒果顶形状有关。张佳琦[4]利用小椒和大椒杂交构建F2分离群体,利用SPAR和SSR分子标记对其进行QTL分析,定位到6个与辣椒果顶形状相关的QTL。耿树文[5]以圆顶茄子自交系283为母本、尖顶茄子自交系284为父本进行杂交,构建6世代遗传群体,通过QTL定位鉴定到3个与茄子果顶形状相关的QTL(fe5.1、fe10.1、fe10.2),fe5.1位于茄子5 号连锁群Marker1322249 和 Marker2732214之间、fe10.1位于10号连锁群Marker897334 和 Marker894480之间、fe10.2位于10号连锁群Marker4365090 和 Marker2070220 之间。Brewer等[6]对番茄进行形态学鉴定时,发现4个与番茄果顶形状相关的QTL (dan7.1,dan7.2,dan8.1,dan12.1)。前人在对黄瓜果实性状研究时主要集中于果实形状,对果顶形状研究相对较少。高智慧[7]以长棒形黄瓜自交系CNS21和近圆形黄瓜自交系RNS7为亲本,对调控果形相关的QTL进行定位,共定位到58个与果实大小和形状相关的QTL;同时,结合QTL定位和基因组重测序,预测了5个可能与黄瓜果形相关的候选基因。简兴等[8]以长棒形黄瓜二早子和短棒形黄瓜NC-76为亲本,应用主基因+多基因混合遗传模型分析了黄瓜果形的遗传特性,结果表明果形是多基因控制的数量性状,果形指数的遗传符合加性-显性-上位性多基因(C-0)模型,并且果形遗传受环境影响较大。潘玉朋[9]以特异性地方自交系WI7239和半野生的版纳黄瓜自交系WI7167为材料,通过QTL定位等方法揭示了黄瓜圆形果形态建成的遗传调控机制,结果表明,果实大小/形状的遗传变异由2个互作QTL位点FS1.2和FS2.1调控。苗晗等[10]以华北保护地黄瓜9930和欧洲温室黄瓜9110Gt为亲本构建遗传图谱,结合不同年份、不同季节表型鉴定数据,对12个黄瓜果实相关性状进行QTL模型(MQM)分析,共检测到32个与黄瓜果实性状相关的QTL。朱拼玉等[11]将黄瓜果顶形状分为钝圆形、卵圆形和瘦尖形,钝圆形果形指数为1.4~2.2,卵圆形果形指数为1.8~2.5,瘦尖形果形指数为2.4~3.4,对不同黄瓜果顶形状进行遗传规律分析和QTL定位,结果表明钝圆形和卵圆形果顶遗传均为不完全隐形遗传,符合A-0模型,受一对主基因控制,bft6.1是控制钝圆形果顶的主效QTL位点,oft4.1是控制卵圆形果顶的主效QTL位点。目前对黄瓜果顶形状的遗传基础研究较少,调控果顶形状的基因尚不明确。
笔者在本研究中以果顶平头形黄瓜自交系玉女为母本(P1),以果顶瘦尖形黄瓜自交系R7为父本(P2),构建F1代和F2代分离群体,采用QTL-Seq方法定位与果顶形状相关的基因,为克隆黄瓜果顶形状相关基因和优良品种选育奠定基础。
1 材料和方法
1.1 材料
以来自山东寿光蔬菜种业集团有限公司自主研发的欧洲温室型品种玉女和河北科技师范学院引进并纯化的日本类型优良自交系R7為试验材料。其中玉女果顶为平头形,R7果顶为瘦尖形,杂交获得F1和F1反,F1自交获得F2代分离群体种子。2018年8月播种各世代种子,采用穴盘育苗,2叶1心时定植,双高垄地膜覆盖栽培,大行距80 cm,小行距50 cm,株距25 cm,P1、P2分别定植25株,F1定植12株,F1反定植17株,F2定植125株,所有材料均定植于河北科技师范学院施各庄基地塑料大棚,田间常规管理。
1.2 黄瓜果顶形状调查与统计
2018年9月,在结果盛期对各世代的正常商品瓜进行表型鉴定,每株选取10个正常商品瓜,根据《黄瓜种质资源描述规范和数据标准》[12]对选取的黄瓜商品瓜的果顶形状进行观察、定性及划分鉴定,用Excel 2016对结果进行统计。
1.3 方法
采用QTL-Seq技术[13]对黄瓜果顶形状进行QTL定位。在F2代分离群体中选择果顶平头形和瘦尖形性状的植株各20株,采用CTAB[14]法提取健康幼嫩生长点处叶片的DNA,琼脂糖凝胶电泳分析DNA的纯度和完整性,Nanodrop检测DNA的纯度(OD260/OD 280比值),Qubit对DNA浓度进行精确定量。相同表型植株的DNA质量检测合格后进行等浓度混合,构建果顶平头形混池(gdp)和果顶瘦尖形混池(gdj)。将父、母本分别构建父本池(P2)和母本池(P1)。由天津诺禾致源有限公司采用QTL-Seq方法进行QTL定位。通过illuminaHiSeqTMPE150测序平台对F2代2个极端表型混池和2个亲本池进行测序,获得原始数据。对原始数据进行过滤获得高质量的clean reads。通过BWA[15]软件中mem算法将clean reads与黄瓜参考基因组(Cucumber (Chinese Long) v3)比对,比对结果经SAMTOOLS去除重复。通过ANNOVER[16]软件对候选区间SNP和InDel进行功能注释。参考黄瓜基因组数据库(http://cucurbitgenomics.org/)和拟南芥基因组数据库(https://www.arabidopsis.org/)对候选区间内的基因进行功能分析,预测候选基因。
2 结果与分析
2.1 黄瓜果顶形状的遗传分析
对2018年秋季的亲本、F1、F1反和F2代分离群体的果顶形状进行鉴定。结果表明,以果顶平头形黄瓜自交系玉女(P1)与果顶瘦尖形黄瓜自交系R7(P2)杂交所得的F1,无论正交还是反交,后代均表现为中间性状钝圆形,F2代分离群体则表现为平头、钝圆与瘦尖3种表型,比例为25.6%∶43.2%∶31.2%,接近1∶2∶1,且表型易受到环境影响。遗传分析结果表明,黄瓜果顶瘦尖形为不完全显性遗传的数量性状(表1)。
2.2 测序数据质量分析
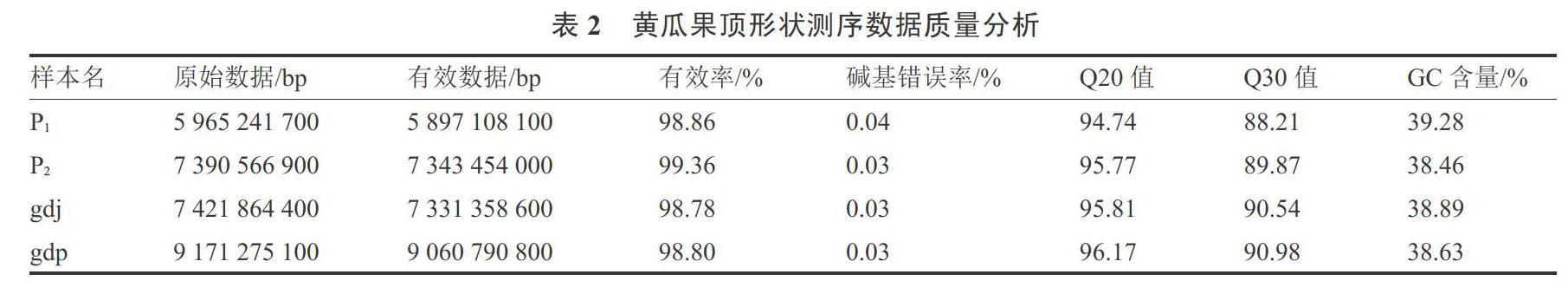
对亲本及2个果顶极端表型混池进行高通量测序并获得29.949 G原始数据,原始数据中含有接头或低质量的reads。为了保证后续信息分析的准确性,需要对原始数据进行过滤,过滤标准如下:1)过滤点带接头的reads;2)过滤掉单端测序reads中N的含量超过reads长度10%的reads;3)过滤掉单端测序reads中低质量碱基超过reads长度比例50%的reads。最终得到29.633 G clean reads。对测序结果进行质量分布检查,测序错误率用e表示,Illumina HiSeqTM/MiseqTM的碱基质量值用Qphred表示,Qphred=-10log10(e)。利用测序结果的Qphred数值,进行碱基错误率计算,结果为Q20≥94.74%、Q30≥88.21%,测序质量高,GC含量38.46%~39.28%(表2)。
所有样本的reads与黄瓜参考基因组的比对数在94.33%~96.25%之间,平均测序深度在20.47X~26.22X,1X的覆盖比率在98.31%以上,4X的覆盖比率在95.93%以上(表3)。比对结果良好,可以用于后续的变异分析。
2.3 黄瓜果顶形状QTL定位
基于基因分型的结果,筛选两个亲本间纯合差异的标记,共筛选出286 947个多态性标记。以亲本P1作为参考亲本,分析计算2个子代的SNP-index与InDel-index(即SNP与InDel-index的频率),以1 Mb为窗口,1 kb为步长,对gdj和gdp中SNP(图1-A、B)和InDel(图2-A、B)在染色体上的分布作图。
统计2个极端性状混池的SNP-index和InDel-index,并计算子代池ΔSNP-index,在95%置信水平下,以ΔSNP-index值大于阈值的窗口作为候选区域,共检测到30个与果顶形状有关的SNP位点,分别位于1号染色体(8.225~31.309 Mb)、3号染色体(21 668 266 bp)、4号染色体(15.700~18.230 Mb)和6号染色体(5 047 789 bp)上(图1-C)。
同样在95%置信水平下,以ΔInDel-index值大于阈值的窗口作为候选区域,共检测到78个与果顶形状有关的InDel位点,分别位于1号染色体(7.755 ~32.155 Mb)、2号染色体(6.113~9.008 Mb)、4号染色体(14.703~23.033 Mb)、5号染色体(25.035Mb)和6号染色体(17.881~24.954 Mb)上(图2-C)。
将SNP-index和InDel-index合并后得到直观的Allindex在染色体上的分布情况,以95%为阈值计算ΔAll-index,最终定位到6个与黄瓜果顶形状相关的QTL,含有108个SNP和InDel位点,分别位于1号染色体(7.755~32.155 Mb)、2号染色体(6.113~9.008 Mb)、3号染色体(21 668 266 bp)、4号染色体(14.703~23.033 Mb)、5号染色体(25 035 518 bp)和6號染色体(5.047~24.954 Mb)上(图3)。
在全基因组范围内筛选2个子代SNP-index和InDel-index差异显著的位点,即在果顶平头形混池中SNP-index和InDel-index接近0.9,且在果顶瘦尖形混池中SNP-index和InDel-index接近0.15的位点。变异位点统计见表4。
2.4 候选基因分析与预测
基于QTL-Seq结果,在候选区域内获得候选变异位点108个。挑选其中All-index接近0或者1的位点作为SNP或InDel的候选位点,候选区间内一共含有12个变异基因。优先挑选引起stoploss、stopgain、非同义突变或可变剪接的位点所在的基因作为候选基因。变异类型筛选结果表明,只有6号染色体上CsaV3_6G005930.1在外显子上发生SNP替换(C-A)形成终止密码子,导致翻译提前终止(表5)。因此,预测CsaV3_6G005930.1为黄瓜果顶形状的候选基因,该基因编码一个未知蛋白。
3 讨论和结论
果实形状是影响黄瓜外观品质和商品价值的重要指标[17-18]。果顶是黄瓜果实外形的重要组成部分,具有丰富的多样性。朱拼玉等[11]对黄瓜重组自交系中145株钝圆形-瘦尖形分离群体和155株卵圆形-瘦尖形分离群体中果顶形状进行遗传规律分析和植株数量性状主基因+多基因混合模型分析,结果表明果顶钝圆形和果顶卵圆形黄瓜遗传均表现为不完全隐性遗传,符合A-0模型,主要受1对主基因控制。笔者通过果顶平头形自交系玉女和果顶瘦尖形自交系R7杂交构建F1、F1反和F2代群体并进行遗传分析,发现F1和F1反的果顶均为钝圆形,F2果顶表现为平头、钝圆与瘦尖3种表型,且后代分离比接近1∶2∶1,由此认为黄瓜果顶瘦尖形为不完全显性遗传的数量性状,与前人研究结果一致。
朱拼玉等[11]对黄瓜果顶形状相关基因进行定位,发现钝圆形果顶受到bft4.1和bft6.1控制,其中bft6.1(87.99 ~113.09 cM)是控制果顶形状的主效位点。卵圆形果顶受oft3.1、oft3.2、oft3.3、oft4.1、oft4.2、oft5.1控制,且oft4.1(50.62 ~62.40 cM)是控制卵圆形果顶的主效位点。在本研究中利用F2代分离群体,通过QTL-Seq对样本池和双亲池进行高通量测序,寻找差异的SNP和InDel,进而预测黄瓜果顶形状相关的候选基因。基于QTL-Seq结果定位到108个与果顶形状相关的SNP和InDel位点,分别位于1号染色体、2号染色体、3号染色体、4号染色体、5号染色体和6号染色体上,共包含12个发生变异的基因。其中,只有6号染色体上CsaV3_6G005930.1(5 047 789 bp)在外显子上发生SNP替换(G-A)形成终止密码子,导致翻译提前终止。因此,预测CsaV3_6G005930.1为黄瓜果顶形状相关的候选基因。与前人研究结果相比较,本研究结果预测的候选基因CsaV3_6G005930.1位于6号染色体5 047 789 bp处,与前人预测的6号染色体的候选区间不重合。因此,笔者预测到一个新的与黄瓜果顶形状相关的候选基因,且该基因功能未知(unknown protein)。笔者将进一步对候选基因进行序列变异分析和生物信息学分析,验证候选基因的准确性,为后续克隆该基因奠定理论基础。
参考文献
[1] PAN Y P,WANG Y H,MCGREGOR C,et al.Genetic architecture of fruit size and shape variation in cucurbits:a comparative perspective[J].Theoretical and Applied Genetics,2020,133(1):1-21.
[2] 柴丹丹.黄瓜果实圆形性状的SRAP分子标记[D].陕西杨凌:西北农林科技大学,2008.
[3] CHAIM B A, PARAN I, GRUBE R C,et al.QTL mapping of fruit-related traits in pepper (Capsicum annuum)[J].Theoretical & Applied Genetics,2001,102(6/7):1016-1028.
[4] 张佳琦.辣椒果实性状相关性分析及QTL定位[D].广东湛江:广东海洋大学,2014.
[5] 耿树文.长茄果顶形状遗传研究及QTL定位[D].北京:中国农业科学院,2018.
[6] BREWER M T,MOYSEENKO J B,MONFORTE A J,et al.Morphological variation in tomato:a comprehensive study of quantitative trait loci controlling fruit shape and development[J].Journal of Experimental Botany,2007,58(6):1339-1349.
[7] 高智慧.黄瓜两个不同果形自交系全基因组多态性检测及果形相关QTLs定位[D].山东泰安:山东农业大学,2017.
[8] 简兴,苗永美,高青海,等.黄瓜果形性状主基因+多基因混合遗传分析[J].分子植物育种,2015,13(10):2262-2267.
[9] 潘玉朋.黄瓜圆形果的QTL定位及无表皮毛(果刺)基因csgl3的图位克隆[D].陕西杨凌:西北农林科技大学,2016.
[10] 苗晗,顾兴芳,张圣平,等.黄瓜果实相关性状QTL定位分析[J].中国农业科学,2011,44(24):5031-5040.
[11] 朱拼玉,张开京,钟廷龙,等.不同类型黄瓜果顶形状QTL定位[C]//中国园艺学会第八届黄瓜学术研讨会暨新品种展示观摩活动会议手册.南京,2018:79.
[12] 李锡香,朱德蔚,杜永臣,等.黄瓜种质资源描述规范和数据标准[M].北京:中国农业出版社,2005.
[13] HIROKI T,AKIRA A,KENTARO Y,et al.QTL-seq:rapid mapping of quantitative trait loci in rice by whole genome resequencing of DNA from two bulked populations[J].Plant Journal,2013,74(1):174-183.
[14] MURRAY M G,THOMPSON W F.Rapid isolation of high molecular weight plant DNA[J].Nucleic Acids Research,1980,8(19):4321-4325.
[15] LI H,DURBIN R.Fast and accurate long-read alignment with Burrows–Wheeler transform[J].Bioinformatics,2010,26(5):589-595.
[16] WANG K,LI M,HAKONARSON H.ANNOVAR:functional annotation of genetic variants from high-throughput sequencing data[J].Nucleic Acids Research,2010,38(16):e164.
[17] 喬军,刘富中,陈钰辉,等.园艺作物果形遗传研究进展[J].园艺学报,2011,38(7):1385-1396.
[18] 廖芳蕾,陈泽宇,徐启越,等.果形建成基因研究进展及其对佛手果形发育研究的启示[J].园艺学报,2018,45(9):1701-1714.
