PTEN通过靶向P21诱导卵巢癌细胞衰老的机制研究①
2021-08-23柯小平李经维同济大学附属杨浦医院妇产科上海200090
柯小平 李 莉 李经维 刘 平 (同济大学附属杨浦医院妇产科,上海200090)
卵巢癌是女性生殖器官常见的恶性肿瘤之一,发病率仅次于子宫颈癌和子宫体癌[1-2]。卵巢恶性肿瘤中以上皮癌最多见,其次是恶性生殖细胞肿瘤。其中卵巢上皮癌死亡率占各类妇科肿瘤的首位,对女性生命造成严重威胁[3]。由于卵巢深居盆腔,体积小,缺乏典型症状,难以早期发现,卵巢上皮癌患者手术中发现肿瘤局限于卵巢的仅占不足30%,大多数已扩散到盆腹腔器官[4-5],因此,早期诊断和特异性靶向治疗是早期发现和治疗的关键。PTEN(phosphatase and tensin homolog deleted on chromosome 10)是最早发现的具有磷酸酶活性的抑癌基因[6-7],是 PI3K 通路的主要负调节因子[8],在多种进展期和转移性肿瘤中发生高频缺失和突变,它通过使PIP3去磷酸化转化为PIP2,下调细胞内PIP3的水平,拮抗PI3K的活性,负向调节AKT信号通路,使AKT 信号通路失活,进一步干扰众多下游信号,从而调控肿瘤的增殖、迁移、侵袭[9]。PTEN 信号通路可通过诱导细胞凋亡、抑制细胞周期、抑制肿瘤细胞侵袭和转移、抑制肿瘤血管形成、维持免疫系统的稳定性等发挥其抑癌作用[10]。除了经典的PTEN/PI3K/AKT 信号通路,PTEN 是否存在其他的调控卵巢癌发生发展的信号通路?目前大量研究发现,肿瘤与衰老存在密切联系,大多数肿瘤发生在机体衰老时期,衰老细胞难以修复错配基因,更易导致原癌基因的激活和抑癌基因的失活[11-13],另一方面,衰老细胞的细胞周期发生阻滞,使细胞停留在G0/G1 期而抑制细胞增殖,从而阻止细胞过度增殖形成肿瘤。许多调控细胞周期的蛋白分子都参与肿瘤的发生,同时也参与细胞衰老的调控,如P53 和 P21 基因[14]。本研究发现,与正常卵巢组织相比,P21 蛋白在卵巢癌组织表达量较低,P21 表达减少会促进细胞增殖,使得细胞不易衰老,从而导致肿瘤的发生,因此,进一步研究了P21是否影响卵巢癌的发生发展,以及PTEN是否通过调控P21抑制卵巢癌细胞的增殖。研究结果显示,PTEN 通过促进TRIM39 与P21 的结合,导致P21 不能被泛素化降解,间接地促进了P21 的表达,从而促进细胞衰老,抑制卵巢癌细胞的增殖。
1 材料与方法
1.1 材料
1.1.1 临床样本收集及知情同意 收集2017 年1 月至2019 年12 月在同济大学附属杨浦医院妇产科接受一期手术的30 例卵巢癌患者组织样本和30例卵巢囊肿切除的卵巢样本。纳入标准:年龄35~65岁,近3个月未接受激素类药物治疗,排除术前接受化疗的患者。本研究经同济大学附属杨浦医院伦理委员会批准,所有患者均签署书面同意书,并告知患者组织只限用于科学研究。
1.1.2 试剂及设备 SKOV3 细胞购自上海中科院细胞库;过表达PTEN及P21的慢病毒及干扰和过表达TRIM39 的慢病毒均购自上海吉凯基因化学技术公司;小鼠PTEN 抗体、小鼠P21 抗体、小鼠TRIM39抗体及兔Vimentin 抗体购自美国Abcam;对应二抗羊抗小鼠HRP 或羊抗兔HRP 购自美国CST;4%多聚甲醛、氯仿购自中国国药集团;0.01 mo/l L PBS、抗原修复液、β-半乳糖苷酶染色试剂盒购自中国碧云天公司;山羊抗兔555 二抗、DAPI 购自美国Ther‑mo Scientific;Trizol 购自美国 Invitrogen;TB Green®Premix Ex Taq™试剂盒购自日本TaKaRa;PVDF膜购自美国Millipore;羊抗小鼠HRP 或羊抗兔HRP 购自美国CST;McCoY's 5A 细胞培养液购自美国Sigma;荧光显微镜购自日本奥林巴斯。
1.2 方法
1.2.1 免疫荧光染色 将卵巢癌组织样本和正常卵巢组织样本用眼科剪裁切成1 cm3大小的组织块,浸泡在4℃4%多聚甲醛的组织固定液中72 h,液体石蜡包埋卵巢组织后行石蜡切片,室温保存。行免疫荧光染色时,首先使用二甲苯对石蜡切片进行脱蜡,100%、90%、70%乙醇水化,然后放入盛有柠檬酸钠抗原修复液的烧杯中,烧杯中的抗原修复液需漫过组织切片,95℃加热15 min,自然冷却至室温后0.01 mo/l L PBS 清洗,5 min×3 次。用含5%正常山羊血清的封闭液室温孵育组织30 min,将小鼠PTEN抗体(1∶500)、小鼠P21 抗体(1∶500)、小鼠TRIM39抗体(1∶500)及兔Vimentin抗体(1∶500)稀释于一抗稀释液中,混匀,滴加在组织表面,4℃孵育过夜,0.01 mo/l L PBS 清洗,10 min×3 次后将山羊抗小鼠488二抗及山羊抗兔555二抗按照1∶1 000稀释于二抗稀释液中,混匀,滴加在组织或细胞表面,37℃室温孵育 1 h,0.01 mo/l L PBS 清洗,10 min×3 次。在组织切片上滴加DAPI 染色液,盖玻片封片,正置荧光显微镜下观察染色情况。
1.2.2 细胞培养及病毒感染 McCoY's 5A 细胞培养液+10%胎牛血清作为完全培养液培养SKOV3细胞,当细胞融合密度达到90%时进行细胞传代,按照试验要求分别接种在6 cm 培养皿和24 孔板中,6 cm 培养皿用于检测靶分子在mRNA 水平和蛋白水平的表达,24 孔板用于β-gal 和Tunel 染色检测衰老细胞和凋亡细胞情况。过表达PTEN 及P21 的慢病毒滴度为 1×108TU/ml;干扰和过表达TRIM39 的慢病毒滴度均为 1×108TU/ml。SKOV3 细胞用 Mc‑CoY's 5A 培养液调整密度为 5×106个/ml,接种于6 cm培养皿,待接种密度达到90%以上,加入400µl病毒感染增强液Hitrans GA 及100 µl 滴度为1×108TU/ml 的慢病毒或阴性对照(neg-control),37℃培养24 h,更换新鲜培养液继续培养,隔天换液,感染后约72 h,观察感染效率(GFP 阳性细胞数量),当效率达到或超过90%时,表示感染成功,可进行后续实验操作。
1.2.3 Real-time PCR 样本收集方法按照传统RNA 抽提方式进行,细胞及血管组织中加入1 ml Trizol 后加入 200 µl 氯仿混匀后静置 10 min,4℃12 000/r min 离心15 min,将上层的水相转移至新的无 RNA 酶的 EP 管,加入 500 µl 异丙醇,混匀,静置 10 min 后 12 000/r min 离心 10 min,弃上清,可见白色RNA 沉积于管底,75%乙醇清洗后晾干,待白色RNA 变为无色透明状,加入30µl 焦碳酸二乙酯(diet-hylpyrocarbonate,DEPC)水溶解RNA,储存于−80℃。使用TB Green®Premix Ex Taq™试剂盒进行基因的定量PCR 检测,采用20 µl 反应体系,95℃预变性 30 s 后 95℃ 5 s,60℃ 30 s 进行 40 个循环,反应结束后确认扩增曲线和融解曲线,依据公式2−ΔΔCT计算被检测基因的相对量,然后进行组间比较。PTEN 引 物 序 列 :forward:5'-TGGATTCGACTTAGACTTGACCT-3',reverse:5'-GGTGGGTTATGGTCTTCAAAAGG-3';P21 引 物 序 列 :forward:5'-TGCAACTACTACAGAAACTGCTG-3',reverse:5'-CAAAGTGGTCGGTAGCCACA-3';TRIM39 引 物 序 列 :forward:5'-GAAAGGGCGAGTTGACTCCAC-3',reverse: 5'-GGCTGCATATTTGTCCCCATT-3'; GADPH引物序列:forward:5'-CTTGCTCAAGCTTAGTTCTAGG-3′,reverse:5'-GAGTGCTCAGTGGTATTGC-3'。
1.2.4 Western blot 体外培养细胞行蛋白抽提后首先进行BCA 蛋白定量测定蛋白浓度,在抽提的蛋白中加入相应体积的5×loading buffer,混匀后100℃蛋白变性5 min,分装后置于−80℃保存。制备SDSPAGE,每孔上样20 µg 总蛋白进行凝胶电泳,将蛋白转移至PVDF 膜后,室温封闭30 min,利用相应一抗:小鼠PTEN多克隆抗体、小鼠P21多克隆抗体、小鼠TRIM39多克隆抗体、兔GAPDH 多克隆抗体及对应二抗羊抗小鼠HRP 或羊抗兔HRP 检测相应蛋白条带,运用IPP软件进行蛋白定量并比较组间差异。
1.2.5 β-gal 染色 使用β-半乳糖苷酶染色试剂盒对衰老细胞进行染色鉴定。β-半乳糖苷酶染色试剂盒以X-Gal 为底物,在衰老特异性的β-半乳糖苷酶催化下会生成深蓝色产物,光学显微镜下很容易观察到变成蓝色的表达β-半乳糖苷酶的细胞。细胞使用β-半乳糖苷酶染色固定液,室温固定10 min,0.01 mo/l L PBS 清洗,5 min×3 次。然后加入β-半乳糖苷酶染色液A(10 µl)、β-半乳糖苷酶染色液B(10 µl)、β-半乳糖苷酶染色液 C(930 µl)和 X-gal(50µl)按照比例混合的染色工作液,37℃孵育4 h,普通光学显微镜下观察、拍照、计数。如不能及时观察拍照,可以去除染色工作液,加入相应体积的PBS,4℃环境下可以保存数日。每孔细胞选取10个视野拍照,计数10个视野β-半乳糖苷酶阳性染色细胞数目,除以总细胞数目,即为阳性细胞比例,对照各组间阳性染色比率,进行统计学比较。
1.2.6 Tunel染色 培养的细胞去除培养液后加入4%多聚甲醛室温固定细胞15 min。0.01 mo/l L PBS 清洗,5 min×3 次。加入含 0.3% Triton X-100的 PBS,室温孵育 5 min,0.01 mo/l L PBS 清洗,5 min×3 次。按照TdT酶∶荧光标记液∶Tunel检测液(1∶9∶10)的比例配置Tunel 染色液。每孔细胞中加入适当的Tunel 染色液,置于37℃避光孵育2 h,0.01 mo/l L PBS 清洗,5 min×3 次后,用抗荧光淬灭封片液封片,荧光显微镜下观察并计数Tunel 阳性染色细胞数,每孔细胞选取10 个视野拍照,计数10 个视野Tunel 阳性染色细胞数目,除以总细胞数目,即为阳性细胞比例,对照各组间阳性染色比率,进行统计学比较。
1.3 统计学分析 运用SPSS18.0软件对所有数据进行分析。定量指标以表示,实验数据采用单因素方差分析及Tukey's post-hoc 检验分析方法,P<0.05表示组间差异具有统计学意义。
2 结果
2.1 人卵巢癌组织与正常卵巢组织中PTEN 和P21表达比较 Real-time PCR 结果显示,与正常人卵巢组织相比,人卵巢癌组织中PTEN 和P21 mRNA 表达水平显著下调(图1A)。Western blot结果显示,与正常人卵巢组织相比,人卵巢癌组织中PTEN 和P21在蛋白水平表达均下调(图1B)。免疫荧光染色显示,与正常人卵巢组织相比,人卵巢癌组织中PTEN和P21 在蛋白水平表达均下调(图1C)。依据上述研究结果,推测抑癌基因PTEN和衰老蛋白P21的表达下调与卵巢癌的发病具有相关性。
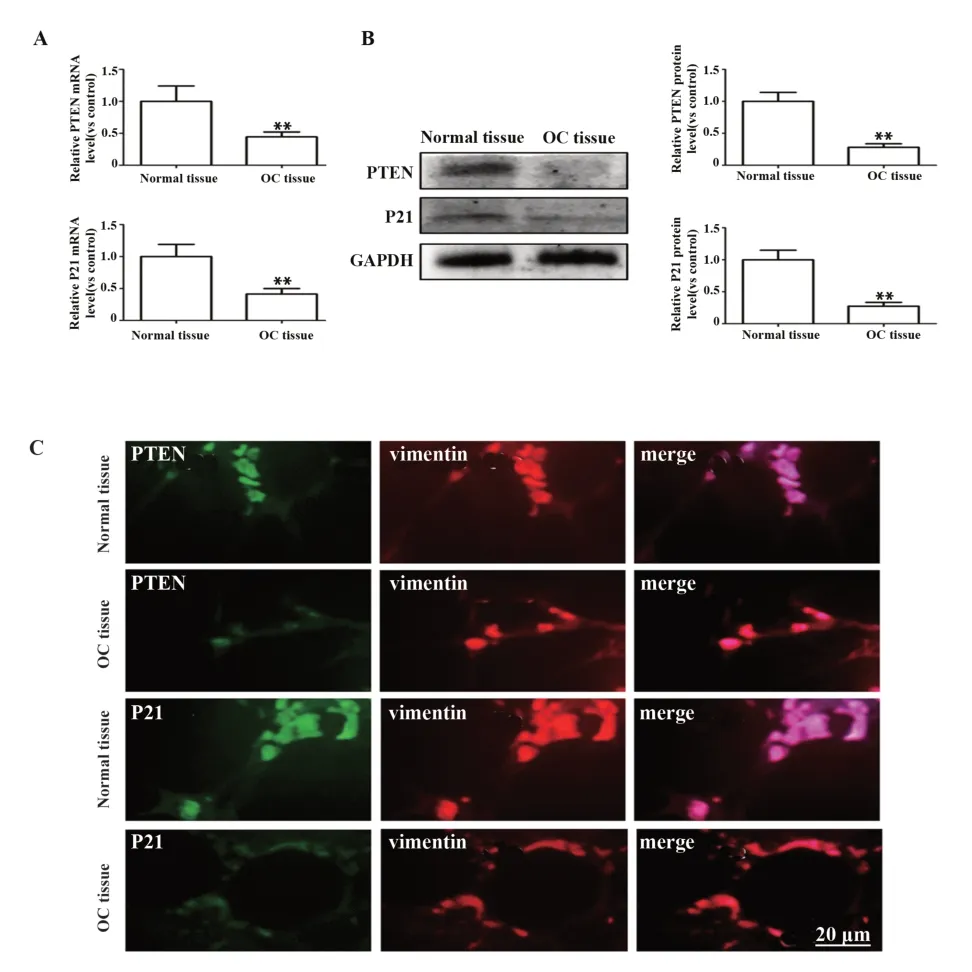
图1 人卵巢癌组织与正常卵巢组织中PTEN 和P21 表达比较Fig.1 Comparison of expression of PTEN and P21 in human ovarian cancer tissue and normal ovarian tissue
2.2 P21 对人卵巢癌细胞衰老和增殖的影响 βgal 染色显示,与正常卵巢癌细胞相比,过表达P21的SKOV3 细胞衰老细胞数目显著增加(图2A),Ki67 表达显著降低(图2B)。过表达P21 的SKOV3细胞中PTEN 在mRNA 及蛋白水平表达未有变化(图2C)。

图2 过表达P21对人卵巢癌细胞的影响Fig.2 Effect of overexpression of P21 on human ovarian cancer cells
2.3 PTEN 对人卵巢癌细胞衰老和增殖的影响 在SKOV3 细胞中过表达PTEN,促进了SKOV3 细胞的衰老(图3A),抑制了SKOV3 细胞的增殖(图3B)。过表达 PTEN 的 SKOV3 细胞中 P21 mRNA 和蛋白水平显著升高(图3C、D)。推测PTEN 通过促进P21 的表达促进卵巢癌细胞衰老,抑制卵巢癌细胞增殖。
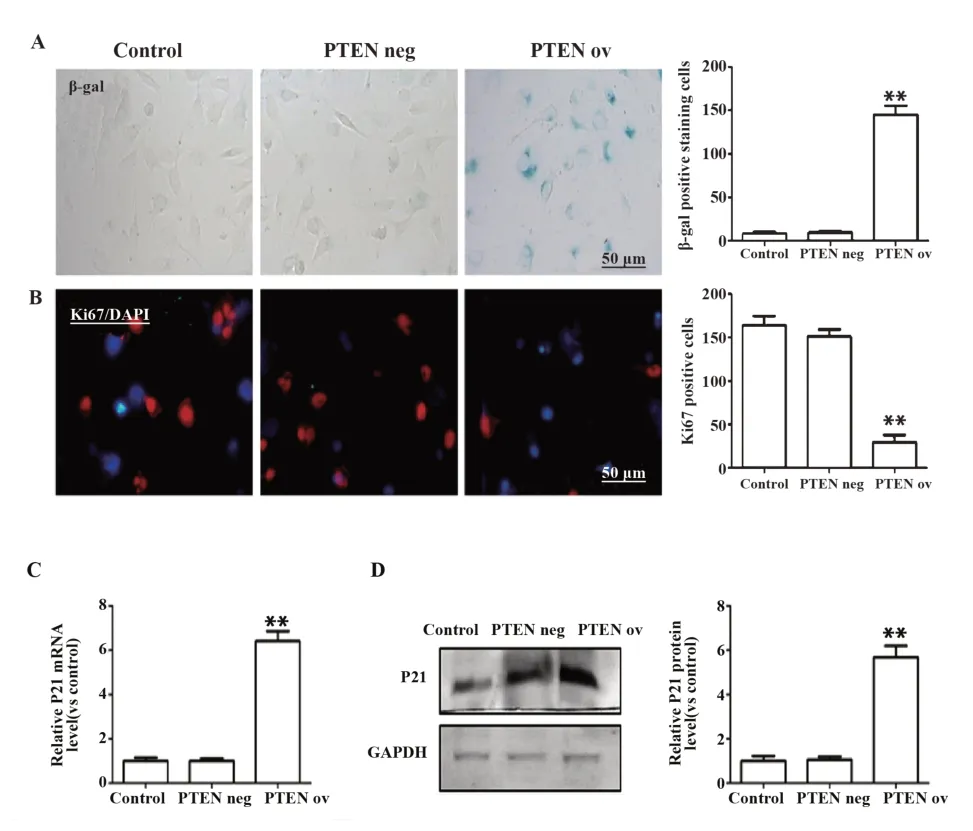
图3 过表达PTEN对人卵巢癌细胞的影响Fig.3 Effect of overexpression of PTEN on human ovari⁃an cancer cells
2.4 TRIM39 对人卵巢癌细胞衰老和增殖的影响 与正常卵巢组织相比,TRIM39 在卵巢癌组织中的mRNA 和蛋白表达显著减少(图4A~C)。在SKOV3 细胞中过表达 TRIM39,P21 mRNA 和蛋白水平显著升高(图4D)。结果显示过表达TRIM39促进了SKOV3细胞的衰老(图4E)。

图4 过表达TRIM39对人卵巢癌细胞的影响Fig.4 Effect of overexpression of TRIM39 on human ovarian cancer cells
2.5 PTEN 对人卵巢癌细胞影响的机制验证 在加入PTEN 激动剂naringin 的SKOV3 细胞中Realtime PCR 和 Western blot 结果显示,PTEN 激动剂同样促进了TRIM39 的表达(图5A、B)。在干扰TRIM39 表达的SKOV3 细胞中加入PTEN 激动剂naringin,与对照组相比,P21 mRNA和蛋白表达显著减少,衰老的卵巢癌细胞数量显著减少(图5C、D),说明PTEN 通过促进TRIM39 表达维持了P21 的稳定,减少了P21 的降解,从而促进了SKOV3 细胞衰老。
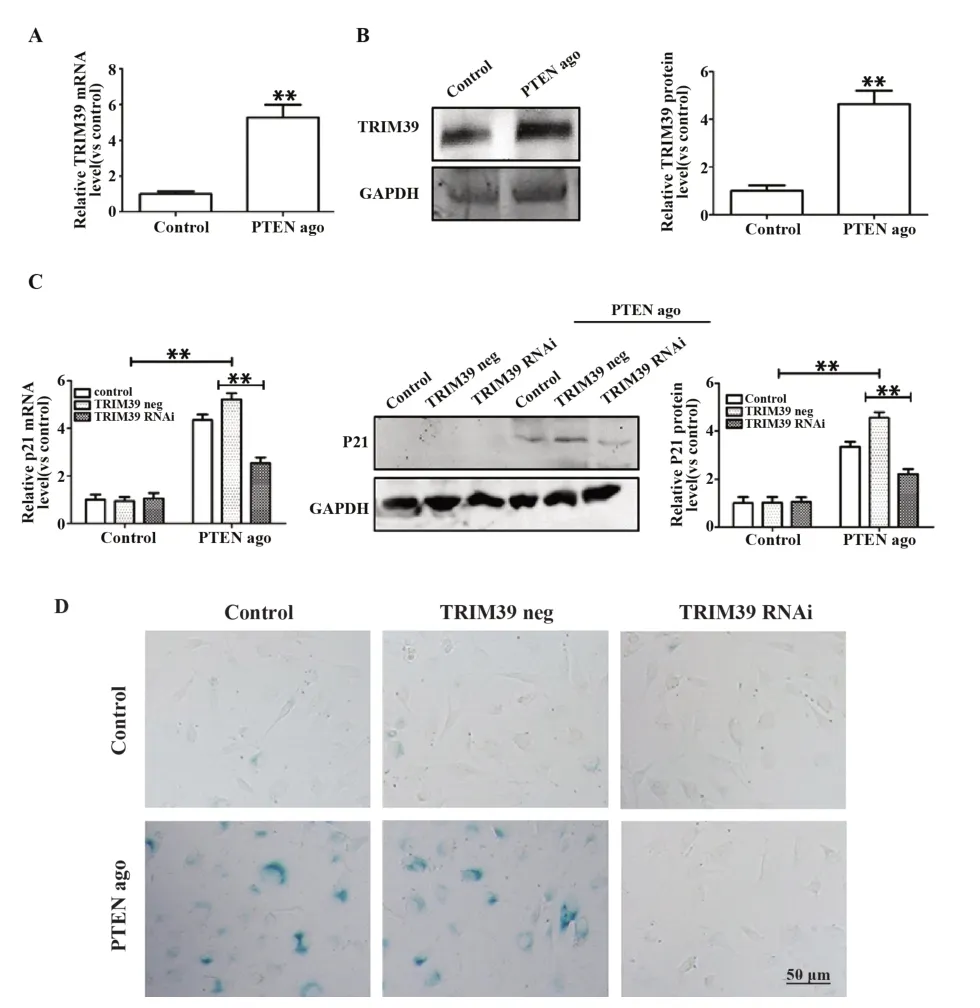
图5 PTEN/ TRIM39/ P21 通路在人卵巢癌细胞衰老中的作用Fig.5 Role of PTEN/ TRIM39/ P21 pathway in senes⁃cence of human ovarian cancer cells
3 讨论
卵巢癌是女性生殖器官常见的恶性肿瘤之一,其发病率仅次于宫颈癌和子宫内膜癌而列居第三位。其中上皮性肿瘤占原发性卵巢肿瘤的50%~70%,其恶性类型占卵巢恶性肿瘤的85%~90%[15-16]。手术和化疗虽然可以治愈大多数初期患者,但却不能挽救很多晚期患者的生命[17]。卵巢癌组织类型主要有交界性肿瘤、浆液性癌、内膜样癌、透明细胞癌、黏液性癌。近10 年来,为了提高卵巢癌的治愈率,人们提出了新的分类方式,将卵巢癌分为Ⅰ型和Ⅱ型[18-19]。Ⅰ型为低级别肿瘤,包含BRAF、KRAS、PTEN 基因突变的内膜样、黏液性、透明细胞癌。Ⅱ型肿瘤是高级别浆液性和癌肉瘤,包含 p53、BRCA1 和 BRCA2 基因突变[20-21]。基于卵巢癌多基因突变的原因,目前的治疗方式除了传统的化疗药物外,还包括靶向治疗、抗血管生成治疗和激素替代疗法等。
抑癌基因PTEN(MMAJC1/TEP1)定位于染色体10q23.3 上,它的突变与缺失和人类多种肿瘤的发生有关。PTEN 基因主要通过其双重底物特异性磷酸酶活性,经由P13K信号系统和MAPK信号级联途径发挥肿瘤抑制作用,对细胞生长、凋亡、增殖及黏附产生影响。近年来的研究成果已经证实,PTEN与子宫内膜癌、卵巢癌、宫颈癌等多种妇科肿瘤的发生发展密切相关[22-23]。然而,除了经典的PI3K/AKT 通路,PTEN 是否还通过其他途径抑制卵巢癌的发生,有待于深入研究。本研究发现,人卵巢癌组织中PTEN、P21、TRIM39 表达显著降低,P21 参与调控细胞周期,而TRIM39 则负责P21 的稳定。P21作为一种抑癌基因,隶属于细胞周期依赖性蛋白激酶抑制因子,通过其编码蛋白的水平来调控细胞周期,从而抑制肿瘤的发生发展。研究表明,P21 与肿瘤的增生、分化、转移和浸润程度相关,同时具有判断预后的价值。与此同时,P21 也是一个调控细胞衰老的基因,其通过抑制细胞周期,促进细胞衰老[24-25]。因此,本研究观察了P21 是否能够促进卵巢癌细胞衰老,PTEN 是否能够通过调控P21的表达抑制卵巢癌的发生发展。结果表明,P21 促进了卵巢癌细胞衰老,从而促使卵巢癌细胞周期停滞,抑制卵巢癌细胞增殖,这种作用可以通过调控PTEN的表达实现,表明PTEN能够通过促进P21的表达抑制肿瘤的发生发展。然而,PTEN 并不能直接调控P21 的表达,因此,推测PTEN 可能通过调控P21 结合蛋白TRIM39,影响P21 的表达。研究结果显示,PTEN 促进了TRIM39 的表达,从而促进了TRIM39与P21 的结合,阻止了P21 被泛素化降解,从而间接促进了P21的表达,促进了卵巢癌细胞的衰老。
TRIM39 自2000 年被克隆,其生物学功能仍不明确[26-27]。P21 是一个细胞周期蛋白依赖性激酶的抑制分子,它通过调控细胞周期的进程,参与细胞生长、分化、衰老和死亡的调节,在细胞应对应激刺激以及肿瘤的发生发展中发挥重要的作用。研究发现TRIM39 与P21 相互作用,从而阻止CRL4Cdt2这个E3 复合物中的底物识别蛋白Cdt2 与P21 的结合,进而抑制CRL4Cdt2E3复合物介导的对P21的泛素化蛋白酶体降解,由此影响细胞周期以及细胞对DNA 损伤刺激的应答[28-29]。TRIM39 作为调控细胞周期的重要分子,在生理状态下TRIM39与P21共同负向调控细胞周期进程,在DNA 损伤刺激条件下,TRIM39 对细胞周期停滞起至关重要的作用[30]。本研究发现PTEN 通过促进TRIM39 的表达从而阻止了P21 的降解,从而促使细胞周期停滞在G0/G1 期和细胞衰老,抑制了卵巢癌的发生发展。然而,PTEN 可能存在多种调控通路参与抑制肿瘤的发生,因此探索更多的调控肿瘤发生的下游靶基因,对于肿瘤的靶向治疗具有重要意义。
