圣草酚通过调节Nrf2通路促进氧化应激诱导的肝癌细胞的凋亡①
2021-08-23张昆鹏张晓愉李少一尤江莲邢台市人民医院邢台054001
张昆鹏 张晓愉 李少一 甄 品 尤江莲 (邢台市人民医院,邢台054001)
肝癌是世界上最常见的恶性肿瘤之一,在全球癌症死亡率中居第四位,是我国第二大健康负担[1]。通常所用的化疗法可以在某种程度上杀死癌细胞,但副作用给患者带来了很多麻烦。它会导致电解质失衡,脱水和营养不良,从而影响患者的生活质量,这使得对新药的需求变得迫在眉睫[2]。癌细胞逃脱凋亡的机制在肿瘤学研究中引起广泛关注,利用药物诱导肿瘤细胞凋亡是治疗肿瘤的重要途径之一[3]。凋亡由多种外在和内在信号触发,包括可能诱导某些促凋亡蛋白活化的各种细胞应激或细胞毒性药物,在这多种因素中,由ROS 驱动的氧化应激诱导细胞凋亡备受关注。氧化还原稳态的调节是维持正常细胞功能和促进细胞存活的基础[4]。伴随着比正常细胞更高的ROS 水平,癌细胞特征性地发展出几种适应性反应,以维持与细胞生物学功能兼容的ROS 水平。因此,认为对ROS 稳态的干扰能够破坏癌细胞的生物代谢并有效地诱导癌细胞凋亡[5]。圣草酚是一种天然的多酚黄酮类化合物,在水果、蔬菜和多种中药中普遍存在。圣草酚具有抗炎、抗氧化、镇痛和神经保护等作用[6]。已有研究表明,圣草酚通过诱导线粒体介导的凋亡,G2/M 细胞周期阻滞和抑制m-TOR/PI3K/Akt 信号通路,对人肺癌A549 细胞发挥有效的抗癌活性[7]。虽已有研究表明圣草酚可诱导肝母细胞瘤HepG2 细胞凋亡,但高分化肝癌Huh7细胞株与肝母细胞瘤HepG2细胞具有不同分泌物:Huh7细胞系能产生一些细胞质蛋白,如白蛋白、a 抗胰蛋白酶、AFP 等;HepG2 细胞系可分泌ALB、a2-MG 等。因此,Huh7 细胞更适合用于肝细胞代谢方面的研究。故,圣草酚是否对高分化肝细胞肝癌Huh7 细胞凋亡具有作用尚不明确[8]。本文选取高分化肝细胞肝癌Huh7细胞株,通过体外细胞实验和体内移植瘤实验来探究圣草酚对氧化应激诱导的肝癌细胞凋亡的作用机制。
1 材料与方法
1.1 材料
1.1.1 主要试剂 肝细胞HL-7702 和人肝癌细胞Huh7(上海通派生物科技有限公司);圣草酚(HLPC≥99%,上海叶原生物科技有限公司,货号:B29144),过氧化氢(纯度≥98%,上海百舜生物科技有限公司,货号:7722-84-1);荜茇酰胺(Piperlongumine,PL,可增加活性氧的水平,HLPC≥99%,上海蓝木化工有限公司,货号:S7551);DMEM培养基(上海慧颖生物科技有限公司,货号:C21700500BT);CCK-8 试剂盒(上海艾博抗生物科技有限公司,货号:ab228554);胎牛血清、青霉素和链霉素双抗溶液(上海素尔生物科技有限公司,货号:16000-044、15140122);超氧化物歧化酶(superoxide dismutase,SOD)ELISA 试剂盒(上海恒斐生物科技有限公司,货号:EELR1424);丙二醛(malondialdehyde,MDA)ELISA 试剂盒(南京森贝伽生物科技有限公司,货号:SBJR0007);BCA 试剂盒(上海易色医疗科技有限公司,货号:BC201);辣根过氧化物酶标记的山羊抗兔二抗、Nrf2、HO-1、NOQ1 兔来源的单克隆抗体(上海艾博抗生物科技有限公司,货号:ab36151、ab62352、ab189491、ab80588)。
1.1.2 动物 6 周龄的裸鼠购自河北省实验动物中心,许可证号:SCXK(冀)2018-004。将裸鼠饲养在恒温(22±1)℃、相对湿度(55±5)%、12 h 光照/黑暗周期环境,并提供标准的啮齿动物食物和自来水。动物的护理和处理符合美国国立卫生研究院编写的《实验动物的护理和使用指南》。
1.2 方法
1.2.1 细胞培养 肝细胞HL-7702 和人肝癌细胞Huh7均在含体积分数为10%的胎牛血清、100 U/ml的青霉素和100 µg/ml 的链霉素的DMEM 培养基中,在37℃、5%CO2条件下培养。
1.2.2 CCK-8 法测定圣草酚对细胞的毒性影响 将HL-7702 和Huh7 细胞分别接种到96 孔板中,用不同浓度的圣草酚处理培养48 h 后,将细胞与10 µl CCK-8 试剂连续混合2 h。通过酶标仪测量450 nm 处的吸光度值。细胞活性=(各浓度圣草酚处理OD450n/m0µmo/l L圣草酚处理OD450nm)×100%。
1.2.3 细胞分组及处理 将Huh7 细胞分为对照组、H2O2组、圣草酚组、H2O2+圣草酚组,分别用0.5 mmo/l L H2O2或78µmo/l L圣草酚处理细胞48 h。
1.2.4 体内实验 将裸鼠随机分为对照组、PL 组、圣草酚组、PL+圣草酚组,每组8 只。在裸鼠左腋下皮下注射 Huh7 细胞(5×104个/ml),继续在 SPF 条件下正常饮食饲养。当Huh7肿瘤直径达到约3 mm时,每天腹腔注射PL 2.5 mg/kg或圣草酚40 mg/kg治疗15 d[9-10]。颈椎脱位法处死裸鼠,完整取出皮下肿瘤,测定移植瘤体积和重量。
1.2.5 DCFH-DA探针测定ROS的含量 将细胞用DMEM 洗涤 2 次,然后在 5 µmo/l L DCFH-DA 中于37℃温育30 min。用PBS 洗涤细胞3 次,并在孵育后在裂解缓冲液中裂解。在最佳激发波长488 nm和发射波长下527 nm 测量荧光值。ROS 相对水平=各实验组荧光值/对照组荧光值。
1.2.6 试剂盒检测SOD 和MDA 水平 收集1.2.3处理细胞,加入PBS 冰上超声裂解细胞,然后再置于4℃离心机中,12 000 g 离心10 min,收集上清液备用。收集1.2.4 各组裸鼠血液,于4℃离心机中,3 000 g离心20 min,收集上清液备用。取Huh7细胞上清液和裸鼠血清按照SOD 和MDA 试剂盒说明检测SOD和MDA水平。
1.2.7 流式细胞术检测细胞凋亡率 取1.2.3处理细胞培养24 h后,离心收集细胞,并按1×106个/ml的浓度重悬。细胞悬液中加入5 µl FITC 标记的膜联蛋白V和5µl 碘化丙啶,避光孵育15 min,然后用流式细胞仪分析细胞凋亡情况。
1.2.8 Western blot 检测 Nrf2、HO-1、NQO1 蛋白相对表达水平 用RIPA 裂解液提取总蛋白,并用BCA 试剂盒检测蛋白浓度,然后经SDS-PAGE 分离蛋白后,用半干转膜仪转移蛋白质至PVDF 膜,并用脱脂牛奶室温封闭蛋白2 h,再加入兔来源的单克隆一抗(Nrf2 1∶1 000、HO-1 1∶1 500、NQO1 1∶800、GAPDH 1∶1 000)在4℃封闭过夜,加入对应山羊抗兔二抗(1∶2 000)室温封闭1 h,最后滴电化学反应液曝光,以GAPDH 为内参,使用Quantity One 软件进行分析蛋白条带灰度,以目标蛋白与内参蛋白GAPDH吸光度比值表示蛋白的表达水平。
1.2.9 TUNEL 染色检测细胞凋亡 取肿瘤组织固定后,常规石蜡切片,玻片预先用多聚赖氨酸处理以防止脱片。切片脱蜡入水后按TUNEL 染色试剂盒使用说明操作,DAB 染色,常规脱水、透明、封片,光镜下检查。棕褐色细胞代表凋亡细胞。
1.3 统计学分析 所有统计数据采用SPSS20.0处理,图形使用GraphPad Prism 6.0 构建的。实验数据以表示,数据经 shapiro-wilk 检验发现均呈正态分布,多组比较进行One-Way ANOVA 分析,两两比较使用SNK检验,P<0.05为差异有统计学意义。
2 结果
2.1 圣草酚对HL-7702和Huh7细胞毒性作用 结果显示,圣草酚呈剂量依赖性抑制HL-7702 和Huh7细胞活性。相同浓度的圣草酚对Huh7 细胞抑制作用比HL-7702抑制作用强,且随着浓度增加,差异越显著,这说明圣草酚对肝癌细胞具有选择抑制作用。Huh7 细胞圣草酚 IC50为 126.58 µmo/l L,HL-7702 细胞圣草酚 IC10为 77.96 µmo/l L,因此选择对正常肝细胞HL-7702 无毒害作用的圣草酚浓度78µmo/l L进行后续细胞实验,如图1。
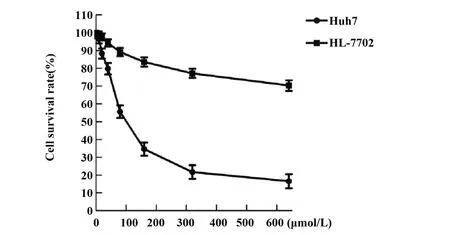
图1 通过CCK-8法检测圣草酚对HL-7702和Huh7细胞毒性作用Fig.1 Cytotoxic effect of Eriodictyol on HL-7702 and Huh7 cells by CCK-8 method
2.2 圣草酚对H2O2诱导Huh 7 细胞氧化应激水平的影响 与对照组相比,H2O2组和圣草酚组ROS 水平和MDA 含量显著上升,SOD 活性显著下降(P<0.05);与 H2O2组相比,H2O2+圣草酚组 ROS 水平和MDA 含量显著上升,SOD 活性显著下降(P<0.05),如图2。这说明圣草酚可改变肝癌细胞Huh7 氧化应激水平。
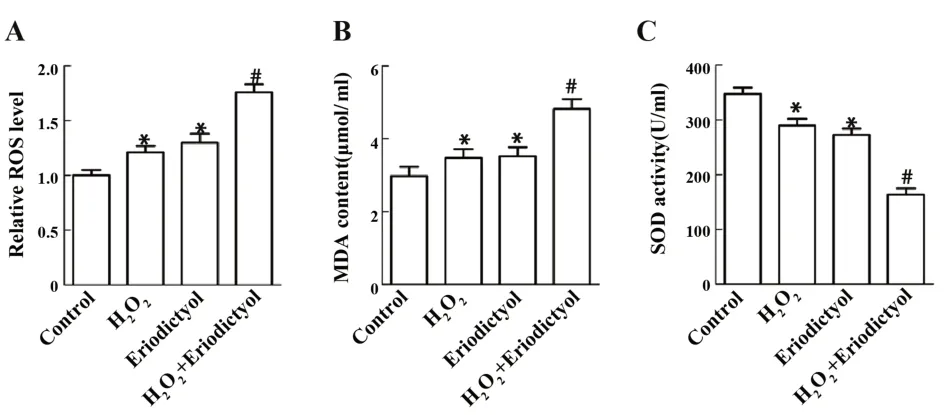
图2 圣草酚对H2O2诱导Huh7细胞氧化应激水平的影响Fig.2 Effect of Eriodictyol on H2O2-induced oxidative stress in Huh7 cells
2.3 圣草酚对H2O2诱导Huh7 细胞凋亡的影响 与对照组相比,H2O2组和圣草酚组细胞凋亡率显著升高(P<0.05);与H2O2组相比,H2O2+圣草酚组细胞凋亡率显著升高(P<0.05),如图3。这说明圣草酚促进氧化应激诱导肝癌Huh7细胞凋亡。

图3 流式细胞术检测圣草酚对H2O2诱导Huh7细胞凋亡的影响Fig.3 Effect of Eriodictyol on H2O2-induced apoptosis in Huh7 cells was examined by flow cytometry
2.4 圣草酚对H2O2诱导Huh7 细胞Nrf2 通路的影响 如图4 所示:与对照组相比,H2O2组和圣草酚组细胞中核 Nrf2、HO-1、NOQ1 表达显著下调(P<0.05);与 H2O2组相比,H2O2+圣草酚组细胞中核Nrf2、HO-1、NOQ1 表达显著下调(P<0.05)。这说明圣草酚抑制Nrf2通路激活。

图4 Western blot 检测圣草酚对H2O2诱导Huh7 细胞Nrf2通路的影响Fig.4 Effect of Eriodictyol on H2O2-induced Nrf2 path⁃way in Huh7 cells was detected by Western blot
2.5 圣草酚对肝癌Huh 细胞移植瘤的影响 与对照组相比,PL 组和圣草酚组移植瘤体积和重量显著降低,ROS水平和MDA含量显著增加,SOD活性显著降低,细胞凋亡率显著升高,Nrf2、HO-1、NOQ1表达显著下调(P<0.05);与PL组相比,PL+圣草酚组移植瘤体积和重量显著降低,ROS水平和MDA 含量显著增加,SOD 活性显著降低,细胞凋亡率显著增多,核Nrf2、HO-1、NOQ1 表达显著下调(P<0.05),如图5。这说明圣草酚促进氧化应激诱导的肝癌移植瘤细胞的凋亡,并抑制Nrf2通路激活。

图5 圣草酚对肝癌Huh7细胞移植瘤的影响Fig.5 Effect of Eriodictyol on liver cancer Huh7 cell transplanted tumor
3 讨论
尽管在诊断和治疗方面取得了进步,但全世界肝癌的发病率仍在逐年上升,肝癌患者五年生存率仍然很低。因此,迫切需要更有效的治疗来提高肝癌患者的生活质量。化疗药物广泛用于提高癌症患者的存活率,但这些药物显示出各种各样的副作用。化疗药物在癌症治疗中的主要策略是诱导细胞凋亡。因此,开发新的促进肝癌细胞凋亡的药物势在必行。圣草酚通过PI3K/Akt/NF-κB 信号通路抑制胶质瘤细胞增殖、转移,诱导胶质瘤细胞凋亡[11]。本研究结果表明,圣草酚选择性抑制肝癌细胞的活性。同时还证明,低毒性的圣草酚促进氧化应激诱导的肝癌细胞和移植瘤细胞的凋亡,并抑制Nrf2通路激活。
细胞凋亡是指细胞为了维持内环境的稳定,由基因控制的细胞自主有序的死亡,绝大多数肿瘤细胞都具有逃脱凋亡的能力。许多蛋白包括细胞表面受体、配体、蛋白酶和有丝分裂组分,调节着细胞的生存与凋亡的平衡[12]。有研究表明,圣草酚诱人肝癌细胞抗癌和凋亡作用与细胞周期阻滞和凋亡相关蛋白的调节有关[13]。氧化应激通过线粒体、死亡受体、内质网应激等途径介导细胞凋亡[14]。ROS包括超氧自由基、羟基自由基和过氧化氢,都是通过细胞过程(如线粒体代谢)的产物。PL 为促氧化药物,可以增加ROS 水平,目前可用于选择性地杀死癌细胞[15]。ROS 的产生与抗氧化剂系统清除自由基的能力之间的不平衡会导致氧化应激。正常细胞中会产生细胞内ROS,以调节一系列生理功能,包括炎症、免疫反应和细胞信号传导,从而促进病原体和致癌物的消除,降低心血管疾病的发生和甲状腺激素的生物合成等[16]。过量的ROS 水平则会对细胞产生严重的氧化应激,导致细胞成分(如DNA、蛋白质和脂质)受损,并最终导致细胞死亡[17]。本研究表明,圣草酚可升高H2O2诱导的Huh7细胞和PL 处理的Huh7 细胞移植瘤中ROS 水平和MDA 含量,降低SOD 活性。实际上,膜脂质的过氧化被认为是破坏氧化应激的首要目标,MDA 是脂质过氧化的主要产物[18]。SOD 是生物体内重要的抗氧化酶,可清除机体内氧自由基[19]。同时,本研究还表明,圣草酚可升高H2O2诱导的Huh7 细胞和PL处理的Huh7 细胞移植瘤细胞凋亡率。这说明圣草酚促进氧化应激诱导的肝癌Huh7 细胞凋亡,这与圣草酚可诱导肝癌HepG2 细胞的凋亡结果相一致[8]。
Nrf2信号传导途径是细胞防御系统最关键的途径之一,该途径调节了许多可以抵消氧化应激的抗氧化剂和细胞保护性基因的转录[20]。如,低聚原花青素通过Nrf2-ARE 途径保护A549细胞免受H2O2诱导的氧化应激[21]。Nrf2 表达于细胞质中,其在细胞核中的积累和激活有利于氧化损伤,也有利于癌细胞,是细胞氧化应激反应的关键因素[22]。在氧化应激期间,会激活复杂的氧化应激响应系统。特别是,Nrf2 暴露于亲电试剂或ROS 中,可以诱导一系列保护性蛋白,例如 HO-1 和 NQO1[23]。本研究表明,圣草酚抑制细胞核Nrf2、HO-1、NQO1蛋白表达,说明圣草酚促进氧化应激诱导的肝癌细胞和移植瘤细胞的凋亡与抑制Nrf2通路激活有关。
综上所述,圣草酚促进氧化应激诱导的肝癌细胞和移植瘤细胞的凋亡,并抑制Nrf2 通路激活,说明圣草酚具有治疗肝癌的潜在能力。但是本文仅是相关机制的初步探讨,具体的分子通路机制仍需进一步探讨。
