CSF-1及其受体在肿瘤微环境和免疫治疗中的研究进展①
2021-08-23沈婧怡蒿艳蓉广西中医药大学南宁530001
沈婧怡 蒿艳蓉(广西中医药大学,南宁530001)
肿瘤微环境是一个动态的网络,它由肿瘤细胞、免疫细胞、成纤维细胞、内皮细胞、细胞外基质、细胞因子、趋化因子和受体构成。这个网络的每一个元素都能够诱导肿瘤的恶性转化,促进肿瘤的发生和发展,并且保护肿瘤逃脱宿主免疫系统的灭杀。越来越多的证据显示,肿瘤微环境中的免疫细胞在促进肿瘤发生及进展过程中起到至关重要的作用[1]。在肿瘤发生及恶性进展过程中,肿瘤相关巨噬细胞(tumor-associated macrophage,TAM)、骨髓来源的抑制性细胞(myeloid-derived suppressor cells,MDSCs)和树突状细胞(dendritic cells,DCs)等肿瘤浸润的免疫炎症细胞发挥了重要的作用,它们能够在肿瘤微环境中促进肿瘤细胞恶化[2-4]。此外,它们还建立起了复杂的细胞间相互作用网络,有助于提高和维持免疫抑制性微环境,促进免疫逃逸,最终促进肿瘤的发展(图1)。
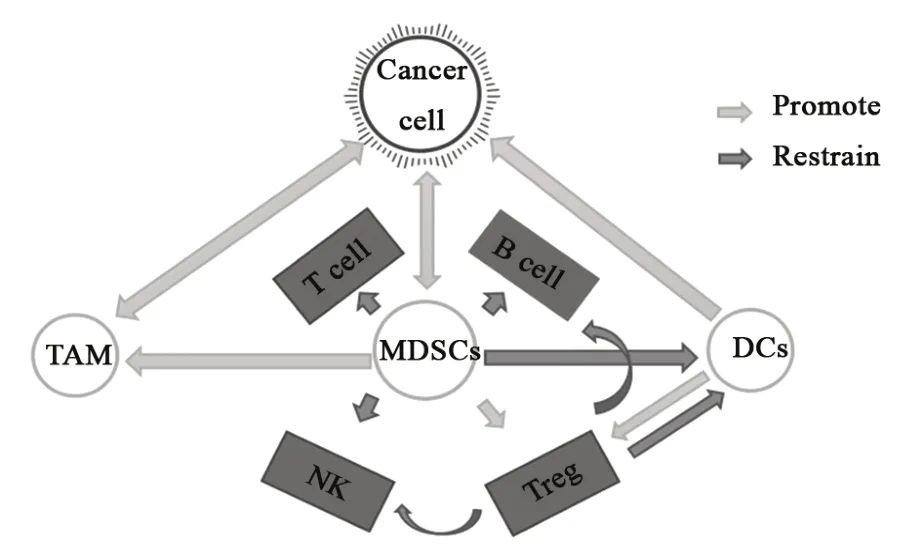
图1 肿瘤微环境中肿瘤与免疫细胞的相互作用网络Fig.1 Tumour-immune cell interaction network in tumor microenvironment
集落刺激因子-1(colony stimulating factor-1,CSF-1),又称巨噬细胞集落刺激因子(macrophage-Colony stimulating factor,M-CSF),长期以来被认为是调节TAM及其他单核吞噬细胞谱系细胞产生、分化和功能的主要生长因子,在多种组织和细胞中广泛表达。CSF-1及其受体(CSF-1R)的异常共表达,是促进肿瘤形成和进展的自分泌生长环,在支持肿瘤细胞存活、增殖和增强运动中发挥关键作用[5]。近年研究发现,CSF-1作为调控因子在DCs分化和MDSCs的产生、募集和功能中都发挥重要作用并能够影响免疫治疗的临床疗效。因此,本文主要通过阐述CSF-1/CSF-1R对免疫炎症细胞TAM、MDSCs和DCs的作用和在免疫治疗中的临床应用,对其在肿瘤微环境和免疫治疗中的最新研究进展做一综述。
1 CSF-1和CSF-1R
CSF-1基因位于人类1号染色体(1p13.3)上,编码554个氨基酸,分子量为60 179 D。活性形式是二硫键连接的同二聚体,可能由膜结合前体的蛋白水解产生,能够促进骨髓细胞(包括单核细胞、巨噬细胞和破骨细胞)的存活、增殖和分化[5]。有研究证实,CSF-1与肿瘤进展、转移、血管生成和治疗抵抗有关,其表达升高可能是肿瘤侵袭性增强的特征之一,并与癌症患者的生存率低有关[6]。
CSF-1R是一种酪氨酸激酶跨膜受体,主要表达于单核细胞系,也表达于其他几种细胞类型,如内皮细胞、滋养层细胞、神经祖细胞和上皮细胞,具有酪氨酸蛋白激酶的固有特异性[7]。目前已有多项研究证实,CSF-1R在肺癌、乳腺癌、卵巢癌等多种肿瘤组织中明显高表达,并与肿瘤进展密切相关[6-9]。一些临床前研究表明,CSF-1R在免疫系统中发挥重要的调节作用,能够通过诱导炎症细胞因子的生成,促进肿瘤细胞的增殖、分化、侵袭和转移。
CSF-1的多效作用都是通过其高亲和力受体CSF-1R和v-fms癌蛋白的细胞同系物转导的。CSF-1诱导的CSF-1R活化触发多个细胞内酪氨酸残基的自身磷酸化,导致一系列以磷酸酪氨酸为基础的信号级联反应的启动,而这些信号级联反应又介导了对CSF-1的各种各样的细胞反应,从而形成1个生长环,发挥其共同的生物学效应[10]。越来越多的证据表明,CSF-1与其受体之间的旁分泌相互作用在免疫抑制的肿瘤相关基质中发挥重要作用。同时,CSF-1/CSF-1R还可以自分泌信号传递给一些表达CSF-1R的上皮癌细胞,如乳腺癌细胞、卵巢癌细胞等,使其更具侵袭性和转移性。因此,在肿瘤微环境中,CSF-1具有自分泌和旁分泌的作用,能够赋予CSF-1R的上皮肿瘤细胞更具侵袭性的表型[11]。
2 CSF-1/CSF-1R在肿瘤微环境和免疫治疗中的研究进展
2.1 CSF-1/CSF-1R与TAM 巨噬细胞能够保护宿主免受感染和损伤,并促进组织重塑。然而,它们经常在病理环境中积累,包括癌症、动脉粥样硬化、代谢性疾病和脓毒症,并对宿主有害的微生物环境作出反应[12]。巨噬细胞的极化、活化有两种截然不同的极端状态:经典活化(M1)和交替活化(M2)巨噬细胞表型,M1巨噬细胞产生促炎细胞因子,提高诱导型一氧化氮合酶2(iNOS)和主要组织相容性复合体Ⅱ类(MHCⅡ)的表达,并具有抗肿瘤作用。而M2巨噬细胞主要由Th2细胞因子,如IL-4、IL-13、糖皮质激素以及CSF-1诱导,能够表达大量的抗炎细胞因子IL-10以及少量的IL-12,参与血管生成、组织重塑、伤口愈合以及抗炎等机体稳态过程[2]。
TAM是成熟的M2极化分型的巨噬细胞,来自由肿瘤部位的癌细胞和间质细胞产生的分子所招募的血液单核细胞。TAM通过分泌CSF-1,刺激巨噬细胞在肿瘤内聚集和移动,CSF-1与其受体CSF-1R结合后,能够促进人单核细胞存活和向巨噬细胞分化,使TAM的浸润增加,进一步促进肿瘤的侵袭、转移和血管生成[13-14]。CSF-1R信号的突变分析表明,CSF-1诱导运动的主要介质是磷脂酰肌醇-3激酶(PI3K)和一个或多个Src家族激酶(SFK),它们激活信号,使巨噬细胞黏附、肌动蛋白聚合、极化,最终迁移和侵袭,从而促进肿瘤的发生和发展[15]。
在肿瘤微环境中,CSF-1R相关性TAM可以促进慢性炎症的持续发生,导致正常细胞原癌基因发生突变产生致癌作用,在CSF-1R表达的TAM被耗尽或抑制后,血管生成减少,肿瘤进展延迟[5]。类似地,已经证明在小鼠肿瘤模型中,TAM的缺失会使肿瘤对过继转移的T细胞治疗和化疗敏感[16-17]。通过红细胞-癌细胞杂合膜将选择性CSF-1R抑制剂BLZ945靶向递送至TAM使其耗竭,能够升高CD8+T细胞比率,逆转肿瘤免疫微环境[18]。STEPHANIE等[19]在小鼠胶质瘤模型中使用BLZ945阻断CSF-1R信号,可以在不减少巨噬细胞数量的情况下,很好地重新编程巨噬细胞的反应,破坏M2巨噬细胞的促瘤功能,使已建立的肿瘤消退。总的来说,CSF-1/CSF-1R能够促进TAM的表达,通过使用CSF-1/CSF-1R抑制剂,便能够达到抑制TAM和肿瘤细胞侵袭和转移的目的。
2.2 CSF-1/CSF-1R与MDSCs MDSCs是骨髓来源的一群未成熟异质性细胞,在肿瘤、炎症和感染过程中不断扩增,具有对先天性和适应性免疫显著抑制的能力。通过提高精氨酸酶活性、增强NO和活性氧(reactive oxygen species,ROS)的产生来抑制T细胞的活化,参与肿瘤免疫逃逸的中心环节[3]。在炎症因子的刺激下,骨髓中产生的未成熟髓细胞(immature myeloid cells,IMCs)分化成MDSCs,防止免疫细胞对机体过度的伤害。但在癌症患者体内,肿瘤来源的CSF-1能够阻滞IMC的正常分化诱导其成为MDSCs,并在患者局部肿瘤组织内大量募集、活化,促进肿瘤细胞存活,抑制固有抗癌免疫和适应性抗癌免疫,导致局部免疫耐受,促进肿瘤进展[20-22]。近年来,大量证据支持MDSCs在肿瘤免疫抑制微环境中发挥关键作用,在肿瘤血管生成、耐药、促进肿瘤侵袭和转移等方面都具有重要作用[23-25]。
SAUNG等[26]在临床前模型中证实,抗CSF-1R抗体与胰腺癌疫苗GVAX联合治疗,可以靶向破坏MDSCs,并调节剩余髓样细胞向抗肿瘤表型发展,增强抗PD-1抗体的抗肿瘤活性。另外,在表达吲哚胺2,3-双加氧酶(IDO)的小鼠黑色素瘤模型中,使用PLX647靶向抑制CSF-1R信号转导消耗了超过65%的肿瘤浸润的MDSCs,导致肿瘤进展延迟。CSF-1R抑制剂能够使表达IDO的肿瘤对T细胞检查点阻断的免疫治疗敏感,并提高针对CTLA-4、PD-1和IDO抑制剂的免疫治疗效果[27-28]。因此,抑制CSF-1/CSF-1R信号可以在功能上阻断肿瘤浸润的MDSCs,增强抗肿瘤T细胞的反应,而靶向CSF-1/CSF-1R已成为降低MDSCs或抑制其促肿瘤功能的策略之一。
2.3 CSF-1/CSF-1R与DCs DCs是外周组织和免疫器官如胸腺、骨髓、脾脏和淋巴结中一种专门的抗原呈递细胞,具有独特的诱导T细胞活化和效应分化的能力,它们可以识别、摄取和处理病原体,并在MHC分子存在的情况下将抗原衍生的抗原肽呈递给淋巴组织中的初始T淋巴细胞。DCs可以启动各种类型的T细胞反应,其中一部分取决于DCs与T细胞相互作用的发育状态[29]。未成熟DCs(iDCs)在小鼠中表现为CD11c+MHCIIlowCD86low细胞,专门识别和处理抗原,但免疫刺激物功能较差,可能会诱导免疫耐受。因此,必须严格调控DCs的成熟,以保持适当的免疫平衡[30]。
目前,CSF-1已被证明除了能够诱导巨噬细胞的发育外,还能诱导正常小鼠和Flt3L敲除的小鼠DCs的发育。JOEY等[30]研究证实,MicroRNA-22、-34a和-155在成熟的MHCIIhiCD86hiDCs中上调,介导CSF-1R mRNA和蛋白的下调。体外实验抑制靶向CSF-1R的microRNAs,不仅可以维持高水平的CSF-1R蛋白表达,还可以在脂多糖的刺激下破坏DCs成熟。此外,通过进一步的研究发现,PI3K能够负向调控DCs的成熟,使用PI3K抑制剂治疗,可以逆转DCs发育过程中CSF-1R对其产生的阻滞作用。因此,CSF-1R介导的PI3K通路激活可能会阻断LPS诱导的DCs最终成熟,在肿瘤微环境中发挥重要作用。此外,研究发现,抑制CSF-1/CSF-1R信号和激活抗原提呈细胞(antigen presenting cells,APCs)与抗CD40激动剂联合治疗与临床前肿瘤模型中的单药治疗相比,具有更高的抗肿瘤疗效和生存率,这种联合方法促进了DCs的成熟和分化,并驱动效应T细胞的有效启动[31]。因此,下调CSF-1/CSF-1R的表达对DCs的最终成熟至关重要。
2.4 CSF-1/CSF-1R联合免疫检查点抑制剂治疗近十年来,基于对肿瘤免疫的更深入了解,肿瘤免疫疗法尤其是对免疫检查点抑制剂(immune checkpoint inhibitors,ICIs)的研究取得了巨大的进展。ICIs表现出强效的抗癌作用,可以阻断负性免疫共刺激通路,使肿瘤浸润淋巴细胞从衰竭状态重新激活[32]。目前,CTLA-4或PD-1/PD-L1的治疗抗体已被批准用于晚期黑色素瘤、肾细胞癌和非小细胞肺癌等多种恶性肿瘤的治疗[33-35]。然而,它们的临床效益却仅限于小部分患者,并且大多数患者会出现原发性或获得性耐药,因此,其耐药机制的鉴定和组合策略的开发对以上治疗方法的进一步改进至关重要。
多项研究证实,靶向CSF-1/CSF-1R的小分子抑制剂和抗体在临床研究中已显示出良好的抗肿瘤活性,并能够协同促进免疫检查点抑制剂的临床疗效。RIKKE等[20]研究发现,靶向CSF-1/CSF-1R联合CTLA-4阻断能较好地降低MDSCs在肿瘤中的蓄积量,协同抑制肿瘤生长,但只有在CTLA-4先于或同时阻断CSF-1/CSF-1R时才能看到效果。在一项研究中,SHI等[36]开发了一种CSF-1R抑制剂(PLX3397)、溶瘤病毒和抗PD-1抗体的组合。研究结果表明,三联治疗协同作用显著控制了肿瘤,延长了结肠癌小鼠模型的生存期。该联合治疗通过增加肿瘤中T细胞的浸润和增强抗肿瘤CD8+T细胞的功能,将免疫抑制肿瘤微环境重新编程为CD8+T细胞偏倚的抗肿瘤免疫,为临床联合治疗提供了强有力的策略。同样,在胰腺导管腺癌小鼠模型中,阻断CSF-1R能够上调包括PD-L1和CTLA-4在内的T细胞检查点分子,而PD-1和CTLA-4拮抗剂作为单一药物抑制PDAC生长的效果有限,但将这些药物与CSF-1R阻断剂联合使用,即使在已建立的肿瘤中,也能有效地诱导肿瘤消退[37]。以上研究表明,靶向CSF-1/CSF-1R联合ICIs治疗方法具有巨大的应用前景,在未来或许会成为一种新的治疗策略。
3 总结与展望
综上所述,CSF-1及其受体在肿瘤微环境中扮演着十分重要的角色。CSF-1与CSF-1R结合之后,不但能够促进髓样细胞增殖分化为TAM和MDSCs,还可以抑制LPS诱导的DCs最终成熟,从而影响肿瘤微环境,促进免疫逃逸,加速肿瘤进展。CSF-1/CSF-1R抑制剂的应用在很大程度上延缓了肿瘤的进展,并协同促进免疫治疗的临床疗效。目前,CSF-1/CSF-1R抑制剂的开发已经取得较大进展,但与其他治疗方法相结合的临床试验还正在进行之中,希望通过本课题组进一步的探究,能够制定出更多的治疗方案,提高临床疗效,改善预后,让更多患者从免疫治疗中获益,为恶性肿瘤患者带来新的希望。