IL-33在结肠癌患者中的表达水平及临床研究
2021-08-23王红敏北京市垂杨柳医院北京100022
王红敏 郭 瑛(北京市垂杨柳医院,北京100022)
结肠癌是一种临床常见消化系统的恶性肿瘤,随着近些年人们生活水平的逐渐提高以及人类饮食结构的改变,结肠癌的发生率、死亡率均明显升高,在消化系统恶性肿瘤中,结肠癌的发病率已跃居第三位,且该病的5年生存率仅为50%[1-2]。目前,对于结肠癌的治疗,临床主要有手术、化疗、放疗及分子靶向治疗等方式,随着肿瘤及免疫学研究进展,有望发现结肠癌新的治疗措施[3]。IL-33是近年发现的IL-1家族的一种新成员,由于其最早发现于小静脉高壁内皮细胞,所以又称为“高壁内皮细胞来源的核因子”[4]。有研究证实在多种慢性炎症发病过程中,IL-33表达明显增强,在多种恶性肿瘤(如卵巢癌、肺癌、乳腺癌及结肠癌等)的发病过程中,IL-33也高度表达,在肿瘤的临床诊断及评估预后中也是重要标志物,同时还有研究人员发现IL-33在抗肿瘤反应中起诱导作用,可称为新的抗肿瘤抑制剂[5-7]。可见,IL-33是一种双功能蛋白,既是一种诱发炎症反应的细胞因子,又是可调控转录的细胞核因子[8]。本次研究的目的在于探讨结肠癌患者其外周血内IL-33水平及其相关的临床意义。
1 资料与方法
1.1 资料 纳入2016年1月至2017年12月我院收入治疗的结肠癌患者进行研究。纳入标准:患者经临床病理诊断后确诊是结肠恶性肿瘤,病理类型均为结肠腺癌;患者既往无神经系统疾病、严重的器质性疾病及心理精神等疾病。排除标准:结肠恶性肿瘤的病理类型属于神经内分泌肿瘤或其他类型,不属于结肠腺癌的患者;出现严重的肝肾功能损伤或机体内环境紊乱者;近期曾服用精神类药品或对药物有过度依赖者;研究过程中自动退出者。根据上述标准,共纳入110例结肠腺癌患者作为观察组,同时选择同期来我院健康体检的100名成年人作为对照组。本研究已通过我院医学伦理委员会的审议,患者及其家属签署本次研究知情同意书。
1.2 方法
1.2.1 实验分组 收集两组成员基本临床资料(性别、年龄等),观察组按照Ducks癌症分期标准,A~B期63例,C~D期47例;根据国际抗癌联盟及美国癌症联合委员会制定的癌症TNM分期标准,Ⅰ~Ⅱ期52例,Ⅲ~Ⅳ期58例;有淋巴转移者49例,无淋巴转移者61例。根据观察组结肠腺癌的分化程度进行分级,若腺上皮细胞呈管状/乳头状排列,且未见明显的异性细胞,核分裂较少,为高分化(29例),若肿瘤细胞的排列呈实质状/片状,仅见灶性的腺样组织结构,见明显的异性细胞、核分裂较多且有坏死,为低分化(37例),介于以上两种分化程度的为中分化(44例)。观察组分为3个亚组,即高分化组29例、中分化组44例、低分化组37例。
1.2.2 ELISA和免疫组化实验检测IL-33水平及IL-33、IFN-γ、IL-4表达的数目 抽取观察组与对照组的空腹静脉血各5 ml,采用ELISA检测外周血中IL-33水平。观察组接受手术切除治疗,术中切取肿瘤病理组织,制作切片并分别进行免疫组化染色,染色后进行封片,在显微镜下观察,以500个细胞为1个计数单位,记录其中IL-33、IFN-γ、IL-4呈阳性表达的数目。在结肠癌的肿瘤组织内,上述几种细胞因子呈阳性的细胞主要在细胞质内表达,呈现浅黄色或者棕黄色。具体计分标准:细胞未染色者为0分,细胞呈较少的淡黄色为1分,细胞呈较多的棕黄色为2分,细胞呈大量的深棕色为3分。在显微镜下观察时,每500个细胞视野内,染色细胞数<30%者记1分,30%≤染色细胞数<76%者记2分,染色细胞数≥76%者记3分。以上两项得分相乘,0分者为“-”,1~4分者为“+”,大于4分者为“++”,“-”为IL-33阴性,“+”及“++”为IL-33阳性。
1.2.3 观察组患者术后随访 对观察组患者术后进行为期2年的随访,统计观察组患者不同TNM分期术后2年的死亡率,对影响结肠腺癌患者预后的因素进行Logistic回归分析。
1.3 统计学分析 本项研究中的相关数据应用SPSS22.0统计学软件处理及分析。经检测,本研究中所有计量资料均符合正态分布,计量资料以±s的形式表示,比较时使用t检验法;计数资料进行比较采用χ2,多因素回归分析使用Logistic法,以P<0.05为差异具有统计学意义。
2 结果
2.1 比较两组患者的临床相关资料及血清IL-33水平 两组患者性别、年龄均差异无统计学差异(P>0.05),观察组血清IL-33水平为(44.23±11.31)pg/ml,明显高于对照组(28.35±7.86)pg/ml,P=0.000,差异具有统计学意义,见表1。
表1 两组患者的临床相关资料及血清IL-33水平(±s)Tab.1 Clinical data and serum IL-33 level were compared between two groups(±s)
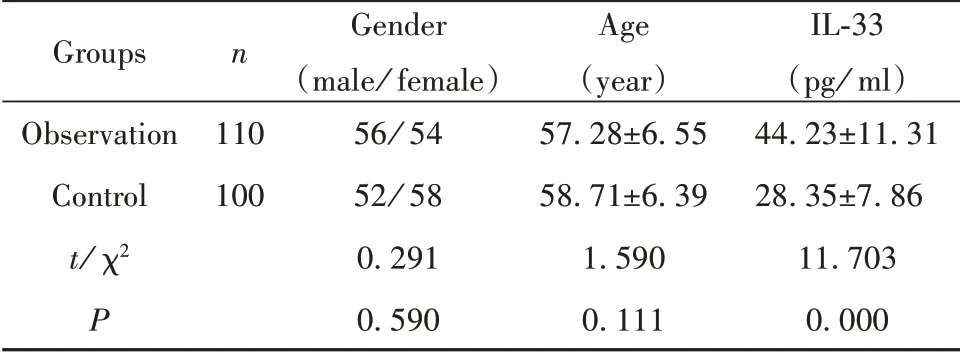
表1 两组患者的临床相关资料及血清IL-33水平(±s)Tab.1 Clinical data and serum IL-33 level were compared between two groups(±s)
Groups Observation Control t/χ2 P n 110 100 Gender(male/female)56/54 52/58 0.291 0.590 Age(year)57.28±6.55 58.71±6.39 1.590 0.111 IL-33(pg/ml)44.23±11.31 28.35±7.86 11.703 0.000
2.2 比较观察组血清IL-33水平与结肠腺癌临床病理特征相关性 观察组血清IL-33水平与患者的年龄、性别无关,与肿瘤病理分期及淋巴结转移有关,T3~4期的IL-33水平明显高于T1~2期(P<0.05),TNMⅢ~Ⅳ期的IL-33水平明显高于Ⅰ~Ⅱ期(P<0.05),有淋巴结转移的IL-33水平明显高于无淋巴结转移(P<0.05),见表2。
表2 观察组血清IL-33水平与结肠腺癌临床病理特征相关性(±s)Tab.2 Correlation between serum IL-33 level and clinicopathological characteristics of colon adenocarcinoma in observation group(±s)

表2 观察组血清IL-33水平与结肠腺癌临床病理特征相关性(±s)Tab.2 Correlation between serum IL-33 level and clinicopathological characteristics of colon adenocarcinoma in observation group(±s)
Clinicopathological characteristics Age(year)<60≥60 Gender Male Female Tstage T1~2 T3~4 TNMstageⅠ~ⅡⅢ~ⅣLymph node metastasis Yes No n 48 62 56 54 59 51 52 58 49 61 IL-33(pg/ml)45.48±9.16 42.34±8.24 48.32±8.71 46.05±8.63 38.18±7.62 45.35±8.44 40.31±9.17 46.47±8.62 45.88±5.92 43.19±6.27 t 1.888 1.373 4.682 3.631 2.307 P 0.062 0.173 0.000 0.000 0.023
2.3 免疫组化检测观察组不同病理特征患者IL-33表达水平 免疫组化法检测观察组肿瘤组织IL-33阳性表达细胞数,发现肿瘤分化程度较低、临床分期较高的患者肿瘤组织中IL-33阳性表达数目较高,见表3。
表3 免疫组化检测观察组不同病理特征患者IL-33表达水平(±s)Tab.3 Expression levels of IL-33 in patients with different pathological characteristics were detected by immunohistochemistry(±s)

表3 免疫组化检测观察组不同病理特征患者IL-33表达水平(±s)Tab.3 Expression levels of IL-33 in patients with different pathological characteristics were detected by immunohistochemistry(±s)
Note:Compared with high differentiated tumors,1)P<0.05;compared with low differentiated tumors,2)P<0.05.
Pathological characteristics Degreeof tumor differentiation Low differentiation Moderatedifferentiation High differentiation Tstage T1~2 T3~4 Nstage N0 N1~2 TNMstageⅠ~ⅡⅢ~Ⅳn 37 44 29 59 51 67 43 52 58 IL-33 positive cell number 4.94±2.31 3.19±2.11 2.15±1.39 2.45±1.62 4.17±2.37 2.11±1.70 3.99±.23 2.47±1.72 4.27±2.14 t 5.736 2.338 4.492 5.002 4.731 P 0.0002)0.0001)0.000 0.000 0.000
2.4 免疫组化检测观察组3个亚组IL-33、IL-4、IFN-γ表达水平比较 观察组3个亚组中IL-33、IL-4表达水平为低分化组>中分化组>高分化组(P<0.05),IFN-γ表达水平无明显差异(P>0.05),见表4。
表4 免疫组化检测观察组3个亚组IL-33、IL-4、IFN-γ表达水平比较(±s)Tab.4 Comparison of expression levels of IL-33,IL-4 and IFN-γin three subgroups of observation group by immunohistochemistry(±s)

表4 免疫组化检测观察组3个亚组IL-33、IL-4、IFN-γ表达水平比较(±s)Tab.4 Comparison of expression levels of IL-33,IL-4 and IFN-γin three subgroups of observation group by immunohistochemistry(±s)
Note:Compared with high differentiated tumors,1)P<0.05;compared with low differentiated tumors,2)P<0.05.
Groups Low differentiation Moderate differentiation High differentiation n 37 44 29 IL-33 positive cell number 4.94±2.311)3.19±2.112)2.15±1.39 IL-4 positive cell number 10.84±2.02 1)8.36±1.80 2)6.02±1.05 IFN-γpositive cell number 24.81±5.43 24.66±4.80 25.40±5.61
2.5 术后2年随访并统计观察组患者死亡率 术后2年随访发现,观察组肿瘤组织病理分期越高的死亡率越高,见表5。
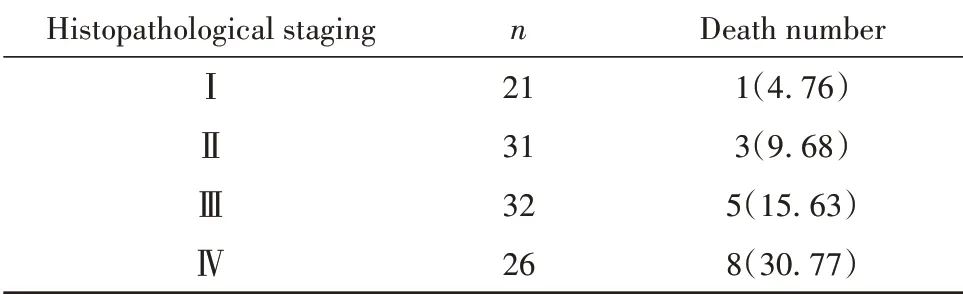
表5 术后2年随访并统计观察组结肠腺癌患者死亡率[例(%)]Tab.5 Mortality rate of patientswith colorectal adenocarcinoma in observation group was statistically analyzed after 2 years of follow-up[n(%)]
2.6 影响结肠腺癌患者预后的多因素回归分析Logistic多因素回归分析,IL-33水平是影响结肠腺癌患者预后的独立危险因素,见表6。

表6 影响结肠腺癌患者预后的多因素回归分析Tab.6 Multivariate regression analysisof prognosis in patients with colon adenocarcinoma
3 讨论
IL-1家族新成员IL-33在巨噬细胞、上皮细胞、肥大细胞及内皮细胞等多种细胞中均可表达,当机体细胞受损时会有大量IL-33生成,IL-33亦称“警戒素”,在多种慢性炎症,如关节炎、结肠炎、哮喘等发病过程中大量表达[9]。由于细胞类型的差别,IL-33可诱发多种炎症反应,如IL-33诱导机体肥大细胞产生IL-4、IL-5、IL-6等多种细胞因子,诱导Th2淋巴细胞生成IL-5和IL-13等细胞因子[10-11]。大量研究证实,机体慢性炎症与肿瘤的发病具有相关性,在肿瘤发生的炎症微环境中,IL-33是主要成分并可进一步诱发肿瘤[12-13]。有研究人员在乳腺癌动物模型中发现IL-33诱导IL-10、IL-13及调节性T细胞(Treg)的生成,加重肿瘤的发展浸润[14];在胃癌动物模型中,IL-33增加IL-6及金属蛋白酶(MMP-3)的分泌,诱发癌细胞浸润转移[15]。
本研究对比结肠癌患者与健康人血清中IL-33水平,发现IL-33在结肠癌患者中表达明显升高;血清IL-33水平在不同年龄、不同性别的结肠癌患者之间无显著差异;根据结肠癌患者肿瘤分化程度及TNM分期不同,进一步比较亚组患者血清中IL-33水平,发现肿瘤分化程度较低、临床病理分期较高的患者血清IL-33明显升高。免疫组化法对观察组结肠癌患者的肿瘤组织进行检测,发现随着结肠癌患者肿瘤组织的分化程度降低、临床病理分期较高的患者肿瘤组织中IL-33阳性表达数目较高。术后2年随访发现,肿瘤组织病理分期较高的死亡率随之增高。
恶性肿瘤的发生与机体免疫系统Th1/Th2细胞失衡有关,肿瘤细胞的分化可抑制Th1型细胞因子的分泌、促进Th2型细胞因子的生成,导致免疫逃逸及Th1/Th2失衡[16]。关于IL-33在机体免疫系统中发挥作用的相关研究,发现IL-33是促进Th2型细胞因子生成的诱导剂,IL-33可抑制钙黏蛋白在肿瘤细胞间的表达,并对肿瘤血管内皮细胞分化、增殖具有较强的刺激作用,促进血管的形成[17-18]。ST2是一种在Th2细胞中大量表达的IL-33受体,有研究发现IL-33由IL-33/ST2L信号通路诱导恶性肿瘤的发生,同时激活自然杀伤性细胞相关通路、促进Th2型细胞因子的表达[19-20]。Th1型细胞因子主要有IFNγ、IL-12,Th2型细胞因子主要有IL-4、IL-10等。为进一步研究和探讨IL-33引发结肠癌的免疫学机制,本研究发现,IL-33、IL-4表达水平随观察组患者分化程度的不同而有明显差异,IL-33、IL-4表达水平为低分化组>中分化组>高分化组。可见,分化程度越低的结肠癌患者,IL-33、IL-4表达水平越高,IL-33促进Th2型细胞因子的分泌及Th1/Th2失衡,与前人研究一致。
综上,本研究发现在结肠癌患者外周血中IL-33水平明显升高,IL-33与结肠癌病情程度呈正相关,IL-33的检测对结肠癌的诊断具有积极意义,但是,近年随着对IL-33研究的深入,发现IL-33能诱导机体CD8+T细胞分泌IFN-γ,提高机体免疫应答反应,对肿瘤的监测及抑制具有积极作用,有学者在肺癌动物模型体内发现IL-33的表达能抑制肿瘤细胞的生长及转移[19-20]。关于IL-33在肿瘤中作用的相关研究目前尚未有定论,在不同的肿瘤组织中,IL-33发挥的作用不同,仍有待进一步的研究。