牛膝总皂苷体外干预膝关节炎软骨细胞增殖与凋亡的研究
2021-08-23陈浩雄徐启良黄竞杰林新珍徐宁达
陈浩雄,徐启良,黄竞杰,林新珍,徐宁达
(广州中医药大学深圳医院(福田),广东 深圳 518034)
膝骨关节炎是骨科临床很常见的退行性、进展性疾病,病理改变以关节软骨退变、皱缩、溃疡为特征。软骨细胞及细胞外基质组成关节软骨,生物学因素或力学因素可导致软骨细胞合成和凋亡平衡的破坏,造成软骨细胞减少和软骨基质破坏,最终导致关节炎发生[1]。 目前研究认为多种细胞因子参与关节软骨的合成与分解,其中白细胞介素-1(IL-1)、肿瘤坏死因子-α(TNF-α)的分泌失常与关节软骨的破坏及修复密切相关,因此抑制炎症因子的异常表达显得尤为重要。目前临床中所使用的治疗关节炎的药物主要为非甾体消炎止痛药减缓控制炎症的进展,氨基葡萄糖、玻璃酸钠等营养关节软骨,结合非药物疗法如肌力锻炼、控制体重、局部理疗等减缓关节软骨损伤、退变,但尚不能根治。膝骨关节炎属中医“膝痹病”,从中医辨证多为肝肾不足、气滞血瘀,治疗以补肝肾、强筋骨、活血通络为法。前期研究证实,牛膝提取物能促进兔骨关节炎模型骨髓间充质干细胞软骨分化,促进关节软骨修复,且牛膝总皂苷含药血清体外能促进软骨细胞增殖[2-3]。本实验进一步观察了不同浓度牛膝总皂苷对膝骨关节炎软骨细胞增殖及凋亡和炎性因子IL-1、TNF-α表达的影响,以探讨单味中药体外干预对骨关节炎软骨退变的作用,现将结果报道如下。
1 实验材料与方法
1.1试剂与仪器 DMEM:F12(1∶1)培养基(Gibco);倒置相差显微镜(OLYMPUS);流式细胞仪(BD);DAPI染液(碧云天生物研究所);抗荧光衰减封片剂(碧云天生物研究所);倒置荧光显微镜(DM16000B,Leica);胎牛血清(FBS)(Gibco);10%甲醛标本固定液;CO2培养箱(Thermo Fisher公司);CCK-8试剂盒(CK04,东仁化学);0.25%胰蛋白酶(含EDTA)(Gibco);Collagen Ⅱ抗体(abcam);牛膝总皂苷(深圳市中医院药剂科制备);甲苯胺蓝染色液Annexinv-pe/7-AAD流式凋亡检测试剂盒(凯基生物),流式细胞生物仪(BD),离心机(Thermo Fisher公司)。
1.2关节软骨取样 取3例女性晚期膝骨关节炎行膝关节置换患者的膝软骨细胞组织,征得参与研究的患者知情同意。
1.3方法
1.3.1人软骨细胞原代培养 将获取的软骨组织先用PBS(含双抗)漂洗3次,用显微手术剪将附着软骨块的软组织剪除,剪碎软骨块面积约1 mm3。用DMEM/F-12完全培养基(含10% FBS、及1%双抗),在温度37 ℃、5% CO2培养箱中培养人膝骨关节炎软骨细胞。每天用倒置显微镜观察细胞1次,每2~3 d换液1次。培养瓶中的细胞生长到80%左右时,消化收集细胞,转移至无菌离心管中,1 000 r/min离心4 min,弃上清液,以1∶3比例转移培养。
1.3.2不同浓度牛膝总皂苷培养基的制备 10 mg/mL牛膝总皂苷储存液:称取10 mg牛膝总皂苷,加入1 mL D/F12完全培养基溶解,过滤除菌后于-20 ℃保存。1 mg/mL 牛膝总皂苷D/F12培养基配制:取一无菌EP管,加入0.9 mL D/F12完全培养,再加入0.1 mL含10 mg/mL牛膝总皂苷储存液,混匀,即可;按相同方法比例,再分别制备0.5 mg/mL、0.1 mg/mL、0.05 mg/mL、0.01 mg/mL牛膝总皂苷D/F12培养基。
1.3.3CCK-8检测细胞增殖能力 实验分为空白组、牛膝总皂苷0.01 mg/mL组、牛膝总皂苷0.05 mg/mL组、牛膝总皂苷0.1 mg/mL组、牛膝总皂苷0.5 mg/mL组、牛膝总皂苷1 mg/mL组。收集对数生长期人膝骨关节炎软骨细胞,计数,用D/F12完全培养基使软骨细胞悬浮,调整细胞浓度1×105个/mL,于96孔板中接种,各孔加0.1 mL细胞悬液,在37 ℃,5% CO2条件下孵育过夜。牛膝总皂苷各组给予相应浓度牛膝总皂苷干预,于37 ℃、5% CO2条件下继续培养,于酶标仪450 nm处测定培养1,3,5,7 d后OD值,绘制软骨细胞生长曲线。
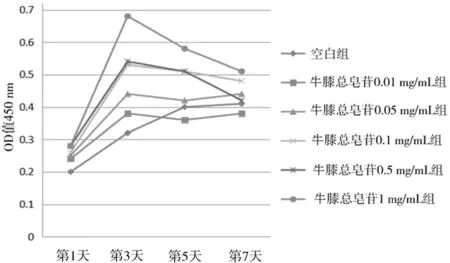
图1 各组膝骨关节炎软骨细胞培养不同时间点增殖情况
1.3.4Annexin V-FITC/PI检测细胞凋亡情况 按照1.3.3方法分组干预3 d后,依次添加PI染液、Binding Buffer、Annexin V-FITC摇匀,室温,避光反应5~15 min。用流式细胞仪检测,激发波长Ex=488 nm,发射波长Em=530 nm,Annexin V-FITC荧光信号呈绿色,使用FL1通道检测;激发波长Ex=488 nm,发射波长Em≥630 nm,PI红色荧光用FL3通道检测。
1.3.5IL-1β、TNF-α检测 按照1.3.3方法分组干预72 h, 应用放射免疫分析法检测IL-1β水平,应用ELISA法检测TNF-α水平,具体步骤按试剂盒说明书进行,每份标本至少测定3次, 取平均值。

2 结 果
2.1各组膝骨关节炎软骨细胞增殖情况 各组细胞培养第1~3天为对数增殖期;牛膝总皂苷各组第3天达到高峰(空白组第5天达到高峰),第3~5天进入平台期,之后呈下降趋势,牛膝总皂苷0.5 mg/mL组各时间点细胞增殖OD值均明显高于其他组(P均<0.05)。见图1。
2.2各组膝骨关节炎软骨细胞凋亡情况 培养3 d后,牛膝总皂苷0.01 mg/mL和0.05 mg/mL组早期细胞凋亡率、晚期细胞凋亡率、总凋亡率与空白组比较差异均无统计学意义(P均>0.05);牛膝总皂苷0.1 mg/mL、0.5 mg/mL、1 mg/mL组早期细胞凋亡率、晚期细胞凋亡率、总凋亡率均明显低于空白组(P均<0.05),牛膝总皂苷0.5 mg/mL组细胞总凋亡率明显低于牛膝总皂苷0.1 mg/mL和1 mg/mL组(P均<0.05)。 见图2及表1。
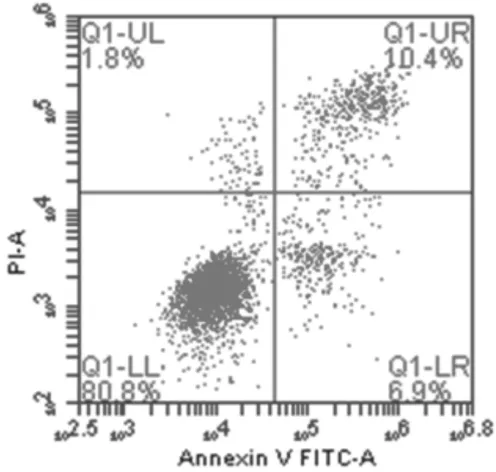
空白组
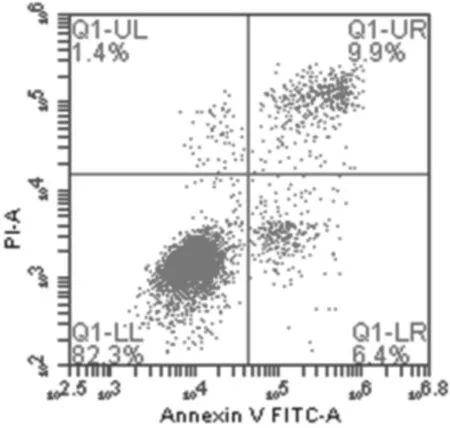
牛膝总皂苷0.01 mg/mL组
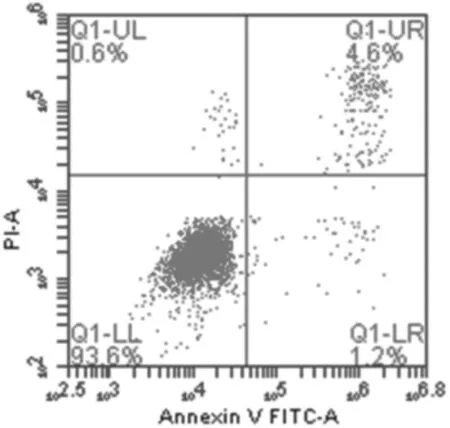
牛膝总皂苷0.1 mg/mL组

牛膝总皂苷0.5 mg/mL组
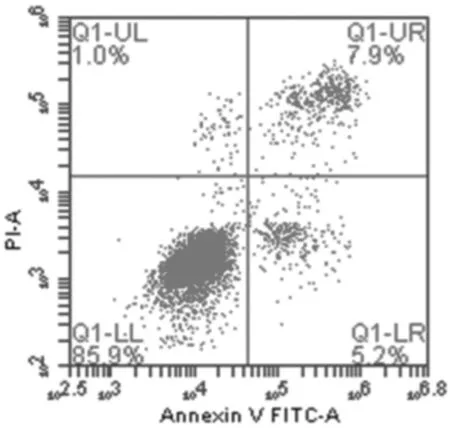
牛膝总皂苷0.05 mg/mL组

牛膝总皂苷1 mg/mL组
表1 各组干预3 d后人膝骨关节炎软骨细胞凋亡率比较
2.3各组膝骨关节炎软骨细胞中IL-1β、TNF-α表达水平 干预72 h,牛膝总皂苷各组IL-1β、TNF-α水平均明显低于空白组(P均<0.05),且牛膝总皂苷浓度越高,IL-1β、TNF-α水平越低,各组间两两比较差异均有统计学意义(P均<0.05)。见表2。

表2 各组人膝骨关节炎软骨细胞培养上清液中IL-1β、TNF-α水平比较
3 讨 论
膝骨关节炎是慢性炎性进展性疾病,其发病机制尚不明确。目前研究认为IL-1、TNF-α是引起关节炎炎性变及软骨基质破坏的重要细胞因子,特别是IL-1能抑制软骨细胞合成蛋白多糖和Ⅱ型胶原,为降解软骨细胞外基质的重要炎性介质[4],其能促进基质金属蛋白酶(MMPs)合成,同时通过胞浆素原激活物的分泌,促进MMPs活化,并抑制胞浆素原激活物抑制物的合成,导致软骨的破坏[5]。Osta等[6]研究认为TNF-α和IL-1β具有抑制软骨合成、加快关节软骨降解的作用,在膝骨关节炎发病过程中起到重要介导作用。
目前膝骨关节炎的治疗方法有限,其中非甾体消炎止痛药虽可明显缓解疼痛,但存在明显胃肠道反应;盐酸或硫酸氨基葡萄糖起效慢、疗程长,是否能减慢疾病的进展尚不明确;玻璃酸钠对早、中期患者有一定效果,但其在保护软骨和减慢疾病进程中的作用不大;糖皮质激素短期应用可明显缓解病情,但频繁使用会加重关节软骨的损伤及导致全身损害;膝关节置换是终极疗法,术后有并发症,多数患者并不适用[7]。
中医治疗骨关节炎以补肝肾、强筋骨,活血化瘀通络止痛为法[8]。《本草经》中记载牛膝能“主寒湿痿痹,四肢拘挛,膝痛不可屈伸”,是治疗膝痹的有效药物,也是中医补肾活血法的代表药物之一[9-10]。其有效成分有多糖类、皂苷类、甾酮类等[11],其中皂苷类具有促进软骨细胞增殖和抗软骨细胞凋亡的作用[12-13]。余阗等[14]证实牛膝总皂苷能减轻兔骨关节炎滑膜病变,同时能明显降低关节液中TNF-α、IL-1β等炎症因子含量。廖州伟等[15]和胡烈奎等[16]研究发现牛膝醇提物、牛膝含药血清可以明显促进膝关节炎软骨细胞增殖及抑制其凋亡。孙雪莲等[17]研究发现牛膝总皂苷能够上调兔膝骨关节炎关节液中TGF-β1的表达而下调IL-1β的表达,减轻关节软骨损伤。以上研究表明牛膝有利于抑制膝骨关节炎炎症的进展并对关节软骨有修复作用。
本课题组前期研究证实补肾活血中药可通过抑制NF-κB信号通路从而降低IL-1和TNF-α水平,减轻患膝关节疼痛,改善膝关节功能[18]。本实验结果显示,0.05,0.1,0.5,1.0 mg/mL牛膝总皂苷体外培养人膝关节软骨细胞能够明显促进软骨细胞增殖,增殖高峰出现在干预后的第3天,最佳浓度为0.5 mg/mL;且随着牛膝总皂苷浓度增高,细胞凋亡减少,0.5 mg/mL时凋亡最少,1.0 mg/mL时凋亡又增加;IL-1、TNF-α水平随着牛膝总皂苷浓度的升高而逐渐降低。提示不同浓度的牛膝总皂苷在体外干预膝骨关节炎软骨细胞,能促进软骨细胞增殖和抑制其凋亡,且与浓度有关。在目前倾向于体外用药、局部用药的大环境下,本次实验为关节腔注药治疗骨关节炎提供了实验依据及可能性。然而,药物的干预与细胞受体的数目、信号通路的类型及软骨细胞的生存环境等有关,高浓度的牛膝总皂苷很可能会改变软骨细胞的最佳生存环境,进而影响细胞的增殖与凋亡,这仍需进一步深入研究其作用机制。
利益冲突:所有作者均声明不存在利益冲突。
