基于网络药理学研究人参治疗心肌纤维化的相关机制
2021-08-23刘孟楠何清位杨思进
刘孟楠,罗 钢,何清位,刘 平,刘 颜,杨思进*
(1.国家中医药临床研究基地及心血管内科,西南医科大学附属中医医院,泸州646000;2.澳门科技大学中医药学院,氹仔999078)
慢性心脏病是目前最常见的重大疾病之一。2019年发布的《中国心血管健康与疾病报告》显示2017年我国心血管疾病死亡人数占比高达31%[1]。心肌纤维化(myocardial fibrosis,MF)是慢性心脏病的主要病理改变,表现为心肌成纤维细胞过度增殖以及细胞外基质过度沉积[2]。MF不仅是导致心力衰竭的一个主要原因,而且与心血管死亡风险直接相关。目前常规治疗方案虽能缓解慢性心脏病的临床症状,但由于引起心肌纤维化的因素繁多、机制欠清,尚缺乏有效阻逆心肌纤维化的药物[3]。近年来中医药治疗MF的实验研究不断深入,阻止甚至逆转MF的发展是研究的一致目标,分子生物水平及基因领域的探索也日趋深入。MF的中医病机属本虚标实、久病入络,本虚为阴阳亏虚,标实为痰浊、瘀血等[4]。人参是常见的滋补类药物,在虚症及急症中运用广泛,其提取物人参皂苷及多糖等为主要有效成分,其有效成分在治疗MF方面疗效显著[5-7]。
中草药人参为五加科植物人参(Panax ginsengC.A.Mey)的根,是补气的常用药物。人参因集中制作的方法、栽培技术不同、产地区别而有别直参(朝鲜参、高丽参)野山参、红参等不同名称[8]。“人参味甘,主补五脏、安精神、定魂魄,止惊悸,除邪气,明目、开心、益智,久服轻身延年”是《神农本草经》对人参功效的描述[9]。《本草纲目》亦记载人参能“治男女一切虚症”[10]。人参在食疗保健上可调理亚健康状态,是一种滋补强壮药,现代研究表明人参对于治疗心血管疾病、糖尿病、神经衰弱症、癌症等均有一定的疗效[11-13]。虽然人参在治疗心衰、心肌病及改善MF上具有比较明确的效果,但其潜在的分子机制尚待进一步研究探讨。
由于中药多成分、多途径和多靶点的特点,很难明确药效物质基础及作用机制,其作用机制的研究主要停留在疗效性指标层面,应用网络药理学方法的研究较少。因此,本研究旨在运用网络药理学方法寻找人参中具有类药性、口服吸收较好的成分,并预测这些成分治疗MF的作用靶点及相关通路,为深入研究人参及其中药复方治疗MF的作用提供参考。
1 材料和方法
1.1 人参化学成分的收集和筛选
中药系统药理学数据库和分析平台(Traditional Chinese Medicines Systems Pharmacology Platform,TCMSP)(https://tcmspw.com/tcmsp.php)是基于系统药理学收录《中国药典》收录的中药材的作用靶点、成分、药物关键参数的平台,可用于中药材药动学、靶标预测等分析,借助平台信息可以从整体水平研究药物靶标网络和疾病网络,从而揭示中药性质与作用机制[14]。从TCMSP数据库获取人参的化学成分,输入关键词“人参”,得到活性成分信息。本研究通过筛选出同时满足生物利用度(Oral bioavailability,OB)≥30%和类药性(Drug-likeness,DL)≥0.18的化学成分以及文献报道的有活性的成分。
1.2 预测潜在靶点
利用TCMSP数据库检索出人参的活性成分的作用靶点,作为候选药物靶点。然后,通过Uniprot数据库(https://www.uniprot.org/)将所的药物靶点转换成基因名称[15]。以“myocardial fibrosis”为关键词,通过在GeneCards(https://www.genecards.org/)收集与MF相关的基因,将挖掘得到的MF相关基因与药物靶点基因映射筛选出共同靶点,从而得到人参活性成分治疗MF的目标作用靶点。
1.3 活性成分-疾病靶点构建
将候选化学成分与MF靶点通过Cytoscape3.8.2建立人参的化合物-MF靶点群网络,节点(node)代表药物化学成分与潜在作用靶点;边(edge)展现了人参有效成分和其作用靶点之间的联系,根据化合物与靶点连接情况筛选出人参作用于MF的关键化合物。
1.4 靶蛋白相互作用(PPI)网络构建
为分析人参治疗MF靶蛋白之间的相互作用,以STRING数据平台(https://string-db.org/)构建人参治疗MF靶蛋白PPI网络。将药物-疾病交集靶点导入STRING数据库,物种设为“homo sapiens”(人类),最低相互作用阈值设为中等置信度0.4“medium confidence”,勾选“hide disconnected nodes in the network”以隐藏游离点,其余参数保持默认设置,得到蛋白相互作用网络关系,结果保存成PNG及TSV格式。TSV文件与R语言链接并使用barplot包进行编译,以各基因连接节点数量为变量绘制PPI网络核心基因柱状图。
1.5 GO功能分析和KEGG通路富集分析
将药物-疾病交集基因导入DAVID 6.8数据库(https://david.ncifcrf.gov/),输入靶基因名称列表,限定物种为“Homo Sapiens”,将靶点基因修正为官方名称,得到基因的ID,设定阈值P<0.05,进行基因本体(Gene Onotology,GO)生物过程富集分析和KEGG(Kyoto Encyclopedia of Genes and Genomes)通路富集分析,结果用R语言制作柱状图及气泡图。
2 结果
2.1 候选化合物及靶点的筛选
TCMSP数据库中,获得化合物190个,以OB≥30%,DL≥0.18作为筛选条件,得到候选成分21个,结果见表1。逐一对应靶点,得到256个靶点。
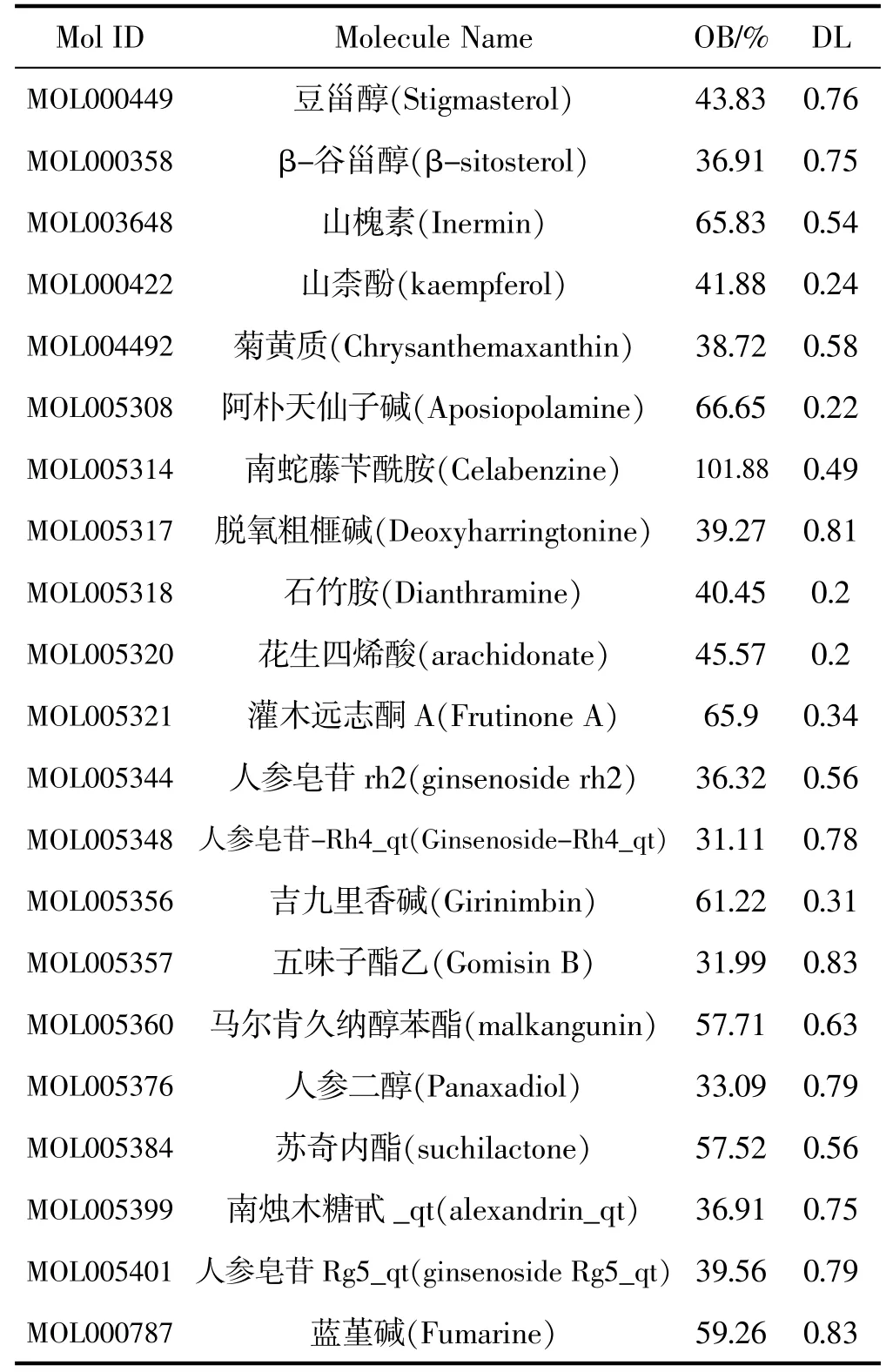
表1 人参候选化合物成分
2.2 疾病靶点获取结果
从GeneCards数据库中检索到个3125个MF相关靶点基因。
2.3 网络构建及分析结果
将256个化合物靶点与3125个MF相关靶点基因进行映射,得到38个共同靶点基因,对应人参17个候选化合物。利用cytoscape3.8.2软件构建中药化合物-靶点相互作用网络。详见图1。
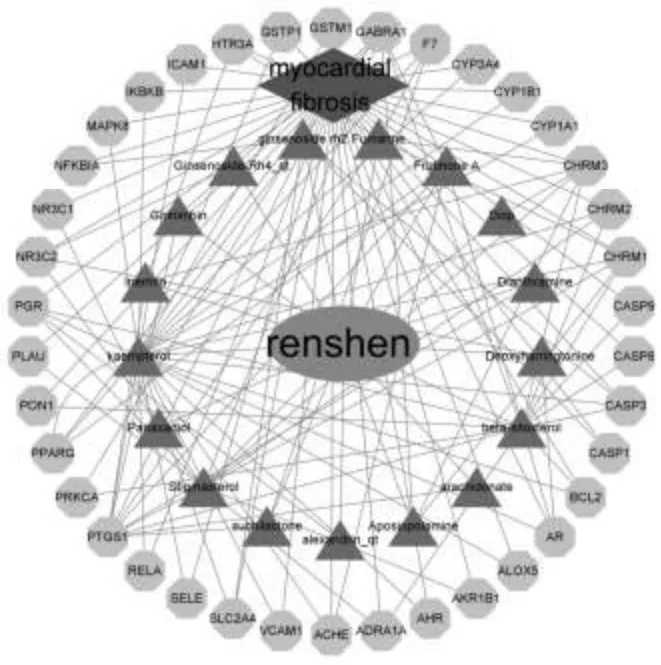
图1 人参有效成分-靶点网络图
蓝色椭圆形为药物,红色菱形为疾病,绿色六边形为药物,紫色三角形为药物有效成分。
2.4 靶蛋白相互作用网络的构建及关键靶点筛选
将映射得到的38个交集靶点基因导入STRINGS数据库进行PPI网络分析,得到蛋白相互作用网络图,如图2示,除去1个游离节点后,PPI网络包含37个靶蛋白节点,共有151条边代表了蛋白之间互作用,处于该蛋白质-蛋白质相互作用网络中心的蛋白质包括B淋巴细胞瘤-2基因(B-cell lymphoma-2,BCL2),含半胱氨酸的天冬氨酸蛋白水解酶(cysteinyl aspartate specific proteinase,Caspase)1/3/8/9,丝裂原激活蛋白激酶8(Recombinant Mitogen Activated Protein Kinase 8,MAPK8)和B细胞κ轻肽基因增强子核因子抑制因子(αnuclear factor of kappa light polypeptide gene enhancer in Bcells inhibitor,NFKBIA)等,这些关联的基因或蛋白可能是人参治疗MF的重要靶点。这些蛋白之间的相互作用在网络中非常重要,通过计算每个因的连接节点数目,找出前15个PPI核心基因,这些即为人参治疗MF的核心基因。详见图3。
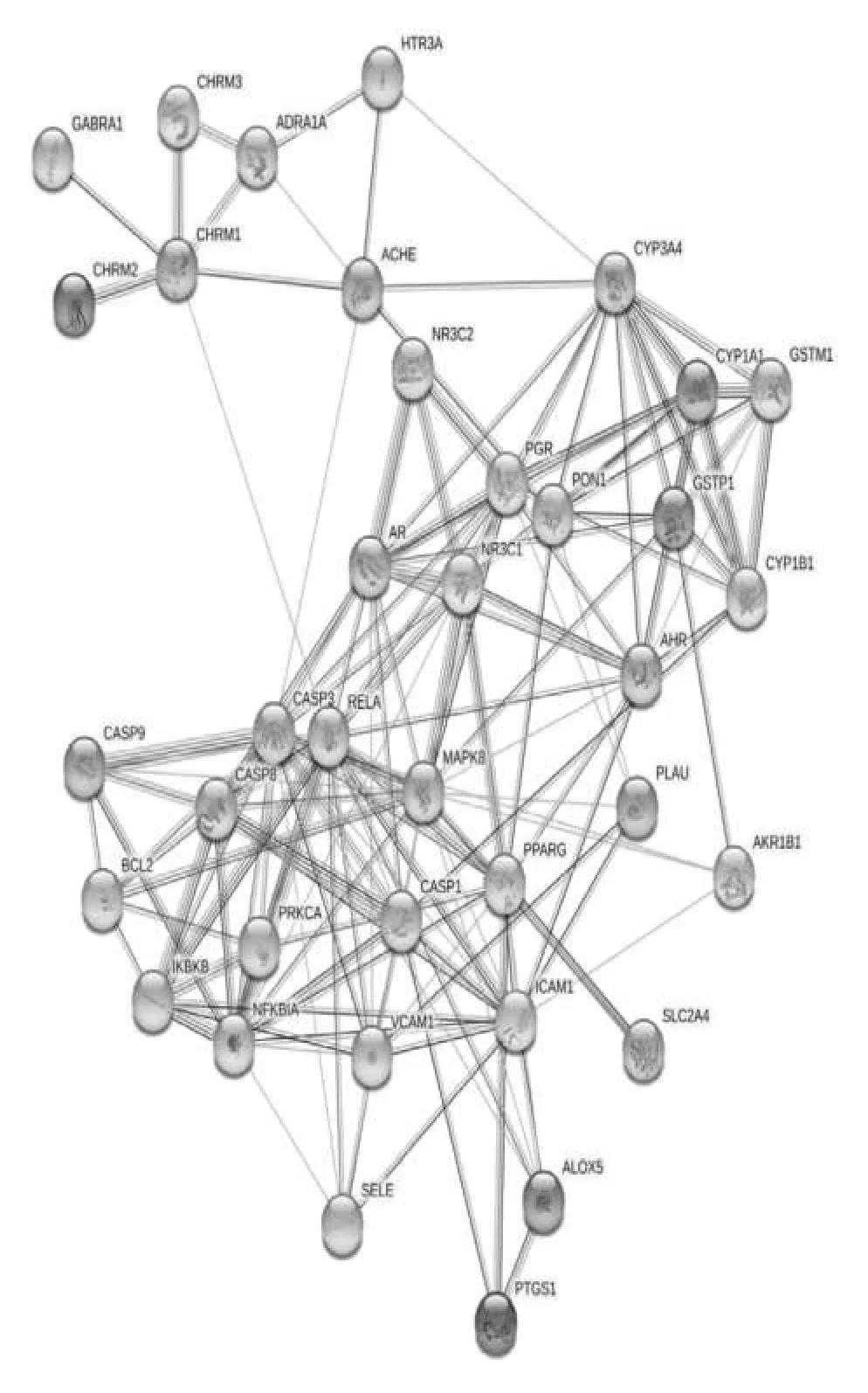
图2 人参治疗MF靶蛋白PPI网络图
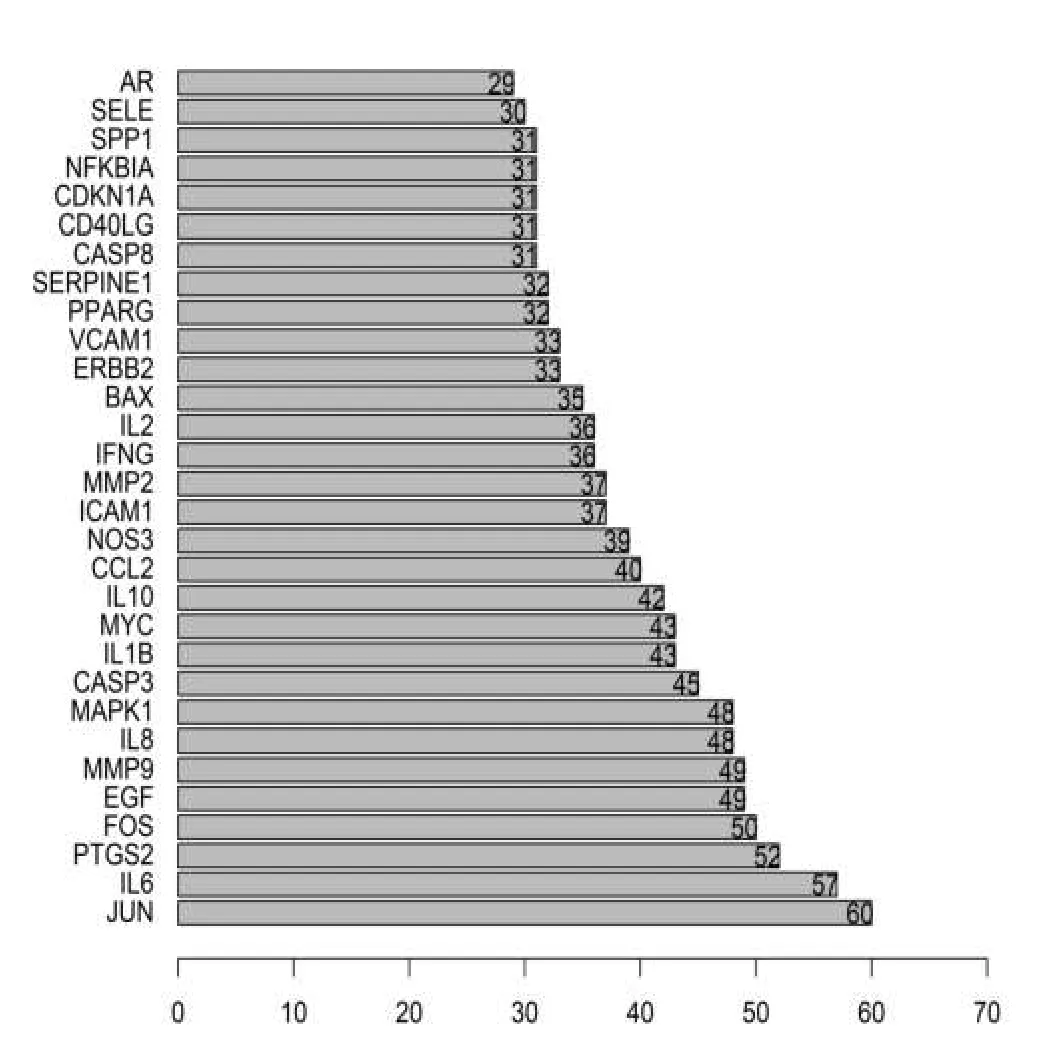
图3 PPI核心基因
2.5 GO功能分析
38个药物-疾病交集基因影响了78个生物学过程(P<0.05),选取P值排名前20的功能信息,详见表2,图4。图表结果显示,人参的活性成分主要富集在核受体的活动,配体激活的转录因子活性,半胱氨酸型内肽酶活性参与凋亡信号通路,半胱氨酸型内肽酶活性参与凋亡过程,转录辅激活结合,G蛋白偶联的神经递质受体活性,类固醇结合,神经递质受体的活动,转录辅因子结合,G蛋白偶联胺受体活性等方面。
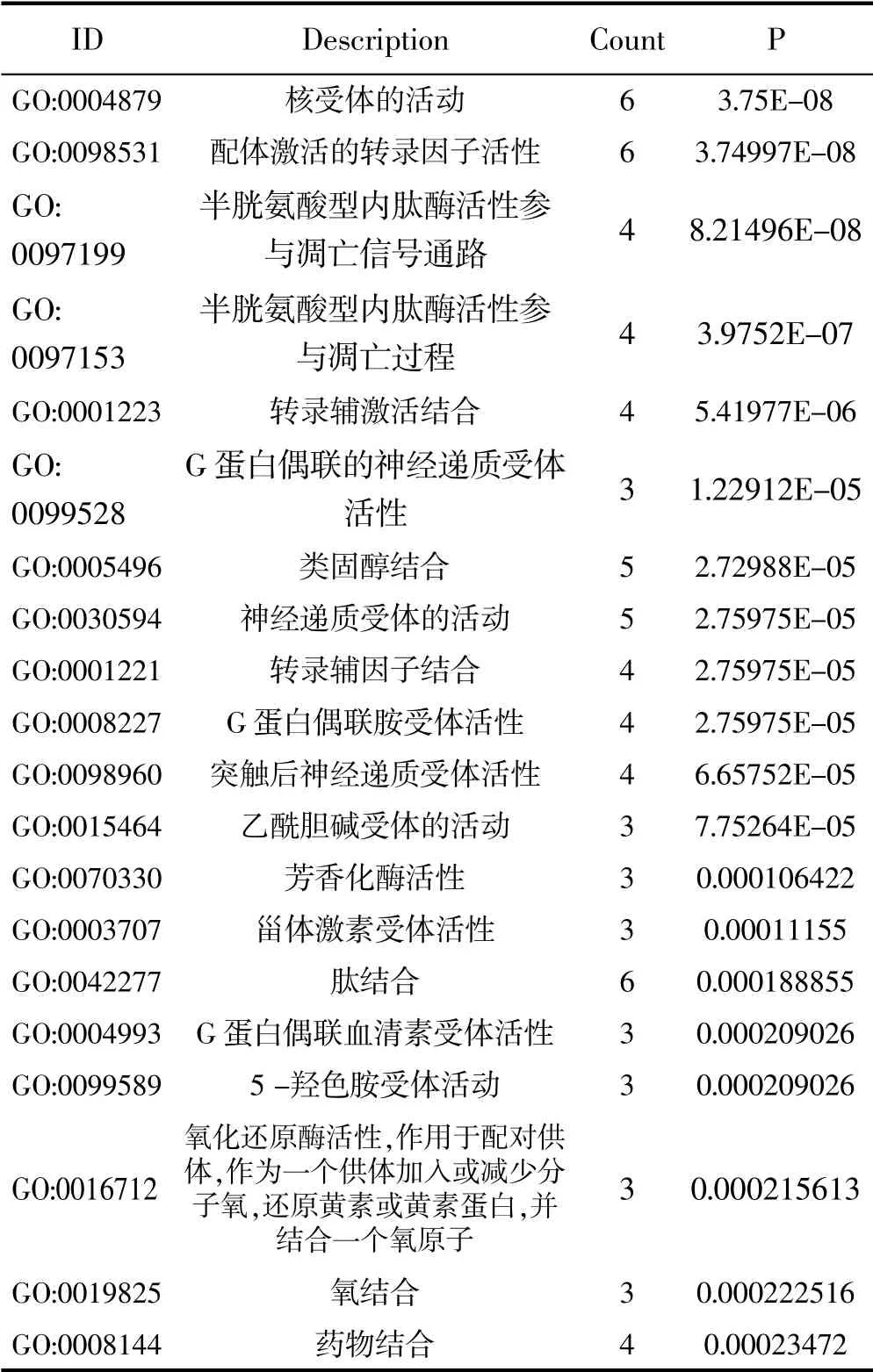
表2 药物-疾病交集基因具有的功能信息
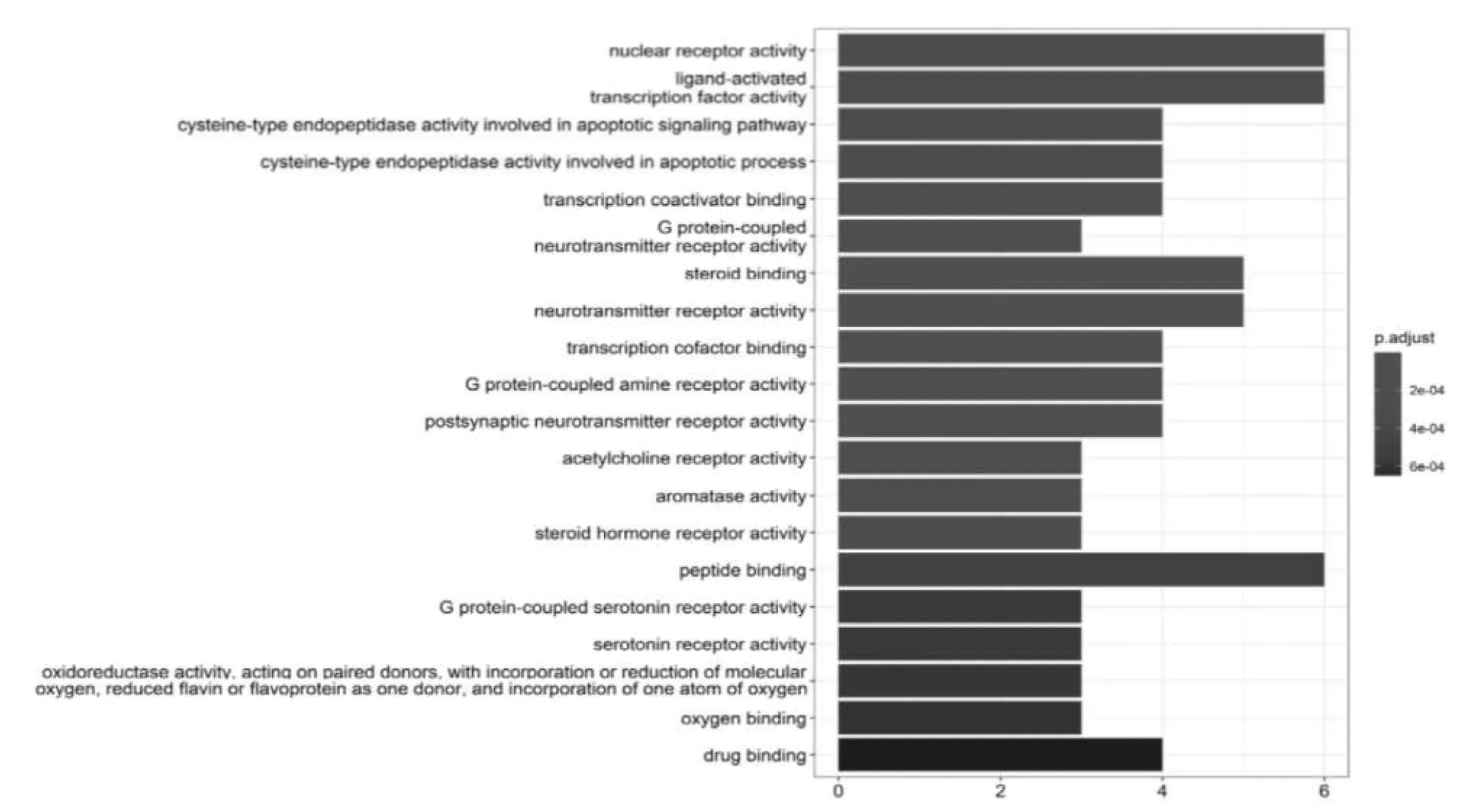
图4 GO功能富集分析柱状图
2.6 KEGG富集通路分析
结果通路富集分析发现,该38个靶点显著富集在88条通路上(P<0.05),其中20条通路与MF密切相关。详见图5,其中,主要通路包括肿瘤坏死因子信号通路,弓形体病通路,流体剪切应力与动脉粥样硬化通路,前列腺癌通路,糖尿病并发症的AGE-RAGE信号通路,乙型肝炎通路,甲型流感通路,细胞凋亡通路,麻疹通路,军团病通路等,提示人参可以通过以上多条通路作用于MF。得到相关的通路图,详见图6。

图5 人参治疗MF关键靶点参与的通路富集信息气泡图圆点越大,富集基因数目越多
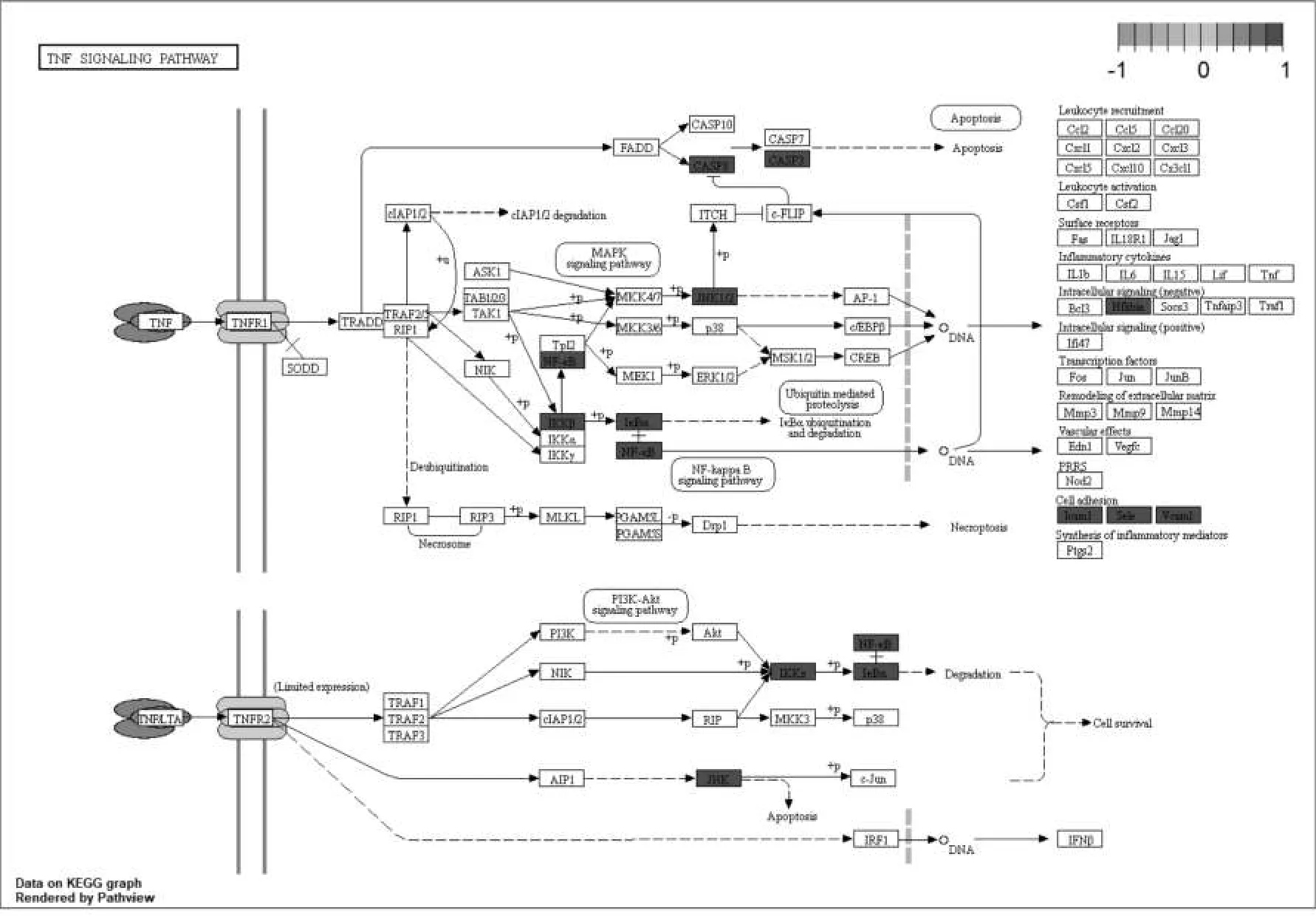
图6 人参治疗MF的相关通路
3 讨论
本研究通过网络药理学方法,筛选出人参中21个活性成分,利用GeneCards数据库得到3125个MF的相关靶点,通过映射找到了17个与MF直接相关的化合物及38个药物与疾病共同直接作用的蛋白靶点,构建了“成分-靶点-疾病”交互网络图,并对靶点进行GO富集分析和KEGG通路分析,明确了相关蛋白靶点的功能类别及参与改善MF作用的信号通路。GO功能富集分析结果显示,人参改善MF的基因功能主要体现涉及核受体的活动,配体激活的转录因子活性,半胱氨酸型内肽酶活性参与凋亡信号通路,半胱氨酸型内肽酶活性参与凋亡过程,转录辅激活结合,G蛋白偶联的神经递质受体活性,类固醇结合,神经递质受体的活动,转录辅因子结合,G蛋白偶联胺受体活性等生物过程,这与MF及其并发症的发生发展都有一定的联系。通过String数据库蛋白质-蛋白质相互作用网络分析,我们发现这些蛋白之间存在着复杂的联系,因此靶点之间的相互作用调节可能是人参治疗MF的潜在机制之一。另外,通过David数据库对这38个蛋白进行KEGG信号通路富集分析,我们得到P<0.05的信号通路,KEGG富集通路分析发现88条通路与MF发病显著相关,包括肿瘤坏死因子信号通路,弓形体病通路,流体剪切应力与动脉粥样硬化通路,前列腺癌通路,糖尿病并发症的AGE-RAGE信号通路,乙型肝炎通路,甲型流感通路,细胞凋亡通路,麻疹通路和军团病通路等。
引起慢性心脏病的因素颇多,其中,高血压是最重要和最常见因素[16]。目前认为,高血压和肾素-血管紧张素系统(renin-angiotensin system,RAS)的激活是慢性心衰心肌纤维化发生、发展的主要因素[2]。临床防治心肌纤维化主要依赖抗高血压药物,RAS抑制剂及他汀类药物[17]。虽然这些药物可一定程度上改善MF,但仍存在诸多不良反应或禁忌症。如沙库巴曲缬沙坦钠片可加重阿尔兹海默症病情,ACEI类药物禁用于高血肌酐及高血钾患者[18]。目前针对MF的新型药物如尼达尼布、波生坦等,虽有基础研究证实其可抑制MF的进展,但还缺少大型循证医学的证据[19]。中医药在治疗高血压心肌病、心力衰竭、心肌缺血等慢性心脏病具有巨大优势,从传统医学获得灵感并取得现代循证医学的支持是推动中医药事业的发展方向[20]。历代医家的记载及现代药理研究均表示人参的药用及保健价值在治疗MF中具有巨大的潜力。
MF是因持续性或反复加重的心肌缺血缺氧所产生的心肌病理改变,亦是多种慢性心脏病的共同结局,分子层面上表现为纤维细胞外基质胶原分泌增加、降解减少,以胶原(Collagen)Ⅰ/Ⅲ比例失调以及细胞外基质(extracellular matrix,ECM)沉积为主要特征[2]。MF具有双重特性,一方面,其保证了因为各种原因导致的心肌损伤后,心肌仍最大限度保持原有结构与功能,是某种意义上的“瘢痕修复”。另一方面,过度的MF会导致心室僵硬度增加,造成心律失常,促进心肌细胞肥大,极大地影响心脏的收缩和舒张功能,最终导致心肌顺应性下降、心力衰竭[16]。心肌纤维化形成机制非常复杂,尚未完全阐明。比如血液动力学障碍导致压力过负荷、长期炎症反应、代谢毒素影响、肾素-血管紧张素的激活、各种生长因子的异常分泌及氧化应激、多条信号通路的激活等,上述诸多因素均参与了MF的发生发展[2]。本研究通过GO功能分析发现38个药物-疾病交集基因影响了78个生物学过程,该38个靶点显著富集在88条通路上,其中包括对器官纤维化研究较为深入的肿瘤坏死因子(Tumor necrosis factor,TNF)信号通路,核因子κB(nuclear factor kappa-B,NF-κB)信号通路,核苷酸结合寡聚域样受体(NOD-like receptor,NLR)信号通路,网络样受体(toll-like receptor,TLR)信号通路,PI3K/Akt信号通路,丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)信号通路,RAS信号通路等,而目前对于器官纤维化联系最为直接的TGF-β/Smad信号通路未列其中,但通过查阅人参相关提取物对于纤维化疾病的研究亦可发现其对该通路具有调控作用,考虑与通路之间相关下游蛋白的交叉有关。在本研究中发现TNF信号通路对MF具有显著的影响。TNF-α是重要的促炎性细胞因子,作为激活细胞级联反应的主要介质,在细胞因子网络中发挥关键作用[21]。NF-κB是调控多种基因转录的关键因子,活化后能调控包括TNF-α在内的多种炎症介质的转录,作为炎性反应的整合者在免疫调节和炎症发生过程中具有重要作用[22]。本研究亦发现人参提取物对于炎症相关信号通路具有调节作用。
MF在中医学中可根据其临床表现归属于“心衰”“心悸”“胸痹”等范畴[5]。导致MF的病因多样,病机有别故存在诸多证型,需选择不同治则来进行治疗。多数医家认为该病的病机多以肝肾亏虚为本,痰瘀互结为标,故多采用补益肝肾、化痰祛瘀等方法治疗[23]。人参作为滋补强壮之要药多用于虚症的补益之法,大量的基础研究证实人参提取物豆甾醇、山柰酚、人参二醇及人参皂苷等均具有保护受损心肌、抑制心肌纤维化的作用。此外还有很多中药的有效成分例如小檗碱、熊果酸、白藜芦醇等被证实具有抑制MF的作用[5]。
本研究基于网络药理学方法对人参活性成分和MF进行靶标挖掘和通路分析,预测出人参治疗MF可能存在的17个化合物,38个靶点及88条潜在的通路,初步揭示了人参治疗MF的作用机制,证实了中药治疗疾病的多成分、多靶点、多通路的特点,为其后续基础研究及临床试验提供依据和方向。然而仅利用网络药理学技术研究人参的活性成分和作用靶点,可能存在相当的局限性,如原始信息来源于不一致,各数据库存在的各种差异等,因此,未来还需大量基础研究来验证本次研究成果。
