microRNA-15b通过调节MET-PI3K-Akt通路对肺癌模型鼠免疫功能及高凝状态的影响研究
2021-08-23陈超常娜赵萌张蕊张莹
陈超 常娜 赵萌 张蕊 张莹
肺癌是全球癌症相关死亡的主要原因,肺癌的总体5年生存率仅为15%[1]。免疫抑制在肿瘤的发生和进展中起着重要的作用,肿瘤会影响机体T淋巴细胞亚群,抑制细胞免疫[2]。此外,肺癌患者往往处于高凝状态,这会增加肺栓塞的发生风险并影响预后[3]。MET-PI3K-Akt通路在肺癌患者中高表达,不但参与肺癌细胞的增殖、转移和免疫抑制,还与凝血有关,研究显示PI3K-Akt通路的激活会诱导高凝状态[4-5]。微小RNA(microRNA,miRNA)可在转录后水平上调节基因的表达参与肺癌进程,最近的临床研究显示miR-15b在肺癌患者血清中降低,并可以促进肺癌细胞凋亡,但是其作用机制尚不明确[6]。并且最新研究显示抑制miR-15b可以通过激活PI3K/AKT相关通路促进氧葡萄糖剥夺心肌细胞模型的存活[7]。综上,本文主要分析miR-15b通过调节MET-PI3K-Akt通路对肺癌模型鼠免疫功能及高凝状态的影响,并探究其作用机制。
材料与方法
一、主要实验材料
人肺癌细胞A549(ATCC公司,美国)。DMEM培养基血清和抗体(Invitrogen公司,美国)。BALB/C裸鼠(上海斯莱克实验动物中心,中国)。miR-15b类似物(mimic)、抑制剂(inhibitor)以及阴性对照(negative control,NC)(GenePharma公司,China)。LipofectamineTM 2000(Invitrogen,美国)。ELISA试剂盒和TUNEL染色试剂盒。TRIzol(Sigma公司,美国)。miScript试剂盒和PrimeScript-RT(Takara公司,日本)。anti-CyclinD1、anti-Ki67、anti-MET、anti-PI3K、anti-AKT(Abcam公司,美国)。PVDF膜(Bio-Rad公司,美国)。ECL 显色试剂盒(Thermo Fisher公司,美国)。FACSCanto II流式细胞仪和配套试剂盒(BD Biosciences公司,加拿大)。miR-15b类似物(mimic)和阴性对照(NC)(GenePharma公司,China)。LipofectamineTM 2000(Invitrogen,美国)。pMIR-REPORT 双荧光素酶试剂盒和1000 Assay System检测系统(Thermo Fisher公司,美国)。
二、分组和建模
将DMEM培养基中处于对数生长期的各组等的A549细胞分为3组:NC组、mimic组和inhibitor组,mimic组和inhibitor组分别通过Lipofectamine 2000转染50 nM 的miR-15b mimic或者inhibitor来上调或抑制miR-15b的水平。NC组转染等量的NC空载质粒作为对照组,转染条件为7 ℃,5%CO2,48 h。通过qPCR分析转染效果。将转然后的各组细胞重新配置成浓度为5×105个/mL的溶液,然后将0.2 mL的细胞悬液注射在小鼠右前腋下,每组细胞10只小鼠,在7 d时可以触摸到有瘤体生成提示建模成功,在第28 d ,将小鼠称重后,取眼眶血,然后断头处死小鼠,收集肿瘤病灶。
三、检测指标和方法
1 RT-qPCR检测miR-15b
肿瘤组织中总RNA通过TRIzol获得,通过miScript试剂盒合成互补DNA(7 ℃/60分钟,95 ℃/5分钟,4 ℃),利用MiScript SYBR-Green PCR试剂盒检测互补DNA(95 ℃/10 s,55 ℃/30 s,72 ℃/30 s,40个循环)。U6用作miR-15b的内源参照,通过2-ΔΔCq分析RNA的相对表达水平。
2 TUNEL染色检测凋亡
将肿瘤组织用4%的聚甲醛固定并用梯度醇脱水,包埋在石蜡中,制成厚度为5 μm的组织玻片标本,将样本脱蜡、抗原修复处理,并用密封液封闭。在切片中加入50 μL 的TUNEL反应溶液,在37 ℃下孵育1 h,然后用使用PBST洗涤切片。然后加入100 μL的二氨基联苯胺在37 ℃下孵育30 min,然后用PBST洗涤。最后,在显微镜下观察样品。随机选择每个组织的四个视野进行计算,凋亡指数=凋亡数/(凋亡数+正常细胞数)×100%。
3 Western blot检测增殖蛋白Cyclin D1和Ki67
将肿瘤组织研磨后收集总蛋白并通过BCA试剂盒检测浓度。应用SDS-PAGE(110 V,100分钟)分离40μg的总蛋白。分离后,将蛋白质转移到PVDF膜上,并在膜上添加1 ∶500稀释的anti-CyclinD1、anti-Ki67抗体并孵育过夜。然后在室温下加入以1 ∶5 000稀释的HRP标记的二抗,4 ℃下孵育2 h。 通过ECL检测蛋白印迹带。GAPDH作为内参。
4 凝血功能和内皮功能
一部分新鲜的小鼠血液样本送至检验科检测全血黏度,并以及血浆凝血酶原时间(PT)及活化部分凝血活酶时间(APTT)。ELISA检测血清内皮功能指标,然后将血液样本在2000 rps下离心20 min收集血清,通过ELISA说明书加入试剂,显色后使用酶标仪在450 nm下检测吸光度(OD),根据标准曲线计算一氧化氮(NO)和内皮素(ET1)的浓度。
5 流式细胞术检测CD4+和CD8+细胞
使用流式细胞术检测小鼠外周血中CD4+和CD8+水平,按照试剂盒加入抗体孵育对标志蛋白进行标记,通过流式细胞仪检测CD4+和CD8+水平。
6 Western blot检测MET-PI3K-Akt通路
根据1.3.1的方法检测肿瘤组织中MET、PI3K、Akt蛋白水平。
7 双荧光素酶报告
根据工具网站Starbase预测miR-15b与MET mRNA的的结合位点,根据结合部分的序列分别构建野生型(wt-)和突变型的(mut-)的MET序列和miR-15b mimic或NC序列克隆到pMIR-REPORT荧光素酶载体中。使用Lipofectamine 2000将细胞用两种载体转染至细胞中。使用双荧光素酶报告基因1000 Assay System分析系统评估荧光素酶活性。当miR-15b与MET结合后,荧光素酶活性会降低。然后通过RT-qPCR和Western blot检测NC组和mimic组中MET mRNA和蛋白水平。
四、统计学处理
统计分析使用SPSS 19软件。以平均值±标准差(SD)表示,两组定量数据的比较采用t检验的方法;多组定量数据地比较采用ANOVA方差分析,两两比较通过SNK-q。 统计学显着性表示为P<0.05。
结 果
一、miR-15b对肿瘤生长的影响
与NC组比较,mimic组的miR-15b水平(3.45±0.36)显著升高而inhibitor组(0.52±0.07)显著降低(P<0.05)。并且mimic组的肿瘤体积、质量显著低于NC组而inhibitor组显高于NC组 (P<0.05)(见表1)。

表1 各组miR-15b以及肿瘤体积、质量比较(n=10)
二、miR-15b对肿瘤细胞凋亡的影响
如图1,深棕色为凋亡细胞,NC组的凋亡指数为(5.12±0.46)%,mimic组的凋亡指数(17.72±3.57)%显著高于NC组(P<0.05),inhibitor组的凋亡指数(1.35±0.41)%显著低于NC组(P<0.05)(见图1)。
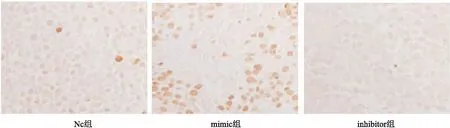
图1 TUNEL染色检测肿瘤细胞凋亡情况(×400)表3 各组血液流变学指标比较(n=10)
三、miR-15b对肿瘤细胞增殖的影响
与NC组(1.12±0.19,1.35±0.10)比较,mimic组的增殖相关蛋白CyclinD1和Ki67蛋白水平(0.52±0.05,0.48±0.04)明显降低而inhibitor组的上述水平(2.67±0.24,2.55±0.26)明显升高(P<0.05)(见表2、图2)。

图2 Western blot检测肿瘤中CyclinD1和Ki67蛋白水平

表2 各组肿瘤组织中CyclinD1和Ki67蛋白水平比较(n=10)

组别低切(5·s-1)中切(30·s-1)高切(200·s-1)PT(s)APTT(s)NC组8.42±1.046.71±0.744.65±0.4317.52±0.7221.47±1.27mimic组10.91±1.23a8.39±0.91a5.38±0.57a15.21±0.86a18.67±1.39ainhibitor组7.06±1.08a6.12±0.83a4.06±0.53a19.78±1.15a24.05±1.45aF26.89728.95020.44324.72431.859P<0.001<0.001<0.001<0.001<0.001
四、miR-15b对血液流变学指标的影响
mimic组的全血黏度高于NC组而PT和APTT显著低于NC组(P<0.05),inhibitor组的全血黏度低于NC组而PT和APTT显著高于NC组(P<0.05)(见表3)。
五、miR-15b对内皮功能的影响
与NC组比较,mimic组的NO升高而ET1降低(P<0.05),inhibitor组的NO降低而ET1升高(P<0.05)(见表4)。

表4 各组NO和ET1水平比较(n=10)
六、miR-15b对肺癌模型小鼠免疫功能的影响
mimic组的CD4+(19.83±2.71%)和CD4+/CD8+水平(1.30±0.34)显著高于NC组(16.74±2.67%,1.07±0.24)(P<0.05),而inhibitor组的CD4+(11.32±2.62%)和CD4+/CD8+水平(0.77±0.18)显著低于NC组(P<0.05)(见表5)。

表5 各组CD4+和CD8+水平比较(n=10)
七、miR-15b对肺癌模型小鼠MET-PI3K-Akt通路的影响
mimic组MET、PI3K、Akt水平显著高于NC组而inhibitor组上述指标水平显著低于NC组(P<0.05)(见表6、图3)。

图3 Western blot检测肿瘤中MET、PI3K、Akt水蛋白水平

表6 各组MET、PI3K、Akt水平比较(n=10)
八、双荧光素酶报告验证miR-15b靶向抑制MET
miR-15b与MET mRNA结合位点(如图4)所示。根据双荧光素酶报告,同时转染miR-15b mimic和wt-MET时,相对荧光酶素活性显著降低(P<0.05),提示miR-15b与MET mRNA靶向结合(如表7)。并且mimic组的MET mRNA和蛋白水平显著低于NC组(见表8)。

表7 双荧光素酶报告检测靶向结合

表8 过表达miR-15b对MET mRNA和蛋白表达水平的影响

图4 miR-15b与MET mRNA结合位点
讨 论
肺癌是最致命的恶性肿瘤,最新的统计报告估计,肺癌约占所有女性癌症死亡患者的26%和所有男性癌症死亡患者的29%[8]。主动或被动吸烟、辐射、烟尘、职业性接触石棉、镍、铬和砷等物质均是肺癌的诱发因素。虽然诊断和治疗肺癌的新方法被不断应用于临床,但由于确诊时约有35%的肺癌病例已经处于晚期,肺癌的预后仍不令人满意。
近年来,miRNA在肺癌中的作用被广泛的发现,miRNA可通过碱基配对的方式与mRNA结合,从而在转录后水平上调控基因的表达。miR-15b是近年来新发现的一种与肿瘤有关的miRNA,研究已经发现在宫颈癌、舌癌以及胃癌中起到抑制肿瘤的作用[9-11]。在肺癌中,研究发现miR-15b可以通过抑制Bcl2蛋白的表达诱导凋亡发挥抑癌作用[12]。也有临床研究结果发现了血清中的miR-15b可以作为肺癌的标志因子[13]。本文通过体内实验,分析提高或抑制miR-15b对肺癌裸鼠模型的的影响,结果显示提高miR-15b的水平可以抑制肺癌裸鼠模型中肿瘤细胞的增殖并诱导凋亡,抑制肿瘤的生长,而抑制miR-15b对肺癌产生促癌作用。本次研究通过体内实验证实了miR-15b在肺癌中发挥抑癌作用。
免疫抑制是肿瘤的主要特征之一,在这个过程中,机体的免疫系统受到抑制,CD4+比例显著降低,CD4+/CD8+的比例也下降[14]。并且CD4+/CD8+受到抑制也是肿瘤发生、进展、转移的必要条件[15]。此外对于肺癌患者,除免疫抑制外,高凝状态也是另一大特征,并且CD4+的变化也与凝血状态有关[16]。本次研究结果显示对于肺癌裸鼠模型,提高miR-15b不但会缓解高凝状态、改善内皮功能,还可以提高CD4+和CD4+/CD8+的水平,解除免疫抑制,而抑制miR-15b具有相反的作用。此外,本次研究结果还显示mimic组MET、PI3K、Akt水平显著高于NC组而inhibitor组上述指标水平显著低于NC组。MET-PI3K-Akt通路的上调,是肺癌发生和进展的重要机制,并且PI3K-Akt通路与凝血功能有关[17]。也有研究发现PI3K-Akt通路也可以诱导肿瘤细胞分泌免疫抑制抗体或调节肿瘤坏死因子等细胞因子的分泌,从而抑制免疫反应[18]。Li等[19]研究结果显示抑制miR-15会激活PI3K/AKT通路。也有研究显示提高miR-15b的水平可以通过激活PI3K/Akt相关通路对卵巢癌细胞起到抑制作用[20]。并且本次研究通过双荧光素酶,报告验证了miR-15b与MET mRNA靶向结合,提高miR-15b的水平会抑制MET的表达,这提示miR-15b对肺癌的抑制作用与MET-PI3K-Akt通路有关。
综上所述,在肺癌裸鼠模型中,miR-15b可以诱导肺癌细胞的凋亡和抑制增殖,并促进免疫功能改善高凝状态。但是关于miR-15b在肺癌中的作用和机制值得进一步研究。
