miR-29b/MMP2轴参与慢性阻塞性肺疾病的作用机制研究
2021-08-23凌婵蒋之裴异
凌婵 蒋之 裴异
慢性阻塞性肺疾病(chronic obstructive pulmonary disease, COPD)是一种复杂、多维、异质性疾病[1],已经成为全球第三大死亡原因[2]。气道重塑是COPD的主要病理基础,也是COPD持续发展的关键因素[3-4]。迄今为止,尚无有效的COPD治疗方法和定义早期COPD的全球公认标准[5-7]。因此,迫切需要新的生物标记物用于早期检测COPD,干预疾病进展[8]。研究发现miRNA可调节COPD的病理过程[9-10]。在COPD患者的肺和血浆中均检测到miR-29b的下降[11],而且miR-29b的水平与肺功能和炎症相关[12];表明miR-29b可能参与COPD的进展。但是目前miR-29b调控COPD发生的程度和方式尚不清楚。MMP2可破坏肺部结构,参与气道重塑[13-14]。miR-29b可通过与MMP2 3′UTR结合而负调控MMP2[15-16]。故本研究拟进一步研究miR-29b是否能调控MMP2参与COPD的进展及其对肺支气管上皮细胞增殖迁移的影响。
资料与方法
一、实验材料
1 实验动物
SPF级健康SD雄性大鼠30只,体重(200±10)g,购自济南朋悦动物繁育有限公司,合格证号为SCXK(鲁)20140007。所有动物均严格按照动物饲养规则喂养,温度为24~26 ℃,湿度为50~60%,自由饮水和摄食。饲养3d充分适应环境后开始实验。
2 试剂及仪器
芙蓉王香烟(焦油11mg,烟气烟碱1.2mg,烟气一氧化碳11mg,湖南中烟工业公司);脂多糖(LPS,美国Sigma公司);HE染色试剂、RIPA裂解液和BCA试剂盒购自上海碧云天生物科技公司,批号分别为C0105、P0013B、P0012S;大鼠MMP2 ELISA试剂盒(美国Abnova,KA0393)购自武汉艾美捷科技有限公司;miRNA提取分离试剂盒、反转录试剂盒及Real-time PCR试剂盒购买于日本TaKaRa公司;Lipofectamine 2000购买于美国Invitrogen公司;PCR引物由南京金斯瑞生物科技有限公司合成;兔抗人MMP2(ab92536)、β-actin(ab8227)、山羊抗兔IgG H&L(HRP)(ab205718)均购自英国abcam公司;miR-29b模拟物(mimics)、miR-29b抑制剂(inhibitor)、mimics-NC、inhibitor-NC均由上海Gene Pharma合成;16HBE(人支气管上皮样细胞)(美国ATCC)购自上海恒远生物科技有限公司;胎牛血清、胰蛋白酶、RPMI 1640培养基均购自美国GIBCO公司;细胞培养箱购自美国Thermo Scientific公司;PFT型小动物肺功能测定仪购自美国Buxco公司;iMark680多功能酶标仪、蛋白转膜装置购自美国Bio-Rad公司、BX51电动显微镜购自日本Olympus公司。
二、方法
1 动物分组及模型制备
采用随机数字表法将30只SD雄性大鼠分为空白组和COPD模型组,每组15只。采用LPS气道滴入联合烟雾法复制COPD大鼠模型[17]。空白组大鼠于正常环境下喂养,COPD组大鼠于实验开始的第1d气管内注入1mL的LPS溶液(100μg的LPS溶于0.5mL PBS),每周1次,连续6周;并且在每周的其余6d,将大鼠置于自制熏烟箱(有机玻璃,长宽高分别为80cm×80cm×80cm)进行人为被动吸烟,每2次/d,每次0.5h,间隔8h,每次12支香烟,连续6周。结束后对大鼠进行肺功能和组织病理学检测,模型出现肺功能受损和典型的COPD特征性病理特征,提示模型制备成功。
2 检测指标
(1)肺功能测定
大鼠麻醉后,脱去颈部毛发,于颈部正中间皮肤剪一纵行切口,钝性分离皮下肌肉组织,暴露出气管,在靠近咽喉处切一倒T型小口,插管,以仰卧位置于密闭体积描记箱中,使用小动物肺功能测定仪,检测动态肺顺应性(Cdyn)、静息呼吸频率、呼气阻力、吸气峰流速(PIF)。
(2)HE染色观察肺组织形态学变化
取血完成后,打开胸腔,暴露双肺,将左肺放入4%多聚甲醛中固定,常规脱水、石蜡包埋,切片,二甲苯脱蜡,梯度乙醇脱苯1min,蒸馏水冲洗,苏木素染色5min,蒸馏水冲洗,放入1%盐酸酒精30s,蒸馏水冲洗,伊红染色5min,自来水流水洗3次,至无色,梯度乙醇脱水,二甲苯透明,中性树脂封片。光镜下观察肺组织基本形态。
(3)血浆MMP2含量测定
肺功能测定结束后,采用含肝素的负压管进行腹主动脉取血,离心,取上清液,酶联免疫吸附法(ELISA)检测血浆中MMP2水平。
(4)qRT-PCR检测肺组织miR-29b表达水平
取出右肺,Trizol法提取总RNA,按照PrimeScript RTMaster Mix说明书将RNA逆转录制备cDNA。按照试剂盒说明书进行PCR扩增:反应体系(25μL):SYBR® Premix Ex TaqTM(2×)12.5μL。上下游引物各0.5μL,cDNA(200ng/μL) 1μL,ddH2O 11μL。条件:95 ℃预变性5min,95 ℃变性15s,60 ℃退火延伸1min,进行40次循环,每个样本重复3次,以U6或β-actin为内参,采用2-ΔΔCt方法,计算miR-29b、MMP2的相对表达量(见表1)。

表1 RT-PCR引物序列
(5)细胞培养及转染
人支气管上皮样细胞16HBE接种于含10%胎牛血清的RPMI 1640培养基,在37 ℃、5%CO2的细胞培养箱中进行培养,隔天换液,每2~3d传代一次,在细胞达到对数增长期时开始实验[18]。取对数期生长的16HBE细胞,转染前1d更换不含抗生素培养基;胰酶消化后制成单细胞悬液,调整细胞浓度以1×105个/孔的密度接种于6孔板中。当细胞密度达到约50%至70%时,根据说明使用Lipofectamine 2000转染试剂,将miR-29b mimics、mimics-NC、miR-29b inhibitor、inhibitor-NC转染试剂混合液分别逐滴加入16HBE细胞培养6孔板中,轻轻混匀。混匀后加入到含胎牛血清的RPMI 1640培养基,于37 ℃和5%CO2培养箱分别培养24h。转染试剂的配置:分别取4μg的miR-29b mimics、mimics-NC、miR-29b inhibitor和inhibitor-NC,加入50μL不含血清的RPMI 1640培养基稀释,再加入1μL转染试剂Lipofectamine 2000,室温静置20min。实验设置无任何转染的16HBE细胞为空白对照组(Control组),每组设置5个复孔。
(6)qRT-PCR检测16HBE细胞miR-29b表达水平
转染24h后采用Trizol法提取16HBE细胞总RNA,然后根据2.2.4项下步骤进行反转录、PCR扩增,计算miR-29b的相对表达量。
(7)CCK-8法检测16HBE细胞增殖
转染24h后,每孔加入10μL的CCK8试剂,于培养箱中继续培养4h。使用酶标仪检测450nm波长下各孔吸光度值(optical density,OD),并计算各组细胞增殖抑制率,细胞增殖抑制率(%)=(1-实验组OD/对照组OD)×100%。
(8)划痕实验检测16HBE细胞迁移能力
取转染24h后的各组16HBE细胞,接种于6孔板中,待细胞完全贴壁后,用移液器尖断在每个孔内划一道痕,每组均设置5个复孔,置于培养箱中继续培养,然后在倒置显微镜下分别在同一位置于0h和48h拍照,观察划痕愈合情况,计算划痕愈合率,实验重复3次。
划痕愈合率(%)=(1-48h划痕宽度/0h划痕宽度)×100%
(9)Western Blot检测各组细胞中MMP2蛋白表达
取转染24后的各组16HBE细胞,按照试剂盒说明书的操作提取细胞中的总蛋白,BCA法测定蛋白浓度后取等量蛋白质样品上样,SDS-PAGE凝胶电泳,湿转法转膜,5%脱脂奶粉封闭,加入一抗(MMP2,按1 ∶1 000的比例稀释;β-actin按1 ∶2 000的比例稀释),4 ℃下孵育过夜,HRP标记的羊抗兔IgG二抗(1 ∶5 000)室温孵育1h,化学发光法(ECL)显色,以β-actin为内参,通过与内参的灰度比,得出目的条带的相对表达水平。
三、统计学分析
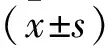
结 果
一、COPD大鼠肺功能测定结果
与空白组相比,COPD组大鼠动态肺顺应性、吸气峰流速显著降低,呼吸频率、呼气阻力明显升高(P<0.05),表明COPD组大鼠存在阻塞性肺通气障碍(见表2)。

表2 COPD模型大鼠肺功能检测结果
二、COPD大鼠肺组织形态学变化
HE染色结果显示,空白组大鼠肺组织及肺泡结构正常,无代偿性肺气肿形成;COPD组大鼠肺泡结构明显被破坏,肺泡间隔增宽,肺泡璧变薄,部分断裂融合,形成代偿性肺气肿,可见大量炎性细胞浸润(见图1)。

图1 COPD大鼠肺组织病理学变化(HE染色,×200)
三、COPD大鼠血浆MMP2含量和肺组织miR-29b表达水平
与空白组相比,COPD组大鼠血浆MMP2含量显著升高,肺组织miR-29b表达水平显著降低(P<0.05)(见表3)。
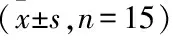
表3 COPD模型大鼠肺功能检测结果
四、16HBE细胞转染后miR-29b表达水平
为了确定转染效果,我们采用qRT-PCR检测16HBE细胞转染后miR-29b表达水平,结果显示,与Control组相比,mimics-NC组和inhibitor-NC组16HBE细胞中miR-29b表达水平差异无统计学意义(P>0.05),miR-29b mimics组细胞中miR-29b表达水平显著增加(P<0.05),miR-29b inhibitor组细胞中miR-29b表达水平显著降低(P<0.05)(见表4)。

表4 转染后16HBE细胞中miR-29b表达水平
五、miR-29b对16HBE细胞增殖的影响
与Control组相比,mimics-NC组和inhibitor-NC组细胞增殖无明显统计学差异(P>0.05),miR-29b mimics组细胞增殖抑制率显著增加(P<0.05),miR-29b inhibitor组细胞增殖并未受到抑制,16HBE细胞增殖反而增加(P<0.05)(见表5)。

表5 miR-29b对16HBE细胞增殖的影响
六、miR-29b对16HBE细胞迁移能力的影响
划痕实验结果显示,与Control组相比,mimics-NC组和inhibitor-NC组的划痕愈合率无明显统计学差异(P>0.05),miR-29b mimics组的划痕愈合率显著降低(P<0.05),miR-29b inhibitor组的划痕愈合率显著增加(P<0.05)(见表6、图2)。

图2 miR-29b对16HBE细胞迁移能力的影响(划痕实验)

表6 miR-29b对16HBE细胞迁移能力的影响
七、miR-29b对16HBE细胞MMP2蛋白表达的影响
Western Blot结果显示,与Control组相比,mimics-NC组和inhibitor-NC组MMP2蛋白表达差异无统计学意义(P>0.05),miR-29b mimics组16HBE细胞中MMP2蛋白表达显著降低(P<0.05),miR-29b inhibitor组6HBE细胞中MMP2蛋白表达显著增加(P<0.05)(见表7、图3)。

表7 miR-29b对16HBE细胞MMP2蛋白表达的影响
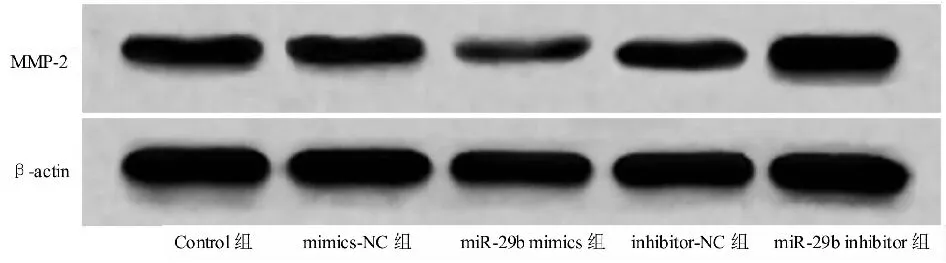
图3 miR-29b对16HBE细胞MMP2蛋白表达的影响
讨 论
COPD的发生,主要是肺部长期暴露在香烟和其它燃料燃烧时产生的烟雾,导致肺部慢性炎症。随着工业化进程的加快,空气污染(如雾霾)频频发生,导致COPD的发病率和死亡率也在不断上升。尽管国内外学者进行了积极的研究,但是针对COPD的诊断和治疗仍没有取得重大进展。因此,迫切需要新的生物标记物用于早期检测COPD,以便于对疾病进行及时干预[19]。
近年来随着对非编码RNA研究的不断深入,人们发现miRNA参与多种疾病的发生发展,如肿瘤、神经性疼痛、肺部炎症等,而且miRNA已经成为肿瘤早期诊断和治疗靶标的生物标志物。最近不少研究发现在COPD患者中也发现有miRNA的异常表达,王美华等[20-21]发现在慢性阻塞性肺疾病急性加重期患者血清microRNA-146a、microRNA-155水平显著升高;Tang、Seiko等发现在COPD患者的肺和血浆中miR-29b的表达明显降低[11,22];而且其表达水平与肺功能和炎症密切相关。动物研究也发现miR-29b在COPD大鼠的肺组织和外周血中均具有较低的表达水平[13];而且有研究发现在慢性肺病或支气管肺发育不良(BPD)患儿的血浆中miR-29b被抑制,表达降低,且其降低与BPD严重程度呈负相关[23]。以上均表明miR-29b可能参与COPD的气道炎症,血浆miR-29b可作为COPD中疾病严重程度的生物标志物。本研究通过复制COPD大鼠模型,采用qRT-PCR检测miR-29b表达水平,发现COPD大鼠模型肺组织中miR-29b表达水平显著低于正常大鼠,与Tang、Seiko研究结果一致。此外,Esha等发现MMP2在COPD模型大鼠和小鼠肺组织、血浆中的表达会增加[13-14],本研究ELISA检测结果同样显示COPD模型大鼠血浆中MMP2明显高于正常大鼠,而且COPD大鼠较正常大鼠明显存在阻塞性肺通气障碍和肺组织结构损伤;提示miR-29b和MMP2可能参与COPD的发生、发展。
miR-29b-3p可通过靶向MMP2来调节血管平滑肌细胞钙化和成骨分化[24];Chen等[25]发现miR-29b mRNA水平的升高,可下调MMP2的表达,减轻多囊卵巢综合征;而且多种研究表明在肿瘤细胞中抑制miRNA-29b,可上调MMP-2,促进癌细胞的增殖,迁移和侵袭,miR-29b可作为肿瘤诊断和预后的新型生物标志物[26]。以上研究均说明MMP2是miR-29b的下游靶标,而且已经过萤光素酶分析验证。但是在COPD中miR-29b是否调控MMP2参与慢性阻塞性肺疾病的进展尚不清楚,故本研究进一步采用人支气管上皮样细胞16HBE为对象,通过干扰16HBE细胞中miR-29b的表达,探究miR-29b对16HBE细胞MMP2表达的影响;因为MMP2是上皮细胞重塑过程中的启动子,可破坏肺部结构,参与气道重塑,所以我们还测试了细胞增殖和迁移的变化。结果显示,miR-29b mimics转染后细胞miR-29b表达水平显著增加,而miR-29b inhibitor转染后细胞miR-29b表达水平显著降低,说明转染成功;CCK-8检测结果显示,miR-29b mimics转染后细胞增殖受到显著抑制,而miR-29b inhibitor转染后细胞增殖并未受到抑制,反而促进了16HBE细胞增殖;Western Blot结果显示miR-29b mimics转染后16HBE细胞中MMP2蛋白表达显著下调,而miR-29b inhibitor转染后6HBE细胞中MMP2蛋白表达显著上调;提示,miR-29b可负调控MMP2参与慢性阻塞性肺疾病的进展。
综上所述,miR-29b可负调控MMP2参与慢性阻塞性肺疾病的进展。我们的发现为COPD的诊断和miR-29b治疗COPD提供了新的可能性。因条件有限本研究只是在动物和细胞水平进行了探究,而且样本量小,此结果尚需要临床研究和大样本进行验证。
