微生物法测定婴幼儿配方乳粉中叶酸含量不确定度评估
2021-08-21吴思敏严家俊黄钟标
吴思敏,严家俊,黄钟标
广东产品质量监督检验研究院,广东佛山 528300
0 引言
叶酸(Folic Acid),又名蝶酰谷氨酸,是人体必需的营养物质之一。叶酸不能在体内合成,需要通过日常饮食摄入,叶酸的缺乏或过量摄入都会对人体造成伤害[1~3]。因此,通过有效方法对含叶酸产品进行定量检测,确保人体叶酸的摄入在合理的水平具有显要的意义[4,5]。
目前,婴幼儿配方乳粉中叶酸的检测方法包括仪器法[6~10]、化学发光分析法[11~13]、酶联免疫法[14,15]和微生物法[16~19]等。相对于其他检测方法,微生物法具有较高的灵敏度及精确度,可以满足对于叶酸含量较低、基质复杂样品的检测需求。美国官方分析家协会手册及《GB 5009.211—2014 食品安全国家标准 食品中叶酸的测定》都将微生物法作为叶酸检测的首选方法和仲裁方法。但微生物法操作较为繁琐,并且试验过程有诸多不确定因素,以致检测结果存在一定的误差。为了更加客观公允的表示分析结果,保证叶酸测定结果的准确性,本研究依据《GB 5009.211—2014 食品安全国家标准 食品中叶酸的测定》及相关不确定度评估标准及统计学方法,对影响婴幼儿配方乳粉中叶酸含量测定结果的不确定度分量进行研究,以此确保检测结果的权威与公正,从而更好地保障食品质量与安全。
1 材料与方法
1.1 试剂与材料
叶酸标准品(纯度≥99%);鼠李糖乳杆菌(Lactobacillus Caseispp.rhamnosus)(ATCC 7469);乳酸杆菌琼脂培养基、乳酸杆菌肉汤培养基、叶酸测定用培养基。
1.2 仪器与设备
CL-40M高压灭菌锅,GHP-9160隔水式恒温培养箱,HH-4数显恒温水浴锅,1-14K离心机,ML204电子天平,CP225D分析天平,UV-1900分光光度计,Vortex-Genie 2涡旋混合器。
1.3 试验方法
1.3.1 试样的提取
准确称取1.000 g样品,精确至0.001 g,转入含80.0000 mL氢氧化钠乙醇溶液的100.0000 mL容量瓶中,超声振荡2~4 h后,用水定容至刻度,摇匀。用水进行适当稀释。
1.3.2 培养管配制
标准曲线系列管:取试管分别加入叶酸标准工作液0.0000 mL、0.2500 mL、0.5000 mL、1.0000 mL、1.5000 mL、2.0000 mL、2.5000 mL、3.0000 mL、3.5000 mL、4.0000 mL和5.0000 mL,加水至5.0000 mL后,添加5.0000 mL叶酸测定用培养液。每个梯度做3 次平行。
样品系列管:取空试管分别加入0.5000 mL、1.0000 mL、2.0000 mL3 个含量的试样稀释液,加水至5.0000 mL后,添加5.0000 mL叶酸测定用培养液。每个梯度做3 次平行。
1.3.3 灭菌与培养
将所有试管塞好试管塞,于121 ℃灭菌5 min,快速冷却至室温。在无菌条件下向每只试管加入20 μL接种液,另取一只标准管不接种,作为0对照管,混匀。置于(37±1)℃恒温培养箱中培养40 h。
1.3.4 测定与结果计算
使用混匀振荡器将培养好的试管混匀,于540 nm处,以0对照管调节吸光度值为0,依次测定各试管培养液。以标准系列管中叶酸的含量为横坐标,各个标准点吸光度值的平均值为纵坐标,绘制标准曲线。通过标准曲线换算试样系列管中叶酸的相应含量,以此计算样品中叶酸的含量。
1.4 建立数学模型及识别不确定的来源
试验中叶酸含量为下式:

其中,X为试样中叶酸含量(μg/100 g);C为试样稀释液中叶酸浓度的平均值(ng/mL);V为试样提取液的定容体积(mL);m为试样的质量(g);f为稀释倍数;为由ng/g换算为μg/100 g的系数。
通过分析不确定度数学模型可知,叶酸的测量不确定度主要由标准溶液的配制过程、样液配制过程、仪器测量偏差、重复性以及检测方法等几方面引入。
2 结果与分析
2.1 标准溶液的配制过程
标准溶液配制过程引入的不确定度来源主要有:标准物质的纯度、标准品的称量、标准工作液的配制以及标准系列管的配制等。
2.1.1 标准品的纯度引入的不确定度
叶酸标准品的检定证书给出其纯度≥99.00%,假设该标准品纯度在99.00%~100.00%的范围内服从矩形分布,其中位值为99.50%,则相对标准不确定度为:
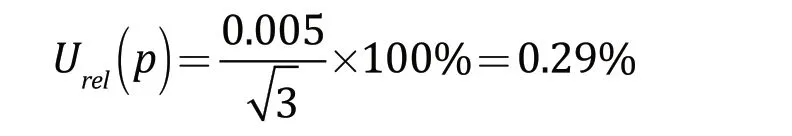
2.1.2 标准品称量引入的不确定度
根据分析天平的检定证书可知,天平的允差范围为±0.1 mg,采用矩形分布,包含因子为,本试验使用减重法称取叶酸标准品20.0 mg,共称重2次,即1 次为空盘质量,1 次为总质量。则标准品称量引入的相对不确定度为
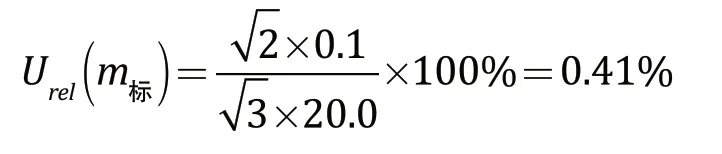
2.1.3 标准工作液配制过程中量具引入的不确定度
称取20.0 mg叶酸标准品后,使用1000.0000 mL容量瓶,定容至刻度,配制成标准储备液。移取1.0000 mL标准储备液至100.0000 mL容量瓶,定容至刻度,配制成标准中间液。移取1.0000 mL标准中间液至1000.0000 mL容量瓶,定容至刻度,配制成标准工作液。该过程中用到1000.0000 mL容量瓶2 次,100.0000 mL容量瓶1次,1.0000 mL移液枪2 次。根据《JJG 646 移液器检定规程》及《JJG 196 常用玻璃量器检定规程》,查得所使用量具的最大允许误差。选用矩形分布,包含因子为,则移液管和容量瓶的不确定度见表1。

表1 标准工作液的配制过程中量具引入的不确定度
根据不确定度的合成公式,标准工作液的配制过程中,由量具所引入的相对标准不确定度为:
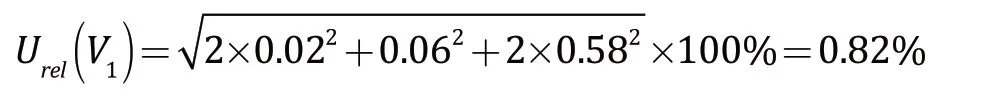
环境温度的变化对标准工作液的配制产生一定的影响,试验所用量具校准的温度为20 ℃。在实际试验过程中,环境的温度波动范围为(20±5)℃,水的体积膨胀系数约为2.1×10-4。因此,假设温度波动均匀分布,包含的因子为 3,则由温度所引入的各量具相对不确定度均是0.06%,标准工作液的配制过程中,由环境温度所引入的相对标准不确定度为:
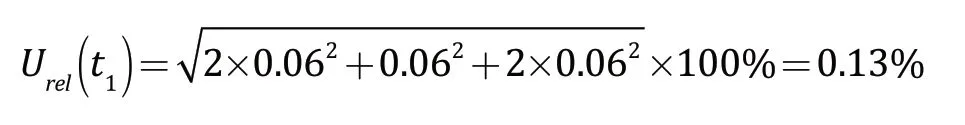
标准工作液的配制所引入的相对标准不确定度为:
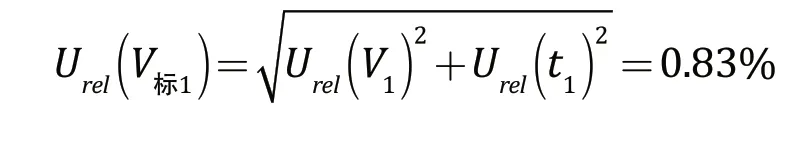
2.1.4 标准系列管的配制引入的不确定度
标准系列管的配制过程中使用1.0000 mL的移液枪吸取了0.2500 mL、0.5000 mL、1.0000 mL,使用5.0000 mL的移液枪吸取了1.5000 mL、2.0000 mL、2.5000 mL、3.0000 mL、4.0000 mL、5.0000 mL。采用矩形分布,包含因子为,则由吸取标准工作液体积的移液枪引入的不确定度见表2。标准系列管配制引入的相对标准不确定度为:
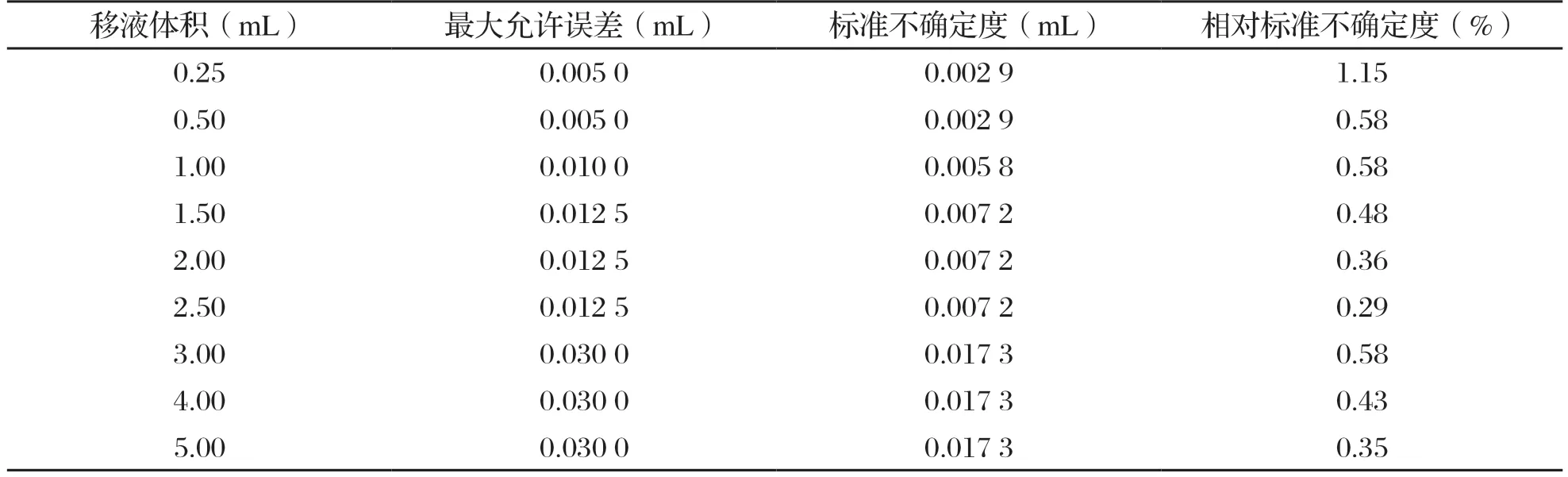
表2 吸取标准工作液体积的移液枪引入的不确定度
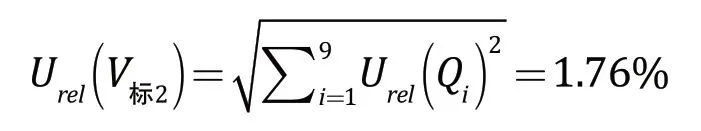
其中,Urel(Qi)为移液枪移取标准工作液体积导致的相对不确定度。
标准溶液的配制过程引入的合成相对标准不确定度为:
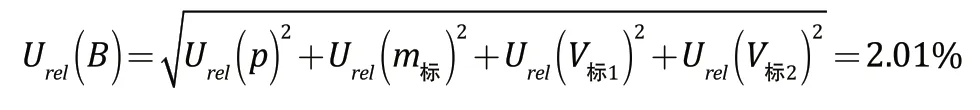
2.2 样液的配制过程引入的不确定度
样液的配制过程所引入的不确定度来源主要有:样品的称量、样品稀释液的配制以及样品系列管的配制等。
2.2.1 样品称量引入的不确定度
根据分析天平的检定证书可知,天平的允差范围为±0.001 g,采用矩形分布,包含因子为,本试验使用减重法称取样品0.500 g,共称重2 次,即一次为空盘质量,一次为总质量。则样品称量引入的相对不确定度为:
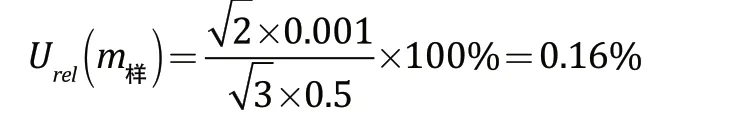
2.2.2 样品稀释液配制过程中引入的不确定度
称取0.500 g样品后,使用100.0000 mL容量瓶定容至刻度,从中移取5.0000~100.0000 mL容量瓶,定容至刻度,配制成样品稀释液。该过程中用到100.0000 mL容量瓶2 次,5.0000 mL移液枪1 次。根据《JJG 646 移液器检定规程》及《JJG 196 常用玻璃量器检定规程》可知所用量具的最大允许误差。采用矩形分布,包含因子为,则移液管和容量瓶的相对标准不确定见表3。

表3 样品稀释液液配制过程量具引入的不确定度
根据不确定度的合成公式,样品稀释液的配制过程中量具所引入的相对标准不确定度为:
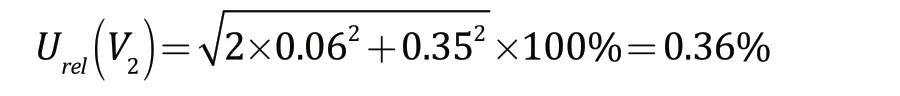
环境温度的变化对样品稀释液配制产生一定的影响,试验所用量具的校准温度为20 ℃。在实际试验过程中,环境温度的波动范围为(20±5)℃,水的体积膨胀系数约为2.1×10-4。因此,假设温度波动均匀分布,包含的因子为,则由温度所引入的各量具相对不确定度均为0.06%,样品稀释液的配制过程中环境温度所引入的相对标准不确定度为:
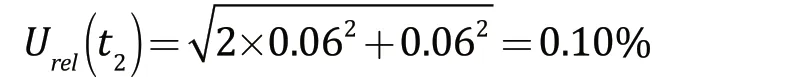
样品稀释液的配制所引入的相对标准不确定度为:
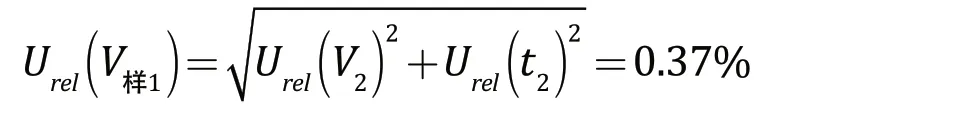
2.2.3 样品系列管配制引入的相对标准不确定度
样品系列管的配制过程中使用了1.0000 mL的移液枪吸取了0.5000、1.0000 mL,使用5.0000 mL的移液枪吸取了2.0000 mL。采用矩形分布,包含因子为,则由吸取样品稀释液液体积的移液枪引入的相对标准不确定度见表4。

表4 吸取样品稀释液体积的移液枪所引入的相对标准不确定度
样品系列管配制引入的相对标准不确定度为:
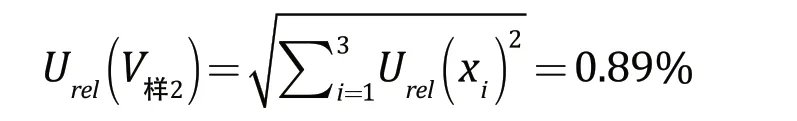
其中,Urel(xi)为移液枪移取样品稀释液体积引入的相对不确定度。
样品的配制引入的合成相对标准不确定度为:
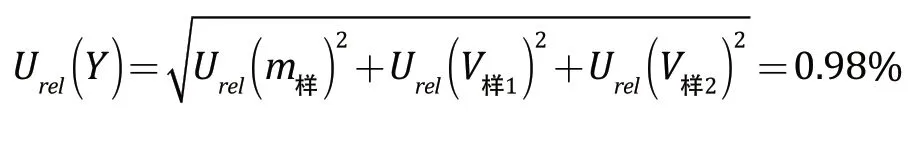
2.3 仪器测量的偏差引入的不确定度
使用紫外分光光度计读取培养后各系列管吸光度值,仪器测量误差主要为透射比的示值误差。由校准报告可得,该仪器透射比最大的允许误差为1.00%,采用矩形分布,包含的因子为,因此仪器测量的偏差所引入的相对不确定度为:
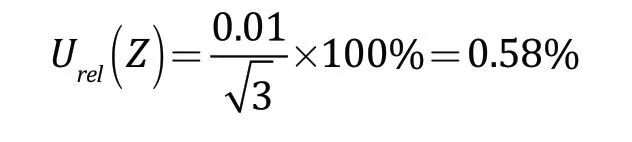
2.4 测量重复性的不确定度
取同一样品进行6 次叶酸含量检测,结果见表5。

表5 样品重复测定结果(n=6)
重复测定所产生的不确定度属A类不确定度[16],依据贝塞尔公式计算由随机效应导致的标准不确定度:
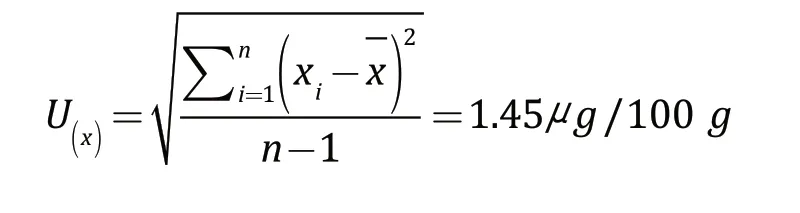
在日常检验过程中,报告结果一般以2 次测量结果平均值表示,则2 次测量的结果平均值的相对标准不确定度为:
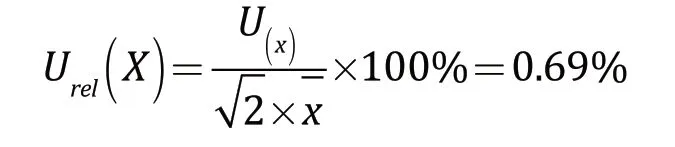
2.5 检测方法引入的不确定度
选择同一样品进行6 次加标回收试验,回收率测定结果见表6。

表6 加标回收试验结果(n=6)
假设分布的类型为三角分布,则由检测的方法所引入的相对不确定度为:
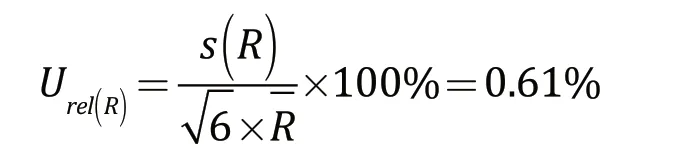
2.6 合成不确定度和扩展不确定度
本研究的主要不确定度由表7所示。

表7 不确定度分量的汇总
故微生物法测定婴幼儿配方乳粉中叶酸含量的合成相对不确定度为:
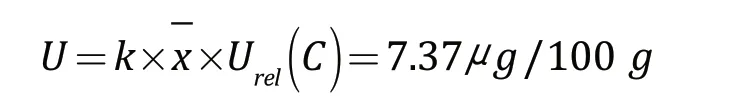
3 结论与讨论
本研究采用微生物法测定婴幼儿配方乳粉中叶酸含量,实验试验所测得的样品叶酸的质量分数为(148.49±7.37)μg/100g,k=2。通过不确定度分量研究可得,影响婴幼儿配方乳粉中叶酸含量检测的主要因素是标准溶液的配制过程和样液配制过程,其他因素为仪器测量偏差、重复性以及检测方法。从研究结果可以看出,标液和样液的配制过程使用到了大量的量具,包括容量瓶、移液枪等,由量具引入的不确定度较大。因此,试验过程中应尽量降低量具使用的误差,严格按照实验试验操作规范操作,对试验用量具进行定期校准和维护。
