杀伤细胞免疫球蛋白样受体和人白细胞抗原C基因型特定前葡萄膜炎的关系
2021-08-21王玉青刘云霞任桂芳滨州市中心血站滨州256613
王玉青 刘云霞 任桂芳②(滨州市中心血站,滨州256613)
葡萄膜炎是虹膜、睫状体、脉络膜及邻近眼部结构的炎症。它是获得性失明的主要原因之一[1]。急性前葡萄膜炎(acute anterior uveitis,AAU)占所有葡萄膜炎病例的85%[2-3]。HLA-B27抗原阳性相关急性前葡萄膜炎(HLA-B27 antigen-positive associated with acute anterior uveitis,B27AAU)和特发性急性前葡萄膜炎(idiopathic acute anterior uveitis,IAAU)是AAU最常见的临床病例[4]。临床上对葡萄膜炎的药物治疗多使用免疫抑制剂,如糖皮质激素、环磷酰胺、环孢素、甲氨蝶呤、秋水仙碱等。B27AAU和IAAU致病的免疫抑制机制尚不清楚。
自然杀伤(natural killer,NK)细胞作为一种对靶细胞能够直接进行杀伤的淋巴细胞,在细胞免疫方面发挥重要作用。杀伤细胞免疫球蛋白样受体(killer cell immunoglobulin-like receptors,KIRs)是一种主要表达在NK细胞和部分T细胞表面的受体。KIR基因编码的跨膜蛋白属免疫球蛋白超家族,共有16个成员:8个抑制型,6个激活型和2个假基因。KIR与其配体的结合调控NK细胞和部分T细胞的活性进而发挥其重要的免疫功能[5-6]。虽然大多数KIR的配体并不知晓,目前其配体鉴定最多是人类白细胞抗原(human leucocyte antigen,HLA)C基因。HLA-C基因具有丰富的多态性,依据其第80位氨基酸的差异把HLA-C基因分成2大组:HLA-C1组是携带精氨酸,HLA-C2组携带赖氨酸。已有报道HLAC1可分别和KIR2DL2、2DL3、2DS2结合,HLA-C2可分别和KIR2DL1、2DS1结合来影响NK细胞的活性[7]。
近年来随着对KIR和HLA-C基因研究的不断深入,不同的眼部疾病和炎症性疾病都与KIR和HLAC基因多态性有关,如Vogt-Koyanagi-Harada(VKH)、重度干眼症(dry eye disease,DED)、原发性Sjögren综合征(primary Sjögren syndrome,SS)以及年龄相关黄斑变性(age-related macular degeneration,AMD)[8-11]等。但迄今未见KIR、HLA-C基因与B27A AU、IAAU关联性的研究报道。本文采用序列特异性引物聚合酶链反应(polymerase chain reaction sequence-specific primer,PCR-SSP)方法就KIR和HLA-C基因型与B27AAU和IAAU的关联性研究报道如下,以为B27AAU和IAAU发生的免疫学机制奠定基础。
1 资料与方法
1.1 资料选取遗传上不相关的确诊为AAU的患者196例以及210例健康者为对照组。患者来自济南市第四人民医院眼科。通过视力、裂隙灯显微镜检查、后段瞳孔扩大检查、x线评价、HLA-B27分型及临床表现确诊。根据葡萄膜炎命名标准化(SUN)工作组的建议,对葡萄膜炎进行了定义和解剖学分类[12]。术语“急性”用于描述以突发性和有限时间(<3个月)为特征的特定葡萄膜炎综合征的病程。本研究将AAU患者分为B27AAU组和IAAU组。根据与AAU相关的HLA-B27基因分型,对B27AAU进行诊断。IAAU的诊断依据眼科检查,前房细胞有无闪光,无玻璃体细胞,虹膜炎、虹膜睫状体炎、前睫状体炎,无感染性病因。排除基因分型HLA-B27的AAU之外的患者被定义为IAAU组患者。所有患者均无关节炎、口腔或生殖器溃疡病史,并由风湿病学家根据相应标准排除了AS、ReA、SpA和Behçet病(BD)的诊断。有眼部手术史、眼外伤、除葡萄膜炎外的、主要全身疾病(包括糖尿病、肾功能衰竭、肝病、血液学和动脉硬化/心血管疾病)的患者排除在外。196例AAU患者中,男性117例,女性79例,年龄33~51岁,平均年龄43岁。同时从本院健康体检中心抽取210名健康者作为对照组。该组由124名男性和86名女性组成,年龄30~55岁,平均年龄为41岁。研究对象均为山东地区汉族。每个参与者须知情同意,并经济南市第四人民医院委员会批准。
1.2 方法
1.2.1 DNA提取EZ Bead system-32 DNA提取工作站(Texas BioGene Inc.)提取血液基因组DNA,严格按照说明书操作。
1.2.2KIR基因检测采用PCR-SSP法对患者和健康者的16个KIR基因进行分型。KIR基因PCR特异性引物序列见表1。(由上海博尚生物技术有限公司合成)。PCR反应体系10µl:包括20 ng的受检基因组DNA、0.2 mmol/L的dNTP、0.5 U的Taq DNA聚合酶(购自Promega)、0.4 µmol/L的引物(除了KIR2DS1的引物为0.8µmol/L外)和1×PCR反应缓冲液。PCR反应参数94℃,4 min;94℃,30 s,65℃,30 s,72℃,90 s,30个循环;72℃,10 min。部分KIR基因PCR扩增的退火温度略有变化:KIR2DS2(63℃)、KIR2DS3(63℃)、KIR2DS4(61℃)和KIR2DS5(63℃)。PCR产物用1~2%琼脂糖凝胶电泳检查,SYNGENE生物图像分析仪进行结果分析。

表1 KIR基因的序列特异性PCR引物Tab.1 Sequence specific PCR primers of KIR genes
1.2.3HLA-C基因型检测采用PCR-SSP法对患者和健康者的HLA-C基因进行分型。HLA-C基因PCR特异性引物序列为C1/C2正向引物:5'-CCGGGGAGCCGCGCA-3',C1反向引物:5'-GCGCAGGTTCCGCAGGC-3',C2反向引物:5'-CGCGCAGTTTCCGCAGGT-3'。PCR反应体系同1.2.2。PCR反应的阳性内对照为生长因子基因(growth hormone gene,GH)。PCR反应参数94℃,120 s;94℃,25 s,70℃,45 s,72℃,30 s,5个循环;94℃,25 s,65℃,45 s,72℃,30 s,21个循环;94℃,25 s,55℃,60 s,72℃,120 s,5个循环;72℃,5 min。PCR产物用1.5%琼脂糖凝胶电泳检查,SYNGENE生物图像分析仪进行结果分析。
1.3 统计学分析HLA-C和KIR基因的表型频率(phenotypic frequency,PF)通过直接计数测得。用SPSS13.0统计软件进行χ2相关分析,Hardy-Weinberg法则证实样本代表性。P<0.05为差异有统计学意义。比值比(odds ratio,OR)分析关联强度,用Woolf公式计算(OR=ad/bc),同时计算95%可信区间(95%confidence interval,95%CI)。
2 结果
2.1KIR基因在患者组和健康对照组中的分布在196例AAU患者中,KIR基因的分布没有偏离Hardy-Weinberg平衡(P=0.28)。与对照组相比,B27AAU患者激活KIR2DS2的频率增加(P=0.022,OR=1.77,95%CI=1.08~2.90),然而,在Bonferroni校正后,差异无统计学意义(P=0.067,表2)。与对照组相比,IAAU患者组抑制性KIR2DL2的频率显著增加(P=0.009,OR=2.25,95%CI=1.31~3.85),而抑制性KIR2DL3的频率显著降低(P=0.000,OR=0.03,95%CI=0.00~0.24)。其他KIR基因和基因型在B27AAU、IAAU和对照组之间的分布差异无统计学意义。

表2 AAU患者和对照组KIR基因频率分布[例(%)]Tab.2 Distributions of KIR gene frequencies in AAU patient and control groups[n(%)]
2.2HLA-C基因在患者组和健康对照组中的分布与对照组相比,B27AAU患者的HLA-C1C1基因型频率显著降低(P=0.034,OR=0.55,95%CI=0.35~0.88,表3)。IAAU患者组HLA-C1C2基因型频率较对 照 组 增 加(P=0.043,OR=1.97,95%CI=1.01~3.82),但经Bonferroni校正后,差异无统计学意义(P=0.128)。与对照组相比,B27AAU组HLA-C1等位基因频率显著降低(P=0.009,OR=0.60,95%CI=0.42~0.84),而HLA-C2等位基因频率显著增加(P=0.009,OR=1.68,95%CI=1.19~2.37)。其他HLA-C等位基因和基因型在B27AAU、IAAU和对照组之间的分布无统计学意义(表3)。
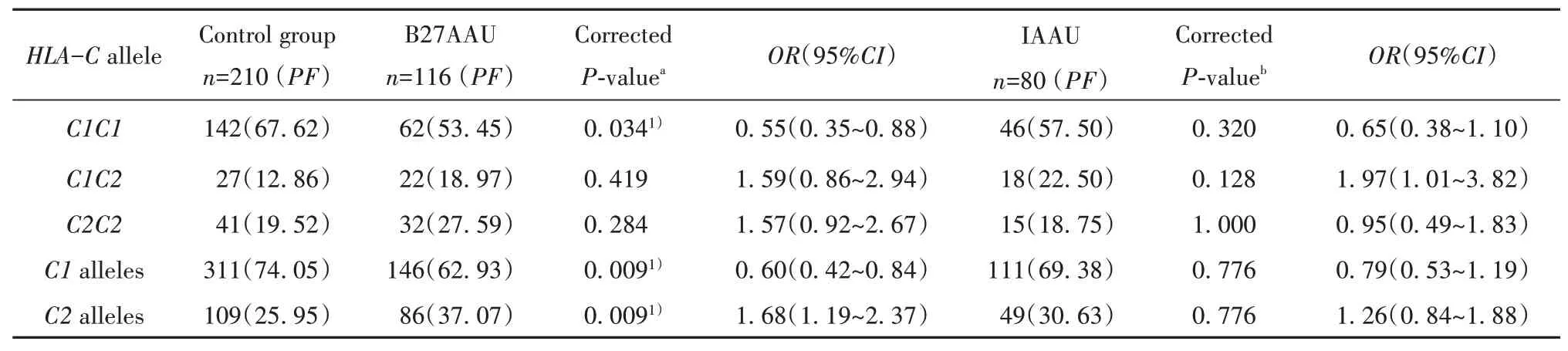
表3 AAU患者和对照组HLA-C等位基因频率分析[例(%)]Tab.3 Distributions of HLA-C allele groups′frequencies in AAU patient and control groups[n(%)]
2.3HLA-C基因和其KIR基因受体在患者组和健康对照组中的分布由于目前鉴定KIR的配体最多的是HLA-C分子,因此分析了HLA-C和KIR基因即受体和配体组合的基因型频率在B27AAU和IAAU患者组与对照组中的分布(表4)。HLA-C1等位基因与其已知的KIR配体KIR2DS2与B27AAU的相关性(P=0.019,OR=1.90,95%CI=1.10~3.29),但Bonferroni校正后差异无统计学意义(P=0.058)。与对照组相比,B27AAU患者的KIR2DL1/HLA-C2基因型频率显著增加(P=0.044,OR=1.78,95%CI=1.12~2.83)。HLA-C1等位基因和KIR2DL2、KIR2DL3与IAAU显著相关(P=0.044,OR=2.05,95%CI=1.14~3.66,P=0.001,OR=0.36,95%CI=0.20~0.62)。其他HLA-C和KIR基因型的表型频率在B27AAU、IAAU和对照组之间的分布无统计学意义(表4)。
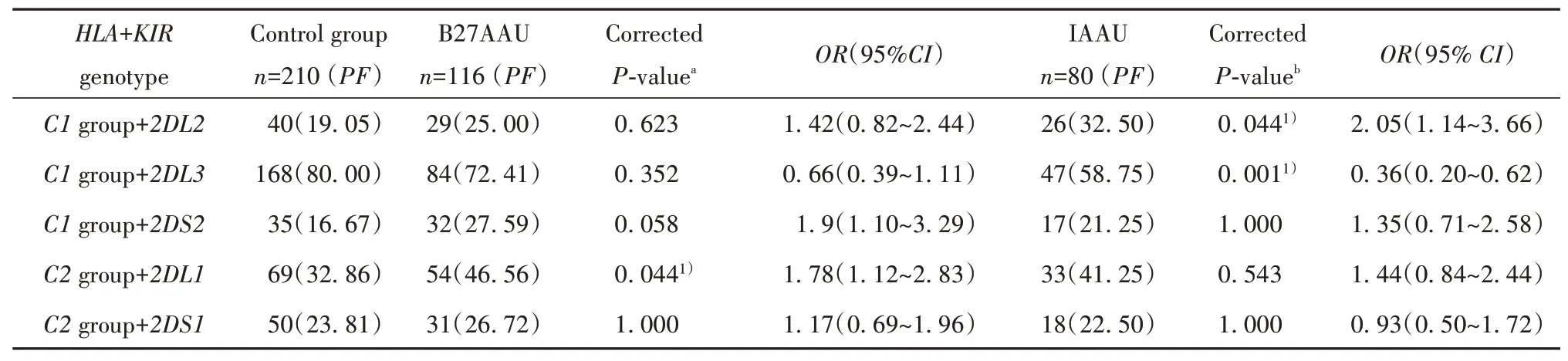
表4 AAU患者和对照组HLA-C和KIR基因配对基因型频率分布[例(%)]Tab.4 Distributions of HLA-C and KIR gene paired genotype frequencies in AAU patient and control groups[n(%)]
3 讨论
KIR和其相应配体对NK细胞在自身免疫性疾病中发挥重要作用[13-16]。然而,KIR和HLA基因在B27AAU和IAAU发病机制中的作用尚不清楚。本研究是首次报道B27 AAU、IAAU与KIR、HLA-C基因之间的关联。
在本研究中,KIR基因和HLA-C等位基因在B27AAU、IAAU和对照组中分布的频率不同,对照组中KIR基因和HLA-C等位基因的分布与中国汉族人群中的分布相似[9,17]。IAAU组与对照组相比,KIR2DL3和KIR2DL3/HLA-C1的频率显著降低,提示KIR2DL3和KIR2DL3/HLA-C1对IAAU有保护作用。KIR2DL3/HLA-C1比其他HLA-C抑制NK细胞的信号较弱,并且可能具有较低的激活阈值[18]。KHAKOO等[19]报道,KIR2DL3/HLA-C1基因型增加了早期丙型肝炎病毒(hepatitis C virus,HCV)感染的清除率,减弱其抑制功能。与对照组相比,IAAU组的KIR2DL2和KIR2DL2/HLA-C1的频率显著增加,提 示KIR2DL2和KIR2DL2/HLA-C1对IAAU敏感。LEVINSON等[20]人报道KIR2DL2/HLA-C1结合增加Birdshot脉络膜视网膜病变的风险。先前的研究表明,KIR2DL2似乎可以抵消KIR2DL3/HLA-C1的清除HCV的保护作用[19]。结果与KIR2DL2/HLA-C1和KIR2DL3/HLA-C1在IAAU组的分布相似。
B27AAU患者的HLA-C1C1基因型 和HLA-C1等位基因频率分别低于对照组,这提示HLA-C1在B27AAU中起保护作用。然而,患者的HLA-C2等位基因频率高于对照组,提示HLA-C2在B27AAU的发病机制中起着不利的作用。此研究结果与前人报道相似:BD患者的HLA-C1频率显著低于健康对照组,而HLA-C2的频率显著高于健康对照组[15]。结果提示,HLA-C1对B27AAU和BD具有保护作用,而HLA-C2与两种眼病的易感风险相关。
KIRs及其配体的结合分析提示KIR2DL1/HLAC2组合与B27AAU呈正相关,HLA-C2与抑制性配体结合时对B27AAU有易感性是由于HLA-C2的易感性。先前的研究表明,B27AAU患者与对照的高加索白人之间KIR2DL1/HLA-C2组合频率差异无统计学意义[21]。结果的不同可能是由于人群的差异造成的。同时也提示KIR与HLA的相互作用与不同的遗传背景有关。
综上所述,本研究分析了KIR基因和HLA-C配体与中国汉族AAU病例的关系,提示KIR和HLA-C基因可以作为1个标记物,为有效治疗疾病提供个性化方案。HLA-C配体与受体结合可能诱导NK细胞活化和抑制AAU进展。KIR受体及其HLA配体的基因分型、表达和功能,以及这些配体和受体在疾病发病中的作用有待进一步研究。
