实时剪切波弹性成像超声检查在甲状腺良恶性结节鉴别诊断中的应用
2021-08-20沈冬花周玲莉杨金君
沈冬花,李 蓉,周玲莉,杨金君,冀 波,王 龚
(1.解放军火箭军特色医学中心超声诊断科,北京 100088;2.解放军联勤保障部队第九二二医院超声诊断科,湖南 衡阳 421001;3.咸阳市第一人民医院超声医学科,陕西 咸阳 712000)
甲状腺结节是是临床常见的内分泌性疾病,在成年人群中的患病率较高[1-2]。该疾病存在良恶性类型之分,且不同类型结节的治疗及预后存在差异。因此,早期评估甲状腺结节的恶性程度并积极治疗,是改善患者预后的关键[3]。超声检查是临床诊断甲状腺疾病的常用检查手段,但常规二维超声存在图像重叠的问题,诊断的特异度及敏感度有待提高[4-5]。Ophir[6]于1991年提出了超声弹性成像技术,该技术可通过测定病灶组织的硬度来鉴定肿块的良恶性,经过不断发展,超声弹性成像技术已发展至实时剪切波弹性成像超声(Shear wave elastography ultrasound,SWE)阶段。SWE是一种新型超声检查技术,在乳腺、前列腺和甲状腺等病灶的检查中,具有良好应用效果[7]。本研究在甲状腺结节良恶性的评估中应用SWE技术,取得良好效果,现报告如下。
1 资料与方法
1.1 一般资料 回顾性分析2018年1月至2020年8月在本院接受治疗的180例甲状腺良恶性结节患的临床及影像学资料。病例纳入标准:①患者经穿刺活检或手术确诊存在甲状腺结节,并依据甲状腺细胞病理学Bethesda报告系统进行分类和诊断;②患者行穿刺活检或手术病理检查前知情同意;③患者性别不限,年龄≥18岁;④均接受常规超声及SWE检查,临床、影像学资料完整。排除标准:①完全钙化或囊性化患者;②存在颈部放化疗或手术治疗史患者;③合并其他恶性肿瘤患者。180例患者中,男69例,女111例,年龄25~65岁,平均(49.23±7.35)岁。病理检查共检出良性结节107例(59.44%),其中结节性甲状腺肿52例,甲状腺腺瘤38例,桥本氏甲状腺炎17例;检出恶性结节73例(40.56%),其中乳头状癌54例,滤泡状癌19例。根据穿刺活检及手术病理检查结果将患者分为良性组(n=107)和恶性组(n=73)。
1.2 研究方法 采用彩色多普勒超声诊断仪(SIEMENS ACUSON OX ANA3)对患者进行甲状腺区域常规超声及SWE检查,探头频率为2~10 MHz。患者取仰卧位,首先行常规超声检查,观察甲状腺结节的位置、大小、形态、内部回声、钙化及血流等情况。启动剪切波弹性模式,选取病灶最大切面对患者进行SWE检查;嘱咐患者屏气,轻放探头,移动取样框至病灶范围2~3倍,设定量程为0~100 kPa,剪切波为0~10 m/s,待图像稳定后,定帧,冻结图像。使用仪器自带测量程序测量甲状腺结节位置。由2名经验丰富的影像学医师对图像进行双盲分析,判断结节良恶性情况,双方结论一致为最终结果。
1.3 观察指标 ①计算甲状腺结节与周围组织的杨氏模量值(E),包括最大(Emax)、最小(Emin)和平均值(Emean),重复计算3次后,取平均值。②根据影像报告,参考TI-RADS分级标准对结甲状腺节进行分级;其中,1级:超声显示腺体大小、回声均正常,甲状腺组织无结节或呈弥漫性增生;2级:检查所见为良性,恶性肿瘤风险为0%;3级:可能良性,恶性肿瘤风险<2%;4a级:恶性肿瘤的可能比例5%~10%;4b级:恶性肿瘤的可能比例为11%~80%;5级:恶性肿瘤的可能比例>80%[7]。③以手术病理检查为“金标准”,绘制受试者工作特征(ROC)曲线,计算曲线下面积(AUC),分析SWE检查的Emax、Emin和Emean指标诊断甲状腺恶性结节的最佳阈值、敏感度和特异度;联合诊断以Emax、Emin和Emean的最佳阈值为基础,E>最佳阈值诊断为甲状腺恶性结节,结节的三个指标中任意一项满足以上条件即可诊断。

2 结 果
2.1 两组患者TI-RADS分级和SWE参数比较 良性组患者检出3级48例,4a级37例,4b级13例,5级9例,恶性组患者检出3级11例,4a级14例,4b级37例,5级17例,两组比较,差异有统计学意义(Z=36.059,P<0.001)。恶性组患者的Emax、Emin和Emean值均大于良性组患者(P<0.05),见表1。

表1 两组患者Emax、Emin和Emean值比较(kPa)
2.2 两组患者不同病理特征病灶Emean值比较 良性组中,不同钙化程度患者的Emean比较,差异有统计学意义(F=7.821,P<0.001),且病灶微小钙化、粗大钙化患者的Emean均高于无钙化患者(微小钙化:q=4.694,P=0.004;粗大钙化:q=3.699,P=0.010),病灶微小钙化、粗大钙化患者的Emean比较无统计学差异(q=1.348,P=0.343);病灶位置、是否囊性病变对Emean值无明显影响(病灶位置:t=1.595,P=0.112;囊性变:t=1.799,P=0.073)。恶性组中,病灶位置、是否囊性病变和病灶钙化情况对Emean值无明显影响(病灶位置:t=1.378,P=0.170;囊性变:t=1.056,P=0.293;钙化:F=1.638,P=0.104)。见表2。

表2 两组患者不同病理特征病灶Emean值比较
2.3 SWE检查诊断甲状腺恶性结节价值 对Emax、Emin和Emean值进一步绘制ROC曲线,分析其预测价值(图1)。Emax、Emin和Emean的AUC值分别为0.844、0.794和0.824,对甲状腺恶性结节的诊断均具有统计学差异(P<0.001)。各指标的最佳阈值、Younden’s指数、敏感度和特异度值,见表3。

图1 Emax、Emin和Emean值及联合诊断甲状腺恶性结节ROC曲线
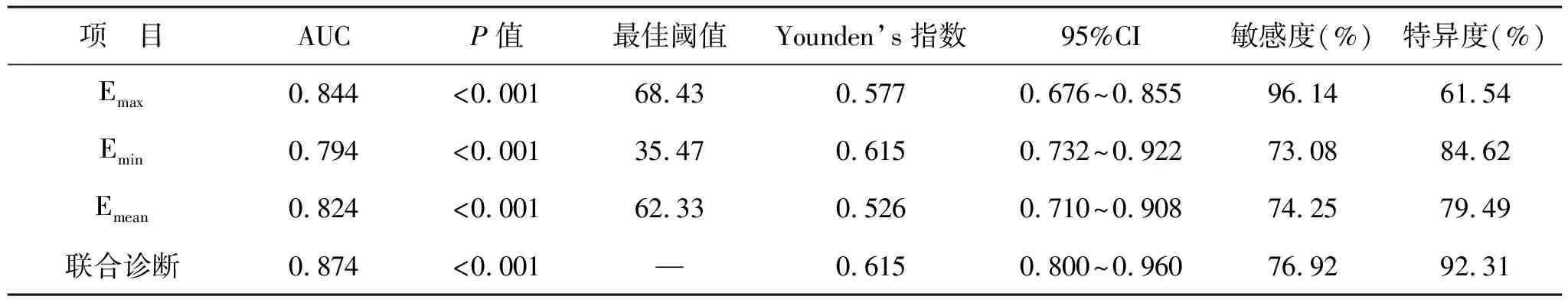
表3 Emax、Emin和Emean值诊断恶性结节的价值
3 讨 论
甲状腺良恶性结节具有不同的病理形态和组织学变异,通过对结节硬度的检测,可明确结节的良恶性特征[8-9]。SWE可通过剪切波在不同组织中的传播,反映不同弹性系数组织的特点,克服了传统二维超声成像敏感度较低的缺点,在临床各类疾病的诊疗及预后判断中具有重要意义[10]。黄靓等[11]在甲状腺高度可疑恶性结节的诊断中应用SWE技术,发现SWE技术对TI-RADS分级为5级的结节诊断准确率、敏感度和特异度均较高,分别为80.82%、72.50%和90.91%,认为SWE可为5级甲状腺结节良恶性的早期鉴别诊断提供一定辅助作用。
SWE作为一种新型弹性成像剪切技术,可通过检测剪切波在组织中的传播速度实时计算出病灶组织的E值,包括Emax、Emin和Emean。尽管Emin即可反映不同组织的硬度,但由于剪切波不能在液体中传播,而甲状腺结节在发生恶性变化的过程中会出现液化、出血等现象,因此临床应用时多与Emax和Emean联合检测[12-14]。本研究结果显示,恶性组患者的Emax、Emin和Emean值均大于良性组患者,提示恶性甲状腺结节的硬度高于良性结节。Fukuhara等[15]研究了SWE成像与甲状腺病变病理结构的相关性,发现构成恶性甲状腺结节的纤维组织和脂肪组织较正常组织、良性结节更多,组织中传播的剪切波速度更快,对应的E值更高,反映到临床上即为组织硬度更大。因此,SWE的E参数可为甲状腺结节良恶性诊断提供参考依据。一项有关甲状腺结节病理特征分析的研究[16]表明,甲状腺结节中的钙化灶会影响肿块的E值。本研究中,良性组病灶微小钙化及粗大钙化患者的Emean均高于无钙化患者,提示甲状腺结节的病理特征会影响SWE的诊断。而恶性组中病灶钙化情况对Emean值无明显影响,可能与甲状腺结节数量较少有关,也可能与诊断过程中检查者操作步骤、患者呼吸频率和颈部动脉搏动等因素有关[17-18]。尽管结节的位置、囊性病变等不会显著影响E值,但由于钙化灶的存在,在一定程度上会影响SWE对甲状腺结节的鉴别诊断,引起假阳性的产生。因此,在临床诊断过程中需尽可能避开粗大钙化灶,以提高SWE的诊断精度[19]。为了进一步探究SWE技术对恶性甲状腺结节的鉴别诊断价值,本研究绘制了SWE各参数的ROC曲线,并计算了AUC值。研究结果显示,Emax、Emin和Emean及其联合诊断的AUC值分别为、0.844、0.794、0.824和0.874,提示Emax、Emin和Emean值在诊断甲状腺恶性结节方面具有良好价值,而三者联合诊断可提高甲状腺恶性结节的诊断准确率。以Emax值为参考时,对恶性甲状腺结节的漏误诊率低于Emin和Emean,这可能与SWE显示的Emax的最佳阈值相对更稳定,不易受组织病理成分变化影响等因素有关[20]。
综上所述,SWE技术测定的甲状腺结节Emax、Emin和Emean值可定量评估结节硬度,在良恶性甲状腺结节的诊断中具有一定临床应用价值。本研究存在一定不足,纳入对象在选择方面存在偏倚,未对不同类型的甲状腺疾病进行分析,未探究SWE技术对不同大小的甲状腺结节的诊断效果,以上内容有待在后续研究中进行完善与分析。
