Na+/K+A TPaseβ1亚基对乙型肝炎病毒复制的影响及其作用机制
2021-08-19曹扬王莹
曹扬,王莹
吉林大学第一医院,吉林 长春 130021
乙型肝炎病毒(hepatitis B virus,HBV)感染致全球超过2.5亿人罹患多种肝病,每年约140万人死于HBV相关疾病,包括肝硬化、肝衰竭和肝细胞癌[1-2]。目前,已批准的HBV感染治疗药物仅为核苷酸类似物和干扰素(interferon,IFN)[3],细胞内抗病毒因子用于治疗HBV感染尚处于研发阶段,是HBV领域重要的基础研究之一。Na+/K+ATPaseβ1亚基(ATP1B1)作为细胞Na+/K+ATPase调节亚基的主要组分,不仅调控其自身活性,还参与T细胞活化[4]。有研究表明,Na+/K+ATPaseβ亚基与某些病毒感染有关,如ATP1B1可作为人类巨细胞病毒(human cytomegalovirus,HCMV)UL136蛋白及甲、乙型流感病毒M2蛋白的伴侣调控病毒复制[5-7];β3亚基可降低HeLa细胞中骨髓基质细胞抗原-2(bone marrow stromal cell antigen-2,BST-2)介导的人类免疫缺陷病毒-1(human immunodeficiency virus-1,HIV-1)产生的限制[8],还可与肠道病毒71(enterovirus 71,EV71)的3A蛋白相互作用,通过增强Ⅰ型IFN的产生来抑制EV71复制[9]。
维甲酸诱导基因蛋白-Ⅰ(retinoic acid-inducible gene-Ⅰ,RIG-Ⅰ)和黑色素瘤分化相关抗原5(melanoma differentiation-associated 5,MDA5)是细胞内识别病毒异常mRNA的模式识别受体(pattern recognition receptor,PRR),参与免疫应答调节,在天然免疫反应中具有重要作用[10-11]。研究表明,RIG-Ⅰ主要识别5′端带三磷酸基团的RNA(包括单链和双链RNA)和短的双链RNA;MDA5主要识别普通的双链RNA或poly(I:C)。未感染病毒的条件下,RIG-Ⅰ和MDA5的上调也可促进细胞分泌Ⅰ型IFN,可启动下游IFN诱导基因(interferon stimulated gene,ISG)的表达,其中包括较多天然抗病毒因子,如ISG15、ISG56、GBPs、OASs和BST-2等,对不同病毒具有拮抗作用[12-15]。本研究通过建立过表达和沉默ATP1B1的HepG2细胞模型,探讨ATP1B1对细胞中HBV复制的影响,为寻找抗HBV的新治疗靶点和方法提供实验依据。
1 材料与方法
1.1 菌株、细胞、质粒及基因 HepG2(No.77400,ATCC)、HepG2.2.15、HepAD38细胞、质粒VR1012-ATP1B1(由cDNA文库获取带有HA标签的ATP1B1基因,插入至载体VR1012)及载体VR1012由吉林大学第一医院检验科保存并提供;稳定表达HBV的质粒pHBV1.3(D基因型)由上海复旦大学基础医学院李建华教授惠赠;siRNA ATP1B1及siRNA NC序列均由广州市锐博生物科技有限公司合成。
1.2 主要试剂 鼠抗HA单克隆抗体(901514)购自美国Biolegend公司;鼠抗β-tubulin单克隆抗体(A00702-100)购自北京锐抗生物科技有限公司;兔抗ATP1B1单克隆抗体(ab193669)购自美国Abcam公司;碱性磷酸酶标记的羊抗兔IgG(111-055-045)及羊抗鼠IgG(115-055-003)购自美国Jackson Immuno公司;Lipofectamine 2000转染试剂购自美国Invitrogen公司;胎牛血清购自美国Gibco公司;HBsAg诊断试剂盒购自上海科华生物工程股份有限公司;Transcriptor First Strand cDNASynthesis Kit购自瑞士Roche公司;CCK8试剂盒购自上海翊圣生物科技有限公司。
1.3 细胞培养 将HepG2、HepG2.2.15、HepAD38细胞按(1~2)×106个/孔分别接种至6孔板,用含10%灭活胎牛血清的DMEM培养基于37℃,5%CO2细胞培养箱培养24 h,用于后续转染。
1.4 引物设计及合成 根据NCBI中登录的HBV、IFNα、IFNβ、IFNγ、IL-28a、IL-29、OAS2、BST-2、ISG56、ISG15基因序列(登录号分别为:NC_003977、NM_024013、NM_002176、NM_000619、NM_172138、NM_172140、NM_001032731、NM_004335、NM_001548、NM_005101),应用Primer 5.0软件设计引物,引物序列见表1。引物由生工生物工程(上海)股份有限公司合成。

表1 qPCR引物序列Tab.1 Primer sequences for qPCR
1.5 过表达A T P1B1对H B V复制影响的检测 采用Lipofectamine 2000转染试剂将400 ng质粒pHBV1.3分别与400 ng质粒VR1012-ATP1B1及载体VR1012共转染HepG2细胞,于37℃培养4 h;更换含10%胎牛血清的DMEM培养基,于37℃,5%CO2培养48h,分别收集细胞和培养上清液。
1.5.1 细胞中ATP1B1的表达 采用Western blot法。用RIPA试剂提取细胞总蛋白,经12%SDSPAGE分离后,转移至NC膜,用脱脂牛奶于室温封闭0.5 h;加入兔抗ATP1B1单克隆抗体(1∶1 000稀释)及鼠抗β-tubulin单克隆抗体(1∶2 000稀释),于4℃作用过夜;用PBST洗涤3次,加入碱性磷酸酶标记的羊抗兔IgG及羊抗鼠IgG(均1∶2 000稀释),于4℃作用1 h;将NC膜与碱性磷酸酶底物BCIP和NBT反应8 mim显色。
1.5.2 培养上清中HBsAg抗原含量检测 采用HBsAg诊断试剂盒检测培养上清液中的HBsAg含量,重复检测3次。
1.5.3 细胞中HBV DNA及RNA含量检测 采用qRT-PCR法。用Trizol提取细胞总RNA,经Transcriptor First Strand cDNASynthesisKit反转录为cDNA,以其为模板,进行PCR扩增。PCR反应体系为:cDNA 1μL,HBV DNA-RT-F/R或HBV RNA-RT-F/R引物(10μmol/L)各0.4μL,SYBR 9.2μL,H2O 9μL。PCR反应条件为:95℃2 min;95℃30 s,55℃30 s,72℃30 s,共40个循环。以GAPDH作为内参,每个样本设3个复孔,以样品的2-△△Ct值作为目标基因的DNA及RNA含量。重复检测3次。
1.6 A T P1B1表达量对H epG2细胞培养上清中H Bs A g含量影响的检测 按1.5项方法将400ng质粒pHBV1.3分别与0、200、400、800 ng的质粒VR1012-ATP1B1共转染HepG2细胞,转染48 h后,按1.5.1和1.5.2项方法分别检测细胞中ATP1B1蛋白的表达和培养上清液中的HBsAg含量。
1.7 沉默A T P1B1对H B V复制影响的检测 按1.5项方法将400 ng质粒pHBV1.3分别与100 nmol/L siRNA ATP1B1及siRNA NC序列共转染HepG2细胞,转染48 h后,按1.5.1、1.5.2及1.5.3项方法分别检测HepG2细胞中ATP1B1蛋白的表达、培养上清中HBsAg含量及细胞中HBV DNA、RNA含量。
1.8 过表达及沉默A T P1B3对H epG2细胞增殖影响的检测 按1.5项方法将siRNA ATP1B1及质粒VR1012-ATP1B1分别转染HepG2细胞,同时设未转染组,转染0、24,48,72 h后,采用CCK8试剂盒测定A450,并按下式计算相对细胞增殖率。
相对细胞增殖率(%)=(转染组A450-未转染组A450)/未转染组A450×100%
1.9 过表达A T P1B1对H B V复制影响的验证 按1.5项方法将质粒VR1012-ATP1B1分别转染HepG2.2.15及HepAD38细胞,同时设未转染组,转染后48 h,按1.5.1和1.5.2项分别检测细胞中ATP1B1蛋白的表达和培养上清液中HBsAg含量。
1.10 过表达A T P1B1对H epG2细胞中细胞因子及P RR表达影响的检测 按1.5项方法将400 ng质粒VR1012-ATP1B1及载体VR1012分别转染HepG2细胞,转染12 h后,qRT-PCR法检测细胞内IFNα、IFNβ、IFNγ和IL-28A、IL-29的mRNA含量,方法同1.5.3项,引物为IFNα-RT-F/R、IFNβ-RTF/R、IFNγ-RT-F/R、IL-28a-RT-F/R、IL-29-RT-F;Western blot法检测细胞内RIG-Ⅰ和MDA5蛋白表达,方法同1.5.1项,其中一抗为兔抗RIG-Ⅰ单克隆抗体和兔抗MDA5单克隆抗体,稀释度为1∶1 000。
1.11 过表达A T P1B1对ISG表达影响的检测 按1.5项方法将400 ng质粒VR1012-ATP1B1及载体VR1012分别转染HepG2细胞,转染12 h后,收集细胞,qRT-PCR法 检 测 细 胞 内ISG15、ISG56、OAS2、BST-2、GBP-1的mRNA含量,方法同1.5.3项,引物为ISG15-RT-F/R、ISG56-RT-F/R、OAS2-RT-F/R、BST-2-RT-F/R、GBP-1-RT-F/R。
1.12 统计学分析 应用SPSS 17.0统计软件进行统计学分析,试验数据均采用均值±标准差()表示,组间比较采用t检验,以P<0.05为差异有统计学意义。
2 结果
2.1 过表达A T P1B1对H B V复制的影响 VR1012-ATP1B1组HepG2细胞中ATP1B1蛋白呈过表达,于相对分子质量约35 000处可见其与兔抗ATP1B1单克隆抗体的特异性结合条带,大小与预期相符;VR1012组未见目的蛋白条带。见图1。VR1012-ATP1B1组及VR1012组HepG2细胞培养上清中HBsAg含量(A450)分别为0.83和0.16,VR1012-ATP1B1组比VR1012组下降了约80%(t=5.940,P<0.01)。VR1012-ATP1B1组HepG2细胞内HBV DNA和RNA含量均明显低于VR1012组(t分别为6.34和6.95,P均<0.01),见图2。

图1 HepG2细胞中ATP1B1蛋白的过表达Fig.1 Overexpression of ATP1B1 in HepG2 cells
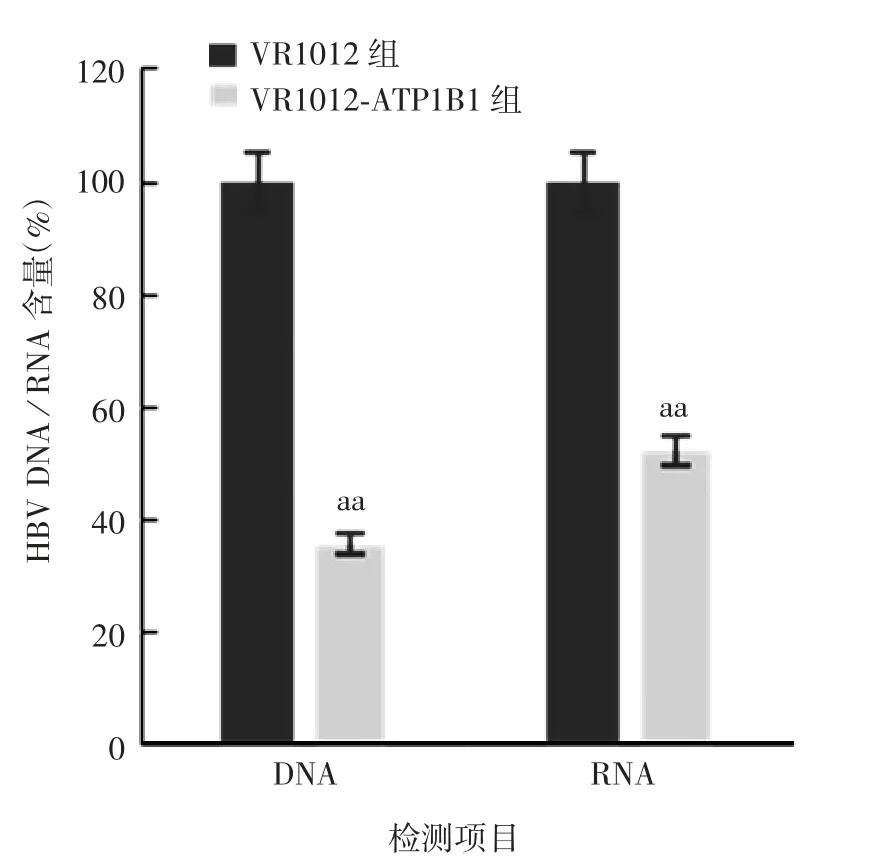
图2 过表达ATP1B1的HepG2细胞中HBVDNA及RNA的含量Fig.2 HBV DNA and RNA contents in HepG2 cells overexpressing ATP1B1
2.2 A T P1B1表达量对H epG2细胞培养上清中H Bs A g含量的影响 随着质粒VR1012-ATP1B1加入剂量的增大,ATP1B1表达量逐渐升高,见图3。0、200、400、800 ng质粒VR1012-ATP1B1组HepG2细胞培养上清中HBsAg含量(A450)分别为0.92、0.54、0.27、0.18,随着ATP1B1表达量的升高,与0 ng质粒VR1012-ATP1B1组比较,HepG2细胞培养上清中HBsAg含量逐渐降低(t分别为6.63、6.84、6.93,P均<0.01)。表明ATP1B1对HBsAg表达的抑制作用呈剂量依赖性。

图3 不同ATP1B1表达量的HepG2细胞培养上清中的HBsAg含量Fig.3 HBsAg contents in culture supernatant of HepG2 cells with various ATP1B1 expression levels
2.3 沉默A T P1B1对H epG2细胞培养上清中H Bs A g含量的影响 siRNANC组HepG2细胞中可见ATP1B1蛋白表达,于相对分子质量约35 000处可见其与兔抗ATP1B1单克隆抗体的特异性结合条带,大小与预期相符;与siRNANC比较,siRNAATP1B1组ATP1B1表达水平下调。见图4。siRNA ATP1B1组及siRNA NC组HepG2细胞培养上清中HBsAg含量(A450)分别为2.10和0.61,siRNA ATP1B1组显著高于siRNA NC组(t=8.04,P<0.01),表明沉默ATP1B1可增加HepG2细胞培养上清中HBsAg的含量。siRNA ATP1B1组HepG2细胞中HBV DNA和RNA含量明显高于siRNANC组(t分别为7.54和6.88,P<0.01),见图5。
图4 HepG2细胞中ATP1B1蛋白的沉默表达Fig.4 Silencing of ATP1B1 expression in HepG2 cells

图5 沉默ATP1B1的HepG2细胞中HBV DNA及RNA的含量Fig.5 HBV DNA and RNA contents in HepG2 cells in which ATP1B1 is silenced
2.4 过表达及沉默A T P1B3对H epG2细胞增殖的影响 转染0、24、48、72 h时,3组HepG2细胞的相对细胞增殖率差异均无统计学意义(t分别为0.34、0.56、0.43,P均>0.05),见图6。表明转染72 h内,细胞活力不受ATP1B1过表达或沉默的影响。

图6 过表达及沉默ATP1B3的HepG2细胞的相对细胞增殖率Fig.6 Relative proliferation rates of HepG2 cells in which ATP1B3 is overexpressed or silenced
2.5 过表达A T P1B1对H B V复制影响的验证 Hep-G2.2.15和HepAD38细胞中可见ATP1B1蛋白表达,于相对分子质量约35 000处可见其与兔抗ATP1B1单克隆抗体的特异性结合条带,大小与预期相符;未转染组未见该条带。见图7。HepG2.2.15组、HepAD38组及未转染组细胞培养上清中HBsAg含量(A450)分别为0.38、0.32、0.75,HepG2.2.15组和HepAD38组显著低于未转染组(t分别为7.73和7.23,P均<0.01)。

图7 过表达ATP1B1的HepG2.2.15和HepAD38细胞中ATP1B1蛋白的表达Fig.7 ATP1B1 expression in HepG2.2.15 and HepAD38 cells overexpressing ATP1B1
2.6 过表达A T P1B1对H epG2细胞中细胞因子及P RR表达的影响 与VR1012组比较,VR1012-ATP1B1组HepG2细胞中IFNα、IFNβ和IL-29 mRNA含量明显升高(t分别为6.84、7.76、3.65,P分别为<0.01、<0.01、<0.05),IFNγ和IL-28A mRNA含量差异无统计学意义(t分别为0.32和1.43,P均>0.05),见图8。VR1012-ATP1B1组HepG2细胞中RIG-I和MDA5蛋白表达高于VR1012组,见图9。表明ATP1B1通过上调细胞内抗病毒PRRs,诱导Ⅰ和Ⅲ型IFN的表达,实现抑制HBV复制的功能。
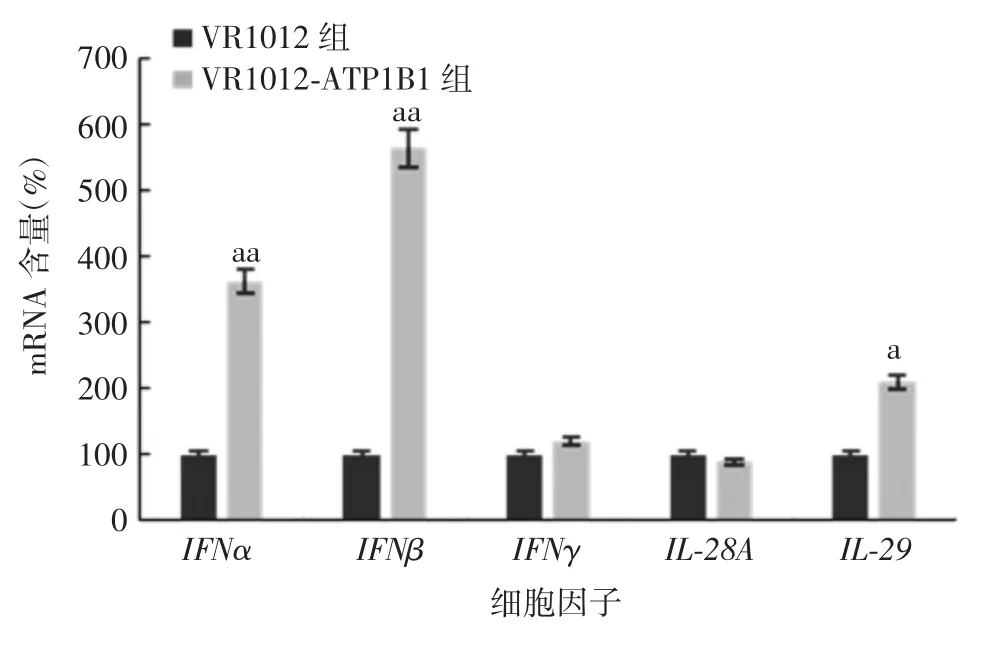
图8 过表达ATP1B1对HepG2细胞中细胞因子表达的影响Fig.8 Effect of ATP1B1 overexpression on expression of cytokines in HepG2 cells

图9 过表达ATP1B1对HepG2细胞中RIG-Ⅰ和MDA5表达的影响Fig.9 Effect of ATP1B1 overexpression on expressions of RIG-Ⅰand MDA5 in HepG2 cells
2.7 过表达A T P1B1对I S G表达的影响 与VR1012组比较,VR1012-ATP1B1组HepG2细胞中ISG15、ISG56、OAS2和BST-2 mRNA含量显著升高(t分别为7.33、7.52、8.04、6.83,P均<0.01),GBP-1 mRNA含量差异无统计学意义(t=0.45,P>0.05),见图10。推测ATP1B1可通过诱导一系列ISG的表达发挥抗HBV作用。

图10 过表达ATP1B1的HepG2细胞中ISG的表达水平Fig.10 Expression levels of ISG in HepG2 cells overexpressing ATP1B1
3 讨论
HBV感染已成为长期存在的全球性公共卫生问题,随着基因工程疫苗的生产和使用,乙肝疫苗的接种率逐年上升,HBV感染率呈下降趋势,但每年仍有众多患者死于HBV感染引发的各种肝病。因此,寻找抗病毒疗法仍是治疗HBV感染的重要研究方向之一[16]。
由于HBV缺少体外感染模型,本实验采用了瞬时转染模型,在肝细胞来源的细胞系HepG2和经重组方法稳定表达HBV的HepG2.2.15、HepAD38细胞中,测定了过表达和沉默ATP1B1蛋白对于HBV复制的影响,结果显示,ATP1B1过表达可下调HBV总DNA、RNA和胞外HBsAg的含量;沉默ATP1B1明显增强肝细胞内HBV DNA和RNA的水平,同时诱导胞外HBsAg表达水平的上升。因此,ATP1B1具有拮抗HBV复制的功能。有报道表明,ATP1B1同家族蛋白可通过协同抗病毒因子BST-2和介导HBsAg的泛素化降解实现抗病毒作用[17];另有研究发现,ATP1B3对HIV和EV71具有不同的调控作用[8-9]。本实验对ATP1B1与HBV作用机制的研究发现,ATP1B1可诱导细胞内模式受体RIG-Ⅰ和MDA5的表达,进而增强肝细胞内Ⅰ和Ⅲ型IFN的表达,使肝细胞在ATP1B1的作用下,产生更多的ISG蛋白,最终实现抗HBV的功能。
IFN和ISG是天然免疫的重要因子。本实验结果显示,ATP1B1可诱导细胞内Ⅰ和Ⅲ型IFN表达,其中Ⅲ型IFN表达较弱,同时,细胞中RIG-Ⅰ和MDA5的表达水平升高,推测ATP1B1可通过上调细胞内RIG-Ⅰ和MDA5调控IFN的表达,具体诱导机制尚需进一步研究。IFN可通过JAK/STAT等通路诱导细胞内ISG的表达。研究发现,一系列ISG的表达,可通过不同机制发挥抗病毒功能,如非允许性细胞中存在的载脂蛋白B mRNA编辑酶催化多肽样蛋白3G,该蛋白是机体内在的抗病毒因子,其在HIV反转录过程中,利用其胞嘧啶脱氨酶的活性,使所形成的病毒负链cDNA中的胞嘧啶脱氨,降低病毒感染力[18]。BST-2则可通过将病毒粒子锚定在细胞膜上,限制病毒释放实现抗HIV和HBV的功能[15]。本实验对已知的抗病毒ISG进行了测定,结果发现,ATP1B1可诱导以Ⅰ型IFN诱导的ISG15、ISG56、OAS2和BST-2等抗病毒因子,推测这些因子是ATP1B1抗HBV的主要下游因子。综上所述,ATP1B1在不影响肝细胞增殖的情况下,可能是通过诱导Ⅰ型IFN(IFNα、IFNβ),上调肝细胞内ISG15、ISG56、BST-2和OAS2等ISG,利用不同机制抑制HBV在肝细胞内的复制,本实验为寻找抗HBV的新治疗靶点和方法提供了实验依据。
