还原氧化石墨烯/泡沫铜电极用于微生物电合成系统中二氧化碳合成有机物
2021-08-19廖梦根
廖梦根,王 黎,柳 焜,胡 宁,余 杨
(武汉科技大学 环境污染绿色控制与修复技术研究中心,湖北 武汉 430081)
CO2是温室气体的主要成分之一,近年来森林的大量砍伐导致CO2的固定受到影响,需要找到替代的方法。利用生物电化学生产燃料受到了众多科学家的广泛关注[1-3]。在众多CO2还原方法中,微生物电合成系统(MES)是最有效的方法之一,不但反应速率可控,而且产物选择性高[4]。阴极材料、阴极微生物、阴极电势、质子交换膜等材料的选择会对MES系统的合成效果产生影响[5-7]。DONG等[8]通过构造包含粒状活性炭颗粒的流化三维电极使乙酸的体积产率提高了2.8倍。VU等[9]通过在MES中加入导电纳米磁铁使甲烷产率提高了22.1%。ARYAL等[10]修改3D石墨烯网络,使CO2电合成乙酸的速率提高了6.8倍。阴极材料作为MES的核心可使微生物更加高效地进行电子转移,其表面可形成致密的生物膜并完成底物的质量传递[11-13]。泡沫铜(CuF)的三维多孔网状结构具有电导率高、比表面积大、有利于微生物附着、成本低廉等优点,完美地契合了电极材料的选择要求。
本工作将金属电极与碳基材料相结合,制备了还原氧化石墨烯/泡沫铜电极,对微生物没有排斥作用,并且提高了CO2电合成有机物的产物转化效率。
1 实验部分
1.1 材料、试剂和仪器
MES菌种来自武汉市某污水处理厂厌氧池的活性污泥。
泡沫铜:孔隙率0.88,昆山富汇立电子有限公司;阳离子交换膜:美国萘酚公司;钛板:欧帝富有限公司;钛丝:欧帝富有限公司;天然鳞片状石墨:南京嘉慧碳素材料有限公司。
所用试剂均为分析纯。CO2,N2:纯度大于99.999%。
XL30 ESEM-TMP型环境扫描电子显微镜:荷兰Philips公司;ISC-90型高效液相色谱仪:塞默飞世尔科技公司;TRACE1300型气相色谱仪:塞默飞世尔科技公司;PB-10型精密pH 计:上海佑科仪器仪表有限公司;218型Ag/AgCl参比电极:相对于氢标准电极电位为+197 mV,上海雷磁仪器有限公司;CHI660E型电化学工作站:上海辰华仪器有限公司。
1.2 MES
MES的阴极室与阳极室间用阳离子交换膜隔开。阳离子交换膜在使用前分别用30%(w)过氧化氢溶液、0.5 mol/L浓硫酸和去离子水煮沸1 h进行预处理,以增加孔隙率并激活负责离子转移的磺化基团。阴、阳2室的有效容积均为600 mL,用直径0.5 mm的钛丝作导线,阴极以还原氧化石墨烯改性后的泡沫铜(5.00 cm×5.00 cm×0.02 cm)作为工作电极,阳极以钛板(6.00 cm×6.00 cm×0.05 cm)作为对电极,参比电极采用Ag/AgCl电极并置于阴极电解室中。
阳极室电解液:浓度为0.05 mol/L的磷酸缓冲溶液,pH=6.8。
阴极室液体培养基: K2HPO42.18 g/L,KH2PO41.70 g/L,NH4Cl 1.25 g/L,KCl 0.10 g/L,NaCl 0.80 g/L,MgCl2·6H2O 1.00 g/L,CaCl2·2H2O 0.30 g/L,NaHCO32.50 g/L,维生素溶液 10 mL/L,微量元素溶液 10 mL/L,pH =6.8。
1.3 实验方法
1.3.1 氧化石墨烯的制备
先用改良Hammers法[14]制备氧化石墨烯。用稀盐酸洗涤产物至pH=7,再用去离子水充分洗涤至滤液中无SO42-,最后用真空干燥箱干燥24 h。
1.3.2 还原氧化石墨烯/泡沫铜电极的制备
按照文献[10]的方法将氧化石墨烯涂覆在泡沫铜上,随后将覆盖氧化石墨烯的泡沫铜用60 mL含量为0.5 mg/mL的抗坏血酸溶液还原2 h。用超纯水充分洗涤还原氧化石墨烯/泡沫铜电极,最后将还原氧化石墨烯/泡沫铜电极放入真空干燥箱干燥12 h。
1.3.3 MES中有机物的CO2还原合成
分别取50 mL驯化好的活性污泥接入改性泡沫铜MES(改性后MES)[10]和未改性泡沫铜MES(改性前MES)中,同时在阴极室中加入500 mL液体培养基。通过向阴极室中加入2-溴乙基磺酸钠抑制污泥中产甲烷菌的活性[15]。设置阴极电势为-0.8 V(vs Ag/AgCl),反应温度为(36±1)℃,阴极液pH为(6.0±0.1)。在阴极室的底部通入CO2进行微孔曝气(曝气流量20 mL/min,曝气时间40 min,静止时间4 h)。阳极进行没有微生物的氧化反应,阴极进行有电化学功能菌的还原反应。反应温度用数显恒温水浴锅进行控制,反应装置稳定运行即成功启动。同时设置无微生物对照组,其运行条件均与实验组一致。
1.4 分析方法
1.4.1 微生物形态的SEM表征
用无菌剪刀从阴极泡沫铜上剪取1 cm×1 cm大小的薄片,用w=2.5%的戊二醛溶液固定24 h;分别用w=25%,50%,70%,85%,95%,100%的乙醇各脱水1次,每次15 min;最后用乙酸异戊酯置换2次,每次15 min。试样干燥后喷金,采用扫描电子显微镜观察阴极电极上微生物的形态。
1.4.2 电化学分析
MES稳定运行一段时间后,阳极连接对电极,阴极连接工作电极,Ag/AgCl电极作为参比电极,记录电流随时间的变化情况。在本研究中,所有的电位数据均相对于Ag/AgCl参比电极,电压输出、电流监测均采用电化学工作站。一个周期运行结束后,进行数据分析,对时间与电流积分,计算出一个运行周期输入的电量。设置工作电压为-0.8 V,扫描频率为0.01 kHz~100 kHz,振幅为5 mV,通过等效电路模型得到阴极的电化学阻抗。利用电化学工作站对MES进行循环伏安扫描,扫描参数:扫描电势范围-1.0 V ~0.8 V,扫描频率0.005 V/s。
1.4.3 电化学功能菌的DNA高通量测序
采用454高通量测序技术[16]对MES反应前和反应10 d后还原氧化石墨烯/泡沫铜电极表面的微生物群落进行DNA高通量测序。
2 结果与讨论
2.1 SEM分析
改性前后泡沫铜电极的SEM照片见图1。由图1a可以看出泡沫铜的表面为三维多层孔洞结构,为其提供更大的比表面积。由图1b可见少量微生物附着在泡沫铜表面。由图1c可以明显看到改性后的泡沫铜电极表面覆盖了一层还原氧化石墨烯,显著增加其比表面积。由图1d可见,改性的泡沫铜电极表面附着了更多的微生物,微生物的形态多样,主要以杆状菌为主,且微生物主要附着在还原氧化石墨烯上。这表明还原氧化石墨烯相比泡沫铜更有利于微生物的附着生长,改性后的电极材料具有良好的生物亲和性。

图1 改性前后泡沫铜电极的SEM照片
2.2 电化学分析
2.2.1 电流
在MES运行期间,用电化学工作站记录改性前后MES与无微生物对照组的电流变化情况,其电流随反应时间的变化见图2。
由图2可见,在改性前MES的最大电流为26.28 mA,改性后MES的最大电流为34.09 mA。此结果表明还原氧化石墨烯改性MES可以提高阴极电流,这是因为泡沫铜电极经过改性后提高了比表面积,使得反应过程中电子的传递量增加,并且还原氧化石墨烯自身就具有导电性,因而MES的电流增大。无微生物对照组在外加电势相同的情况下几乎没有产生电流。而系统中电流越大也就意味着阴极得到的激发态电子越多,阴极发生催化还原的反应越剧烈,越有利于电化学功能菌还原CO2生成有机物。
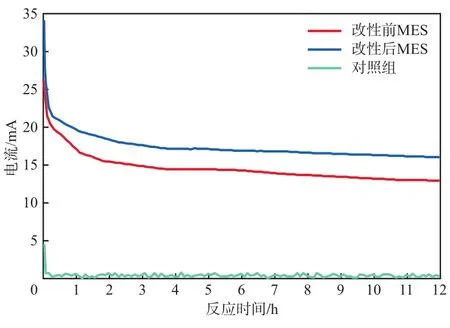
图2 MES电流随反应时间的变化
2.2.2 循环伏安曲线
MES的循环伏安曲线见图3。由图3可见:改性前MES和改性后MES与对照组相比,一个反应周期结束后的电流相应增加,表明实验组具有生物膜的阴极的电化学活性较高;改性前MES的循环伏安曲线在-0.50 V左右处出现了一个还原峰,改性后MES的循环伏安曲线在-0.63 V附近处出现了还原峰,与对照组比对,可以排除是因为析氢反应造成的,由此确定该峰为CO2的还原峰;MES的循环伏安曲线为非对称曲线,表明CO2还原过程是不可逆的。以上结果表明,采用微生物阴极构建的微生物电化学合成系统确实可以降低CO2还原的过电位。
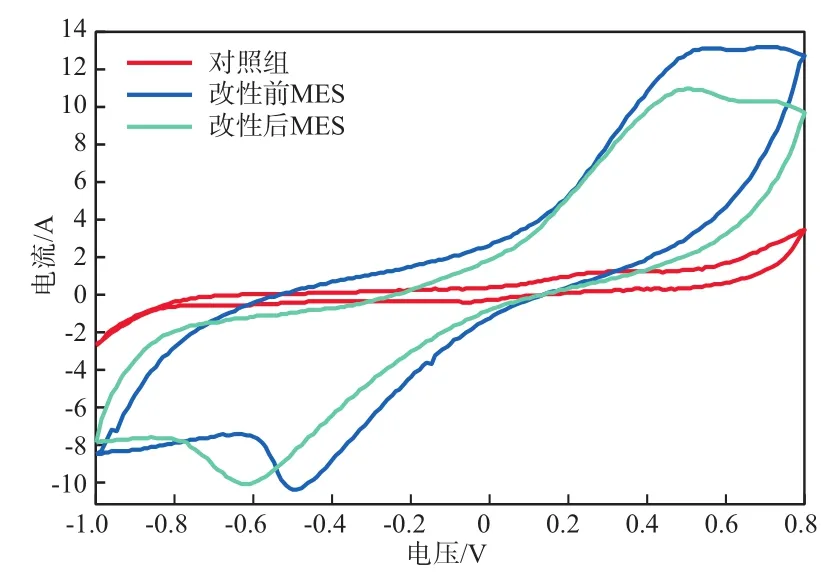
图3 MES的循环伏安曲线
2.2.3 电化学阻抗谱
改性前后生物阴极电极的电化学交流阻抗谱图见图4。
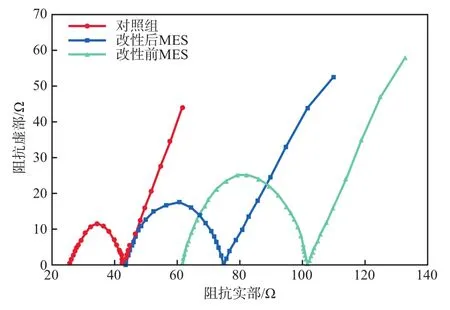
图4 改性前后生物阴极电极的电化学交流阻抗谱图
由图4可见:电化学交流阻抗谱图均由两部分组成,一部分为半圆弧型的高频区,另一部分为斜直线的低频区;高频区半圆弧曲线描述的是反应物在电极表面处发生氧化还原反应时的反应阻抗,圆弧直径与MES系统的电荷转移电阻成正比;低频区的斜线表示反应底物在电极表面扩散时的扩散阻抗,影响扩散阻抗的主要因素是涂层材料的微观结构,其斜线的长度与扩散阻抗呈正相关。
图4的等效电路见图5。根据图5对生物阴极电极电化学交流阻抗谱的数据进行拟合,得到的拟合参数见表1。由表1可见,改性前生物阴极电极和改性后生物阴极电极的电荷转移电阻分别为39.75 Ω和30.84 Ω,均高于对照组,表明生物阴极电极挂膜和改性后能显著提高电子传递速率,从而提高产酸和产气效果;另外,对比改性前后阴极电极的内阻发现,对照组的内阻为26.07 Ω,改性后生物阴极电极的内阻为44.06 Ω,表明阴极电极挂膜后和改性后提高了电极的内阻;而改性前生物阴极电极的内阻为62.09 Ω,对比改性前后内阻发现,改性后生物阴极电极的内阻更低,表明生物阴极改性可以降低系统生物阴极内阻。
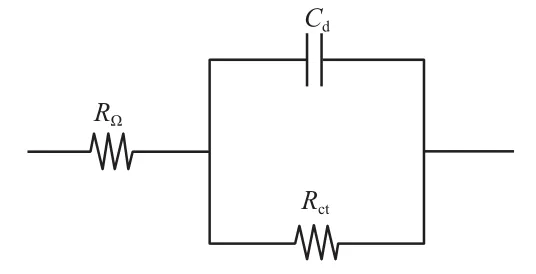
图5 生物阴极电极电化学交流阻抗谱的等效电路
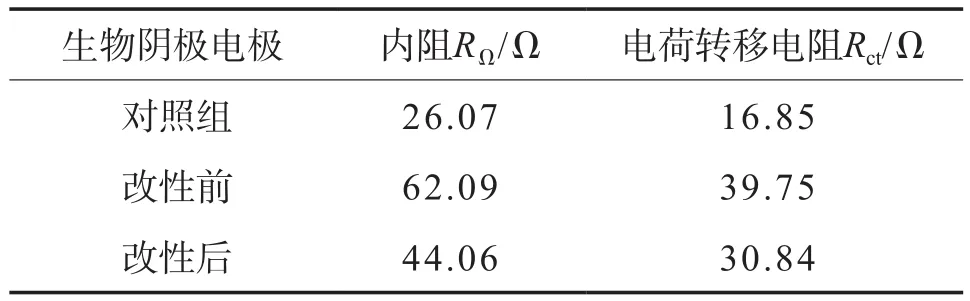
表1 生物阴极电极电化学交流阻抗谱等效电路的拟合参数
2.3 MES的有机物产量
在外加阴极电势为-0.8 V的条件下,改性前后MES的乙酸、丁酸产量和pH的变化见图6。由图6可见:在改性前MES的反应周期内,阴极室中第一天就能测到乙酸的生成,其质量浓度为57.0 mg/L;而丁酸的生成是在反应周期的第3天开始的,在第4天时质量浓度达到10.3 mg/L,反应进行到第10天时乙酸生成速率明显减慢,乙酸和丁酸的积累量达到最大,质量浓度分别为246.0 mg/L和90.4 mg/L,这可能是由于随着反应进行,部分乙酸通过链延长的方式转化成了丁酸[17],导致乙酸生成速率的下降;随着乙酸、丁酸的积累,pH数值从7.1下降至6.3。
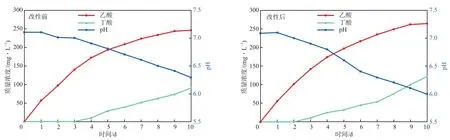
图6 改性前后MES的乙酸、丁酸产量和pH的变化
由图6还可见:在改性后MES的反应周期内,乙酸的积累量随着反应的进行呈现出先上升后趋于平稳的趋势,而丁酸的生成比改性前MES提前了1 d;pH随着乙酸、丁酸的积累,数值从7.1下降至6.0,相比于改性前数值略微降低,原因主要是乙酸、丁酸产量相对增多;经过10 d的积累,乙酸的质量浓度最终达到265.0 mg/L,丁酸的质量浓度最终达到122.5 mg/L,相比于改性前分别增长了8%和35%。
2.4 电化学功能菌的DNA高通量测序
将MES反应前和反应10 d后还原氧化石墨烯/泡沫铜电极表面微生物群落的DNA高通量测序结果与数据库比较,在科水平上进行分类,得到还原氧化石墨烯/泡沫铜电极表面的微生物菌群结构,见图7。
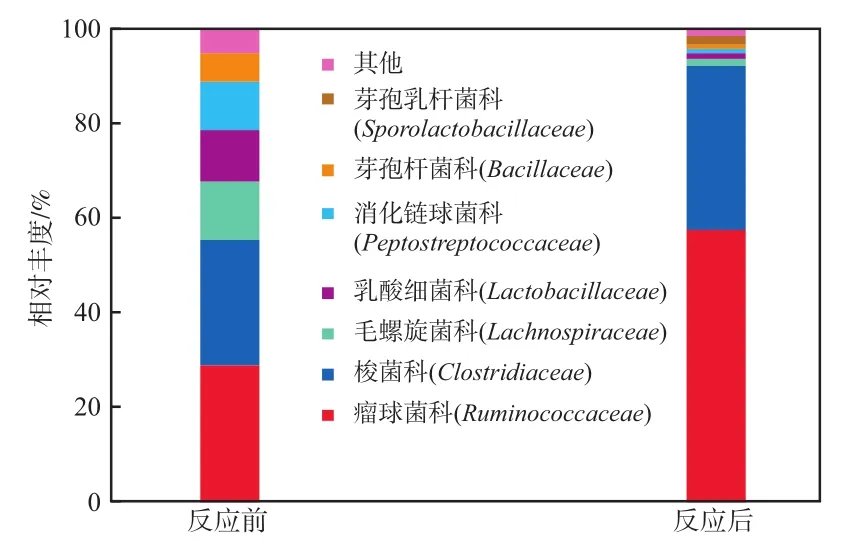
图7 还原氧化石墨烯/泡沫铜电极表面的微生物菌群结构
由图7可见:反应前电极表面的优势菌种分属于瘤球菌科(Ruminococcaceae)、梭菌科(Clostridiaceae)、毛螺旋菌科(Lachnospiraceae)、乳酸细菌科(Lactobacillaceae)、消化链球菌科(Peptostreptococcaceae)和芽孢杆菌科(Bacillaceae),相对丰度分别为28.97%、26.48%、12.37%、10.83%、10.19%和6.06%;反应后电极表面优势菌种主要分属于瘤球菌科和梭菌科[18-19],其相对丰度分别为57.52%和34.69%;相对于反应前的优势菌种,反应后电极表面瘤球菌科和梭菌科细菌的相对丰度分别提高0.98倍和0.31倍,其他菌种由于不适应环境而数量大幅减少。目前有较多文献报道表明梭菌科细菌可以利用电子和质子还原CO2生成乙酸、丁酸,而瘤球菌科细菌的主要产物为乙酸[13,20]。通过DNA高通量测序进行菌群结构分析的结果可以发现,通过生物阴极外加电势确实可以改善MES生物阴极表面生物膜上的菌群结构,筛选出能够利用CO2的具有电化学活性的微生物。
3 结论
a)泡沫铜电极经还原氧化石墨烯改性后,三维空间网状结构更有利于微生物的附着,同时表现出更好的电化学性能。改性后的阴极电极不仅能够降低CO2还原的过电位,而且还具有更好的催化性能。
b)在外加阴极电势为-0.8 V条件下,当反应进行到第10天时,改性前MES中乙酸和丁酸的积累量达到最大,质量浓度分别为246.0 mg/L和90.4 mg/L;改性后MES中乙酸和丁酸的最终质量浓度分别达到265.0 mg/L和122.5 mg/L,相比于改性前分别增长了8%和35%。
c)反应后还原氧化石墨烯/泡沫铜电极表面瘤球菌科(Ruminococcaceae)和梭菌科(Clostridiaceae)细菌的相对丰度相比反应前分别提高0.98倍和0.31倍,其丰度分别为57.52%和34.69%。其他菌种由于不适应环境而数量大幅减少。
