2,4,6-三氯苯酚对污泥性能和菌群结构的影响
2021-08-19李刚强徐永贵赵建国金宝丹
李 玉,李刚强,徐永贵,赵建国,张 珂,金宝丹
(1. 郑州轻工业大学 材料与化学工程学院环境污染治理与生态修复河南省协同创新中心,河南 郑州 450001;2. 郑州航空港区明港水务有限公司,河南 郑州 450001;3. 河南省对外科技交流中心,河南 郑州 450001)
钢铁、制药、纺织、造纸等行业废水以及垃圾焚烧、农药降解和水体氯消毒等过程产生的废水中均含有多种氯酚类污染物[1-3],质量浓度高达几十至上百mg/L[4]。一些市政污水和污染水体中的氯酚含量也在μg/L到mg/L范围内[5]。氯酚类化合物可通过食物链向高等生物体内转移,即使是低浓度的氯酚进入人体,也会对其免疫、神经、呼吸等系统产生毒性作用[6]。因此,氯酚类化合物已被许多国家列为优先控制污染物,我国颁布的《生活饮用水卫生标准》(GB 5749—2006)[7]也将其列为常规水质监测项目。
通常选用活性污泥工艺处理含氯酚废水,在降解废水中氯酚类污染物的同时可去除其他污染物[8]。为实现活性污泥中降解氯酚的优势菌群快速富集,可在氯酚废水处理过程中投加易降解碳源,通过共代谢的方式去除氯酚。但碳源类型及添加比例会引起污泥絮体结构和菌群结构发生改变[8]。另外,可通过采用不同的反应器以及调整运行参数等手段提高活性污泥的抗冲击和耐受能力,进而更有效地降解氯酚[5,9]。废水中污染物的降解是通过微生物代谢过程中产生的酶实现的,氯酚类污染物在降解过程中会产生过量自由基,可导致蛋白质失活、脂质过氧化和DNA损伤等[10-11]。而微生物产生的过氧化氢酶(CAT)和超氧化物歧化酶(SOD)可清除自由基,在维持微生物活性方面起到重要作用[12]。脱氢酶(DHA)活性可用来表征污染物的降解程度[13]。
本研究采用序批式生物反应器(SBR)处理进水质量浓度为10 mg/L的2,4,6-三氯苯酚(2,4,6-TCP)模拟废水,考察2,4,6-TCP对污泥性能和菌群结构的影响,以期为含氯酚废水的处理提供参考。
1 实验部分
1.1 试剂和仪器
2,4,6-TCP(纯度大于98.0%),Tokyo化工有限公司提供;HPLC级甲醇(纯度大于99.9%),北京京科瑞达科技有限公司;碳酸氢钠、盐酸、磷酸、高锰酸钾、磷酸二氢钾和重铬酸钾等:均为分析纯。
LC-10ATVP型高效液相色谱仪:日本岛津公司;ICS 1000型离子色谱仪:美国瓦里安仪器公司;TGL-20bR型高速低温离心机:上海安亭科学仪器厂;Five Easy TM型pH计:瑞士METTLER TOLEDO公司;YSI Pro1020型便携式溶解氧(DO)计:美国YSI公司。
1.2 污泥接种及SBR运行
取市政污水处理厂曝气池污泥,用自来水清洗3次并曝气24 h后接种至有效体积为5 L的2个圆柱形SBR中,SBR的外径和高度分别为20 cm和25 cm。混合液悬浮固体浓度(MLSS)和污泥体积指数(SVI)分别为2.5 g/L和90 mL/g。实验期间,模拟废水中的碳源由甲醇提供,进水COD为(300 ±20)mg/L。模拟废水中补充微生物代谢所需的氮、磷和金属元素[8]。
采用碳酸氢钠溶液和稀盐酸溶液调整进水pH为7.2±0.4。实验组SBR投加进水质量浓度为10 mg/L的2,4,6-TCP,对照组SBR则不投加2,4,6-TCP。SBR每天运行2个周期,每个周期12.00 h,包括进水0.15 h,运行11.00 h,静置0.70 h和排水0.15 h。采用定时开关控制SBR运行期间为间歇曝气,曝气与不曝气时间均设置为2.00 h,DO为(1.5±0.5)mg/L,并通过搅拌使DO与活性污泥充分接触。2个SBR共计运行76 d。
1.3 分析方法
采用pH计和DO计定期测定SBR运行过程中的pH和DO;采用重铬酸盐法[14]和重量法[15]分别测定出水COD和MLSS;采用高效液相色谱仪测定水相和泥相中的2,4,6-TCP质量浓度;采用离子色谱仪测定水相中Cl-质量浓度。
1.4 酶活性分析
取SBR泥水混合液在12 000 r/min和4 ℃条件下高速低温离心5 min,弃去上清液,用磷酸缓冲液清洗污泥3次,所得污泥用于酶活性的测定。采用高锰酸钾滴定法测定CAT活性[16];采用加入人工受氢体氯化三苯基四氮唑(TTC)的方法测定DHA活性[16];采用购自南京建成科技有限公司的试剂盒测定SOD活性。每个样品的酶活性测定重复3次。
1.5 菌群结构分析
当实验组SBR运行结束后,采用溶酶菌-SDS-氯仿异戊醇法提取污泥的基因组DNA[17]。细菌16 S扩增上游引物(357-F-GC)和下游引物(518r)序列分别为5’-CGCCCGCCGCGCGCGGCGGGCG GGGCGGGGGCACGGGGGGGGCCTACGAGGC AGCAG-3’,5’- ATTACCGCGGCTGCTGG-3’。按照BioLinker公司提供的说明书进行PCR反应和Reconditioning PCR反应,其扩增产物通过40%~60%的变性梯度凝胶电泳分离,电泳结束后对凝胶染色、拍照,并用灭菌刀切割优势条带。
采用AxyPrep DNA凝胶回收试剂盒(AXYGEN)回收切割条带中的PCR产物,该产物的二次扩增引物去掉GC发夹结构,利用BioLinker公司的pED-T载体试剂盒克隆PCR产物。挑选平板上的克隆,用Amp抗性LB培养基培养,待菌液浓度培养至OD600值为2~3时,对菌液进行PCR扩增,扩增产物由上海BioSune 生物技术有限公司进行测序和整理。为保证测序结果的准确性,每个样品做3个平行实验。
2 结果与讨论
2.1 SBR出水COD随运行时间的变化情况
SBR出水COD随运行时间的变化见图1。考虑到温度显著影响微生物的代谢[18],故从运行第10天开始利用加热棒控制SBR的水温为(25±1)℃,发现对照组SBR出水COD短暂升高,表明微生物需要一定的时间来应对水温的突然升高。此后,对照组SBR出水COD逐渐降低并趋于稳定。从22 d至运行结束,其出水COD在(85.7±14.0)mg/L的范围内波动。
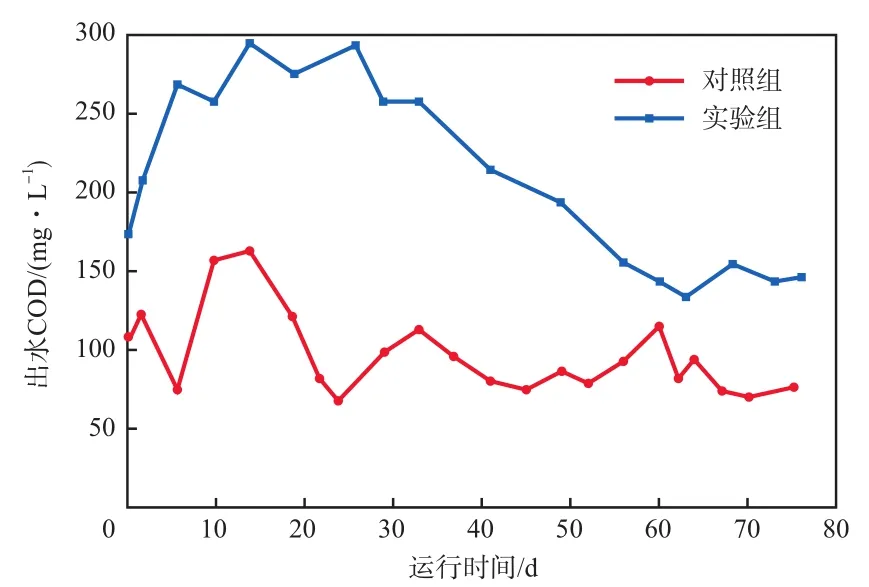
图1 SBR出水COD随运行时间的变化
SBR运行1~14 d,实验组SBR出水COD逐渐升高,在第14 天时达到292.8 mg/L,推断认为进水中的2,4,6-TCP显著抑制污泥活性;运行14~60 d,SBR出水COD逐渐降低,60 d后COD在(143.0±7.6)mg/L的范围内波动。在整个SBR运行阶段,实验组SBR的出水COD显著高于对照组,表明2,4,6-TCP的毒性持续影响污泥活性。
2.2 MLSS随运行时间的变化情况
MLSS随运行时间的变化见图2。由图2可见:对照组SBR的MLSS在2.5 g/L附近上下波动;实验组SBR的MLSS随运行时间逐渐降低,在第25天时低至1.6 g/L;随着运行时间的延长,降解2,4,6-TCP的优势菌逐渐富集,污泥活性部分恢复。在整个SBR运行阶段,实验组SBR的MLSS一直低于对照组,这是因为氯酚类化合物是一类解偶联剂,可抑制微生物的代谢生长[19]。
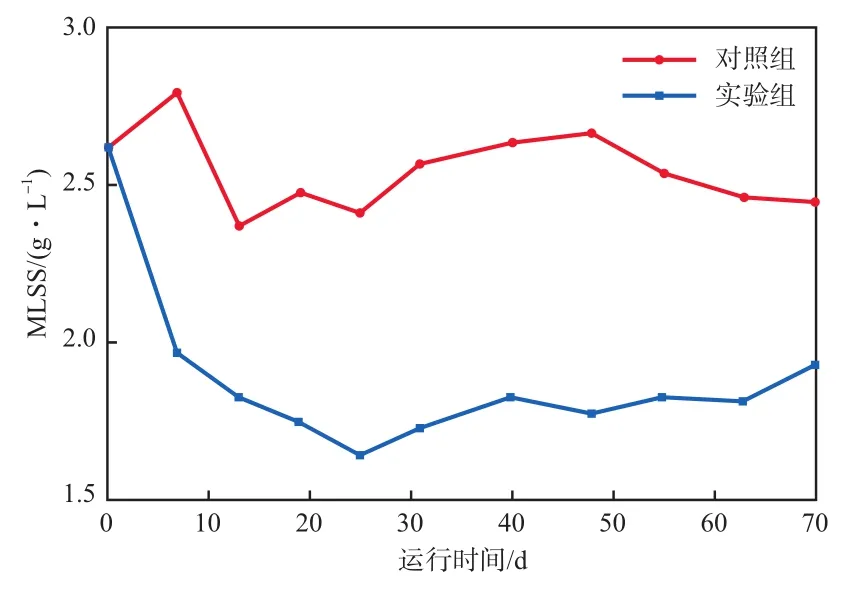
图2 MLSS随运行时间的变化
2.3 2,4,6-TCP质量浓度随运行时间的变化情况
实验组SBR水相和泥相中2,4,6-TCP质量浓度随运行时间的变化见图3。由图3可见:运行1~15 d,水相和泥相中积累的2,4,6-TCP质量浓度均逐渐升高,两者之和超过进水的10 mg/L,这是因为进水中的2,4,6-TCP逐渐积累至泥相还未被降解;运行15~70 d,随着降解2,4,6-TCP的优势菌的富集,进水中的2,4,6-TCP逐渐被降解,水相和泥相中2,4,6-TCP的质量浓度显著下降;至SBR运行结束,水相和泥相中仍可检测到2,4,6-TCP的残留,这是因为2,4,6-TCP的毒性和难降解特性导致其去除较慢。
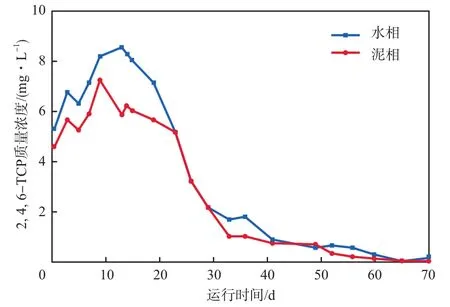
图3 实验组2,4,6-TCP质量浓度随运行时间的变化
2.4 活性污泥的SEM表征结果
对照组SBR活性污泥和实验组SBR活性污泥的SEM照片见图4。由图4可见:实验组SBR活性污泥表面被微生物分泌的黏性物质包裹;而对照组SBR活性污泥中的微生物则聚集成簇,单个微生物清晰可见。这是因为为抵抗2,4,6-TCP的毒性作用,活性污泥中的微生物分泌了大量的胞外聚合物。而已有的研究也证实了氯酚类化合物会诱导活性污泥分泌胞外聚合物[15]。

图4 对照组SBR活性污泥(a)和实验组SBR活性污泥(b)的SEM照片
2.5 单个SBR周期中2,4,6-TCP和COD的去除情况
当实验组SBR运行至第72天时,单个SBR周期不同时间点的COD、2,4,6-TCP质量浓度和Cl-质量浓度见图5。由图5a可知:对照组SBR进水中的COD被快速降解,在9.00 h时COD最低(42.0 mg/L),12.00 h时略有升高(72.0 mg/L),推断认为甲醇属于易降解碳源,前6.00 h被快速降解,12.00 h时升高则是由部分微生物因死亡释放碳源引起;实验组SBR进水COD的降解情况显著低于对照组,在9.00 h时达到最低(88.0 mg/L),12.00 h时同样略有升高,为148.0 mg/L。由图5b可见,随着COD的降解,进水2,4,6-TCP吸附至污泥被降解,积累至污泥的最大2,4,6-TCP质量浓度出现在3.00 h(2.87 mg/L),水相中Cl-质量浓度的升高也表明2,4,6-TCP被有效地降解,2,4,6-TCP降解过程中释放的Cl-证实部分氯代转化产物存在于SBR中。推断认为,虽然降解2,4,6-TCP的优势菌随运行时间的延长而富集,但2,4,6-TCP及其转化产物的毒性会长期抑制污泥活性,导致其出水COD高于对照组。在后续的研究中,可考虑采用延长运行时间或缩短HRT的方式来降解2,4,6-TCP,以及通过鉴定2,4,6-TCP降解过程的转化产物推导其代谢路径。
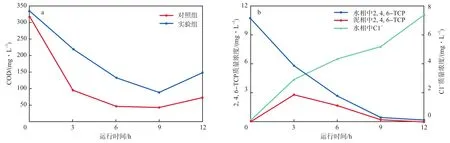
图5 单个SBR周期中COD(a)和实验组2,4,6-TCP质量浓度、Cl-质量浓度(b)随运行时间的变化
2.6 单个SBR周期中酶活性的变化
当实验组SBR运行至第72天时,单个SBR周期不同时间点的CAT、DHA和SOD活性见图6。由图6可见,实验组污泥中CAT和DHA活性显著升高,分别为对照组的1.29~1.58倍和1.56~1.93倍。这是因为经长时间驯化后,降解2,4,6-TCP的优势菌富集,污泥活性逐渐恢复,DHA活性升高可有效降解废水中的2,4,6-TCP。相关研究发现,氯酚类污染物降解过程中会产生多种有毒的转化产物和次级代谢产物[10],而较高的CAT活性可消除有毒物质对微生物的损伤。实验组SBR的SOD活性在6.00 h时达到最大值,为对照组的1.49倍,其余时间略低于或与对照组相当。推断认为,2,4,6-TCP在前6.00 h的降解导致有毒物质的过量积累,诱导SOD活性在单个SBR周期的6.00 h达到最大值,而后随着有毒物质的降解,SOD活性降低。前期的相关研究也发现难降解有机污染物可诱导不同酶活性的升高,与本研究的结果一致[20]。
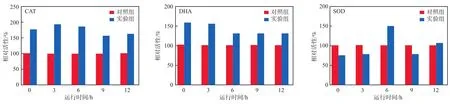
图6 单个SBR周期中不同酶活性随运行时间的变化
2.7 2,4,6-TCP对污泥菌群结构的影响
经检测,对照组SBR污泥经不含2,4,6-TCP的模拟废水驯化培养后,富集的优势菌主要包括Chryseobacteriumsp.、Leadbetterellasp.、Erysipelothrixsp.、Pontibacillussp.、Boseasp.和Salimesophilobactersp.[17]。当实验组SBR运行结束后,污泥中的优势菌主要为Methylobacillussp.、Pseudomonassp.、Pseudoxanthomonassp.、Leadbetterellasp.、Achromobactersp.、Stenotrophomonassp.和Salimesophilobactersp.,2,4,6-TCP显著改变了污泥的菌群结构。经2,4,6-TCP驯化富集的优势菌大都具有降解氯酚类或芳香烃类污染物的能力[17,21-22]。另外,部分菌如Pseudoxanthomonassp.在代谢过程中可分泌表面活性剂等活性因子,可降低氯酚类污染物对微生物的毒害作用[23]。
3 结论
a)采用SBR处理2,4,6-TCP质量浓度为10 mg/L的模拟废水,2,4,6-TCP的存在显著抑制污泥活性。随着运行时间的延长,污泥中降解2,4,6-TCP的优势菌逐渐富集,污泥活性逐渐恢复,进水COD和2,4,6-TCP被有效降解。
b)进水2,4,6-TCP及其转化产物的毒性会长期抑制污泥活性,为抵抗其毒性并将其降解,活性污泥中的微生物分泌了大量的胞外聚合物。污泥中CAT和DHA活性显著升高,SOD活性在单个SBR周期的6.00 h达到最大值,而后随着有毒物质的降解,SOD活性降低。
c)当实验组SBR运行结束后,污泥中富集的优势菌主要为Methylobacillussp.、Pseudomonassp.、Pseudoxanthomonassp.、Leadbetterellasp.、Achromobactersp.、Stenotrophomonassp.和Salimesophilobactersp.,大都具有降解氯酚类污染物的能力。
