菌株Pseudomonas sp. FA4对4-氟苯胺的降解性能及其生物膜形成特性
2021-08-19赵芝清郑梦婷雷宇芬沈骆秦吴燕君
陈 诺,赵芝清,郑梦婷,雷宇芬,沈骆秦,吴燕君
(衢州学院 化学与材料工程学院,浙江 衢州 324000)
有机氟化物因其优异的性能广泛应用于制药、印染、化工、军事等领域[1-2]。然而,除了自然界存在的五十几种外,有机氟化物大多为人工合成,属于难生物降解化合物,在水体、土壤、大气中均有所累积,且具有“三致”性[3-5]。目前,含氟化合物的有效处理已成为研究的热点和难点。迄今为止,相关学者已报道了化学法[6]、物理法[7]和生物法[8]等含氟化合物处理方法。其中,生物法因其处理成本低、不易产生二次污染等优点备受青睐。生物强化技术是指向生物处理系统中引入具有特定降解功能的微生物,提高有效微生物的浓度,从而改善原有生物处理体系的废水处理效果[9]。近年来,相关学者已从环境中分离得到了多株有机氟化物高效降解菌[10-12]。生物强化技术成败的关键是降解功能菌株能否快速定植,而生物膜的形成对菌株的定植具有重要影响。生物膜形成过程中,除受微生物自身一些内在机制调控外[13-14],还受水质条件和水力条件等影响,如pH、盐度和重金属等[15],而当前有关此方面的研究甚少。
本研究以前期筛选得到的一株4-氟苯胺(4-FA)高效降解菌——假单胞菌FA4(Pseudomonassp. FA4)为研究对象,重点考察了pH、重金属等环境因子对其降解性能和生物膜形成的影响,以期为调控该菌株在实际废水处理中的应用提供理论参考。
1 实验部分
1.1 材料、试剂和仪器
所用试剂均为国产分析纯。
4-FA高效降解菌:本课题组前期筛选得到的假单胞菌(Pseudomonassp.),命名为菌株FA4。
培养基:4-FA0.5 g/L,Na2HPO4·2H2O 2.7 g/L,(NH4)2SO40.5 g/L,MgCl20.2 g/L,KH2PO41.4 g/L,CaCl20.01 g/L,酵母提取物 0.02 g/L,微量元素溶液Ⅰ和溶液Ⅱ[16]各1.0 mL/L,pH 7.2。121 ℃高压灭菌30 min。固体培养基中琼脂含量为15~20 g/L,半固体培养基中琼脂含量为5~8 g/L。
Waters高效液相色谱仪:2487型双波长紫外检测器,717型自动进样器,沃特世科技(上海)有限公司;Amethyst C18型色谱柱:4.6 mm×250 mm,填料粒径5 μm,苏州赛分科技有限公司;722N型可见光分光光度计:上海仪电分析仪器有限公司;PHS-3C型pH计:上海精密科学仪器有限公司;Sigma 1-13型离心机:德国Sigma实验室离心机股份有限公司。
1.2 菌株FA4降解能力的影响
设置不同环境因子(4-FA初始质量浓度、pH、重金属种类),考察菌株FA4降解能力的变化:1) 按10%的接种量将600 nm处吸光度(OD600)约为0.5的菌液分别接种至含100~2 400 mg/L 4-FA的培养基中,以30 ℃、120 r/min振荡培养3~4 d后,取样测定4-FA和氟离子的质量浓度、溶液OD600以及1,2-双加氧酶和2,3-双加氧酶的酶活;2)用浓度为1.0 mol/L的HCl和NaOH 溶液分别调整培养基pH为5.0,6.0,7.0,8.0,9.0,10,接种振荡培养3~4 d后取样分析;3)分别称取一定量的重铬酸钾、氯化镍、氯化铜和氯化锌至培养基中,使Cr(Ⅵ)、Ni2+、Zn2+和Cu2+的质量浓度均为10 mg/L,接种振荡培养3~4 d后取样分析,同时设置不投加金属离子的对照组,记为CK。
1.3 生物膜形成的影响
基于实际废水组分,重点考察了pH、金属离子种类和NaCl质量浓度对菌株FA4生物膜形成的影响,具体条件如下:1)用HCl和NaOH溶液分别将培养基pH调至5.0,6.0,7.0,8.0,9.0,10.0,分别取2 mL培养基装至18支φ10 mm×75 mm试管中,在接种量10%、30 ℃、120 r/min条件下接种、振荡培养3~4 d;2)向培养基中添加不同质量浓度的Cu2+、Zn2+、Cr(Ⅵ)和Ni2+,设置0,1,5,10,20 mg/L 5个水平,培养条件同上;3)向培养基中添加不同质量的NaCl,使NaCl的质量分数分别为0,0.10%,0.25%,0.50%,1.00%,2.00%,培养条件同上。培养完成后测定生物膜形成量,每个水平设置3个平行试样。
1.4 细菌群游能力的影响
分别配制不同pH(5.0,6.0,7.0,8.0,9.0,10.0)、不同NaCl质量浓度(0,0.10%,0.25%,0.50%,1.00%)和分别含10 mg/L金属离子(Cu2+、Zn2+、Cr(Ⅵ)和Ni2+)的半固体培养基,接种OD600约为0.5的菌液1 μL,30 ℃培养3~4 d后测定细菌群游直径[17]。每个水平设置3个平行试样。
1.5 分析方法
4-FA的质量浓度采用高效液相色谱法测定[16]:水样经12 000 r/min离心5 min并经过0.22 μm水系滤膜过滤;流动相为甲醇-水溶液(体积比7∶3),柱温 35 ℃,检测波长为230 nm。
1,2-双加氧酶和2,3-双加氧酶的酶活测定方法见文献[16];氟离子质量浓度的测定采用氟离子电极法[18];OD600的测定采用可见光分光光度法。
生物膜形成量的测定采用结晶紫染色法[17]:试管管壁上的生物膜以结晶紫染色后再用乙醇-丙酮溶液(体积比80∶20)洗脱,测定洗脱液在波长570 nm处的吸光度(OD570),以OD570表征生物膜形成量。
2 结果与讨论
2.1 不同因子对菌株降解4-FA、脱氟及生长的影响
2.1.1 初始浓度
4-FA初始浓度对菌株FA4降解能力的影响见图1。由图1可知:菌株FA4可有效降解初始质量浓度为100~2 400 mg/L的4-FA,去除率维持在90.00%以上;随4-FA初始质量浓度的增大,脱氟率由80.00%左右降至42.90%(最高80.60%),OD600则先由0.139升至0.763再降至0.696。SONG等[8]报道4-FA降解菌株罗尔斯通氏菌(Ralstoniasp.)FD-1的最高可降解质量浓度为1 500 mg/L,故菌株FA4具有良好的降解能力。
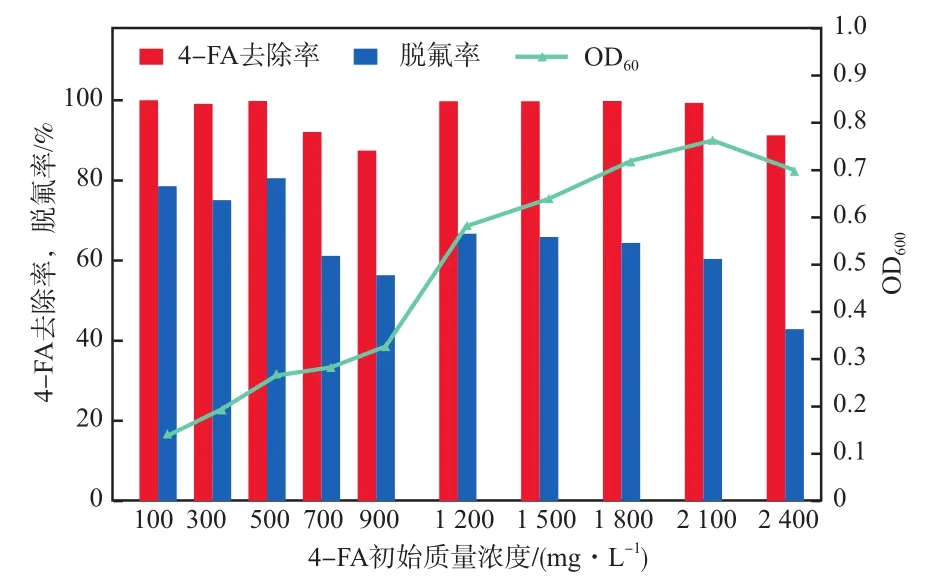
图1 4-FA初始质量浓度对菌株FA4降解能力的影响
采用质量浓度为500 mg/L的4-FA培养3 d后,测定菌液的酶活。结果显示,菌液的1,2-双加氧酶的酶活为(0.027 0±0.002 5)μmol/(mg·min)(以每mg蛋白计),2,3-双加氧酶的酶活基本未检测到。由此可推测,4-FA主要通过邻位开环实现转化降解。
2.1.2 金属离子种类
不同金属离子的种类和浓度会对生化处理系统产生不同的毒性。WANG等[19]研究发现,5 mg/L的Ni2+对生化系统的TOC去除率影响不大,而当质量浓度升至10 mg/L时则呈现明显的抑制。CHENG等[20]报道,5 mg/L的Cr(Ⅵ)即可使生化处理系统的基质去除率急剧下降。鲍雪飞[21]研究发现,9 mg/L的Cu2+可使生物系统的COD去降率下降54.11%。鉴于此,重点考察了10 mg/L的Ni2+、Zn2+、Cu2+和Cr(Ⅵ)对菌株降解能力的影响。在质量浓度均为10 mg/L的条件下,金属离子种类对菌株FA4降解能力的影响见图2。由图2可知:相比CK,10 mg/L Ni2+和Cr(Ⅵ)均对4-FA去除率无较大影响;Zn2+对脱氟过程呈现了促进作用;而Cu2+则呈现了较为明显的抑制作用,4-FA去除率从100%降至53.44%,脱氟率则由76.82%降至3.44%。可见,菌株FA4对Ni2+、Zn2+和Cr(Ⅵ)具有良好的耐受能力。另一方面,在Ni2+、Zn2+、Cu2+和Cr(Ⅵ)存在下,相比CK,OD600均有所增加,分别由0.250增至0.286、0.305、0.407和0.333。金属离子环境下,为了保护细胞免受侵害,微生物通常会分泌出更多的胞外聚合物(EPS),从而影响了OD600的测定。
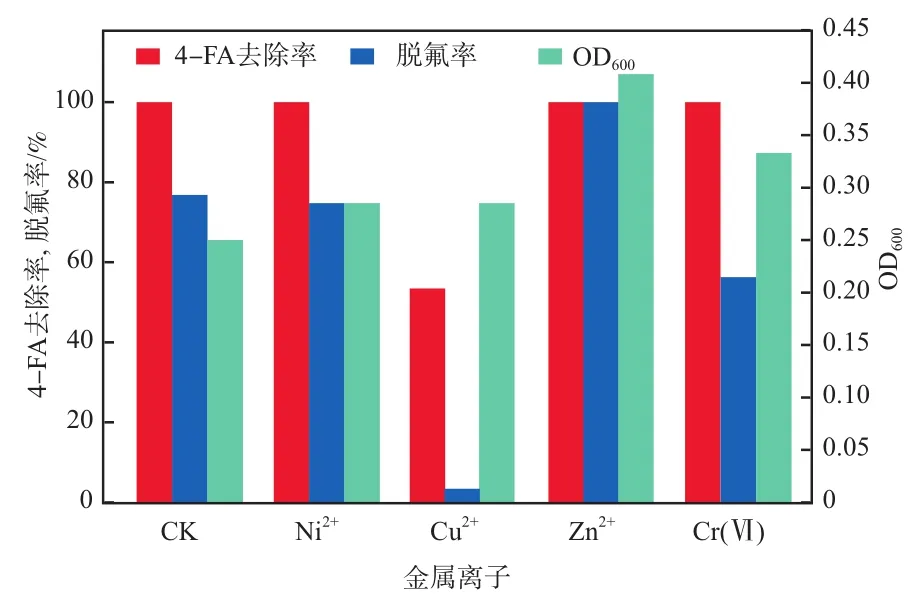
图2 金属离子种类对菌株FA4降解能力的影响
2.1.3 pH
pH对菌株FA4降解能力的影响见图3。由图3可见:当pH为6.0~10.0时,4-FA去除率基本维持在99%以上,脱氟率则随着pH增大而先增加后减小,于pH=7.0时达到最大(90.00%);当pH=6.0时,4-FA去除率、脱氟率和OD600分别为99.67%、65.63%和0.162;而当pH降至5.0时,4-FA去除率、脱氟率和OD600分别降至53.72%、5.51%和0.093。这说明菌株FA4更适宜在中性的环境中生长。
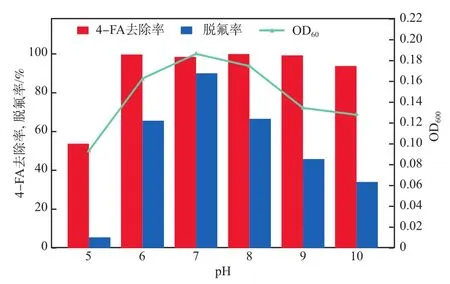
图3 pH对菌株FA4降解能力的影响
2.2 不同因子对菌株FA4生物膜形成的影响
生物膜是细菌细胞在受到pH、盐度等环境因子的刺激或诱导后,发展出的一种具有“应激”特征的集体生长形态[22-23],其形成过程因细菌的种类而异。
2.2.1 pH
pH对菌株FA4染色洗脱液OD570的影响见图4。由图4可见,当pH由5.0升至10.0时,OD570先增大后减少,当pH为7.0时达到最大(0.236),pH为6.0和8.0时次之,基本与降解特性变化趋势一致(见图3)。表明中性环境更有利于生物膜的形成,偏酸或偏碱的环境不利于生物膜的形成。
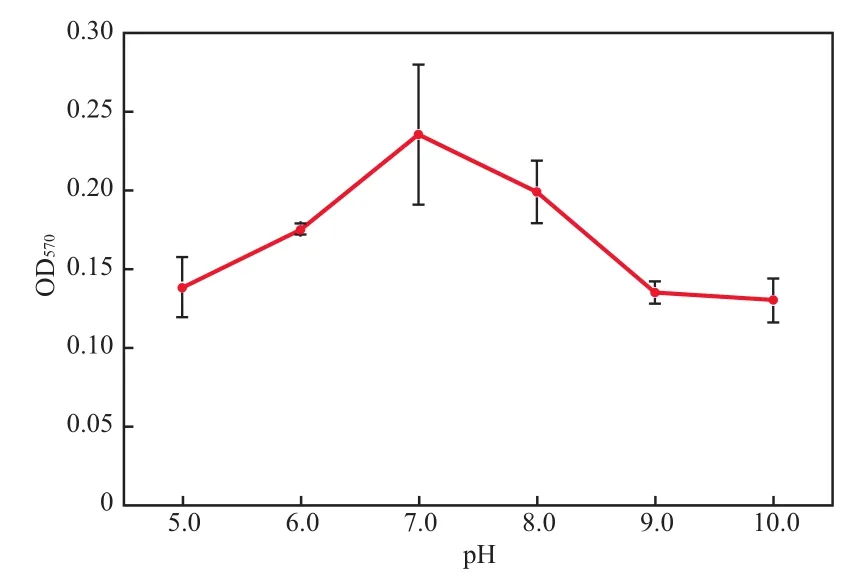
图4 pH对菌株FA4染色洗脱液OD570的影响
2.2.2 NaCl质量分数
NaCl质量分数对菌株FA4染色洗脱液OD570的影响见图5。
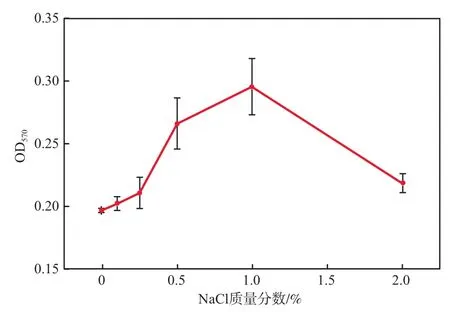
图5 NaCl质量分数对菌株FA4染色洗脱液OD570的影响
由图5可见:当NaCl质量分数为0~0.25%时,OD570约为0.203,随着NaCl质量分数的增加OD570基本保持不变,可能是因为低浓度NaCl对菌的生长无影响,没有激发菌株的“应激”响应体系;当NaCl质量分数进一步提升至0.50%和1.00%时,OD570分别为0.267和0.296,表明生物膜形成量明显增大,可能是因为菌株在胁迫条件下启动了“应激”自我保护,分泌了较多的EPS,从而提高了生物膜形成量;而当NaCl质量分数继续增加到2.00%时,OD570约为0.219,表明生物膜形成量显著下降,可能是由于NaCl质量分数过高导致脱氢酶失活,菌体无法分泌更多的EPS进行自我保护。张兰河等[24]研究发现,NaCl质量分数小于0.5%时微生物产生的EPS相对稳定,而当NaCl质量分数大于0.5%时,EPS也快速增多,以抵抗渗透压升高对细胞的破坏。可见,NaCl质量分数为0.50%~1.00%的生长环境有利于菌株FA4生物膜的形成,这也与熊富忠等[15]的研究结论基本一致。
2.2.3 重金属种类及浓度
重金属种类及浓度对菌株FA4染色洗脱液OD570的影响见图6。由图6可见:Cu2+,Zn2+,Cr(Ⅵ)质量浓度为0~20 mg/L时,Cu2+,Zn2+,Cr(Ⅵ)对OD570均未有明显的影响;未添加Ni2+培养时的OD570为0.269,添加1,5,10,20 mg/L的Ni2+后的OD570分别为0.325,0.509,0.450,0.476,经差异性分析发现,5~20 mg/L的Ni2+对生物膜形成具有促进作用,与相关报道一致[25]。因此,投加5~20 mg/L的Ni2+有利于促进菌株FA4生物膜的形成。
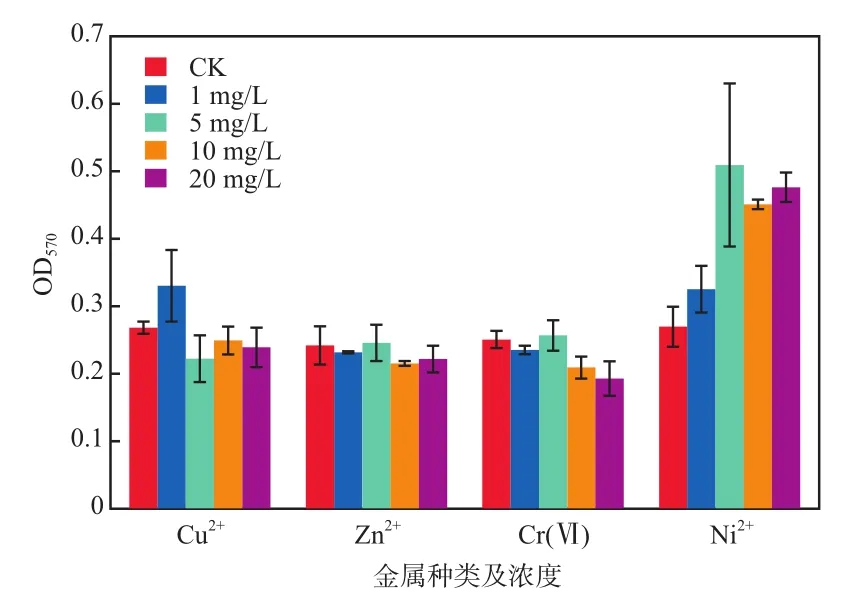
图6 重金属种类及浓度对菌株FA4染色洗脱液OD570的影响
2.3 菌株FA4的群游能力
具有强运动能力的细菌通常能快速与材料表面发生初始黏附,继而增殖、扩张,形成生物膜[26]。不同环境因子条件下菌株FA4的群游直径见图7。由图7a可见,当pH由5.0升至10.0时,群游直径先增大后减少,其中当pH为7.0时达到最大,为5 mm。由图7b可见,当NaCl质量分数为0.10%~1.00%时,群游能力与NaCl质量分数为0时基本相当,维持在4~5 mm,而当NaCl质量分数继续增加到2.00%时,群游能力则显著减小,仅为3 mm。由图7c可见,相比CK,10 mg/L的 Cu2+和Cr(Ⅵ)使菌株FA4的群游能力有所降低,而Zn2+和Ni2+对群游能力的影响不明显。该结果基本与2.23节的结论相一致。
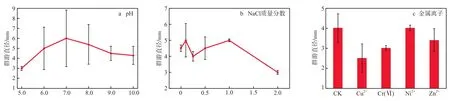
图7 不同环境因子条件下菌株FA4的群游直径
3 结论
a)菌株FA4能有效降解质量浓度为100~2 400 mg/L的4-FA,4-FA去除率维持在90.00%以上,脱氟率为42.90%~80.60%。菌株FA4最适生长pH为7.0,对10 mg/L 的Ni2+、Zn2+和Cr(Ⅵ)具有良好的耐受能力。
b)菌株FA4生物膜形成的最适条件为pH=7.0、NaCl质量分数0.50%~1.00%,投加5~20 mg/L的Ni2+可促进菌株FA4生物膜的形成。
c)就菌株FA4群游能力而言,最适条件为pH=7.0、NaCl质量分数0 ~1.00%,10 mg/L的Zn2+和Ni2+均未对菌株FA4群游能力产生明显影响。
