多模态磁共振评估HBV相关肝癌微波消融的应用价值
2021-08-19王海涛张芃芃李金军尹桂涛侯唯姝
王海涛 张芃芃 李金军 尹桂涛 侯唯姝
肝癌微波消融是目前临床重要的微创治疗方法之一,效率高、时间短,对于血供丰富的较大肿瘤以及邻近血管肿瘤显示出优势,但该治疗方法需要在治疗结束后评价肿瘤残存或复发情况,客观评估微创术后肝癌的活性病灶与坏死情况不仅是评价微创治疗效果的主要依据,还是临床远期预后评估的重要依据。微波消融治疗在单发5 cm以下肝细胞肝癌疗效较明确,具有安全、微创等特点,由于多种原因有较高的肿瘤残存率,因此在治疗结束后评价患者肿瘤残存情况尤为重要。数字减影血管造影(digital subtraction angiography,DSA)显示微波消融术后肝脏残余肿瘤血供情况准确,是评价消融术后有无活性病灶的“金标准”,但DSA检查具有有创和术后副反应等局限性,不能作为肝癌微波消融术后的常规评价方法。本研究通过多模态MRI诊断的肝脏活性病灶与DSA结合甲胎蛋白(Alpha-fetoprotein ,AFP)确诊活性病灶为金标准进行对比,探讨多模态MRI用于肝癌微波消融术后肿瘤活性病灶诊断的价值。
1 资料与方法
1.1 一般资料 回顾性分析阜阳市第二人民医院2018年3月至2020年10月经病理或临床确诊并在微波消融术前后均行MRI检查和术后DSA检查并行经皮肝动脉导管化疗栓塞术(transcatheter arterial chemoembolization, TACE)治疗肝癌患者的临床资料。
纳入标准:①纳入患者的病历资料、随访资料完整;②微波消融术前MRI检查,术后1个月MRI复查,提示完全消融者每隔2~3个月复查MRI;③术后随访MRI检查提示未完全消融者(存在活性病灶),4周内行DSA检查和TACE治疗;④实验室检查AFP升高。排除标准:①肝移植或既往接受肝脏手术的患者;②肝脏弥漫性病变的患者;③病灶小于1 cm易出现部分容积效应的患者;④合并严重心、肾等其他重要脏器功能不全的患者。
最终31例患者纳入本研究,均为乙型肝炎病毒(hepatitis B virus, HBV)阳性,其中男性28例,女性3例,年龄47~76岁,中位年龄58岁。体质量44~82 kg,平均(65.2±10.23)kg。术前31例患者共检出42个病灶,其中21例为单发病灶,10例为多发病灶(2~3个病灶)。病灶直径1.1~5.3 cm,平均(2.41±0.86)cm。42个病灶均行微波消融。
1.2 研究方法
1.2.1 磁共振检查方法 Simens Skyra 3.0T超导型磁共振仪,体部表面线圈,检查前患者需禁食禁饮超过6 h。扫描序列包括:常规平扫轴位TWI、TWI、短T反转恢复序列(short Tinversion recovery,STIR),冠状位TWI;上述轴位扫描结束后实施轴位弥散加权成像(diffusion weighted image,DWI)扫描,用轴位快速梯度自旋回波平面成像(turbo spin echo-echo planar imaging,TSE-EPI)序列,以腹部32通道相控阵线圈为射频发射和接收线圈。扫描参数:扩散敏感系数b值为0、800 /mm,TR 4 600 ms,TE 60 ms,层厚7~9 mm,层间距1 mm,FOV 36~40 cm,矩阵256×256,NEX 2,采用呼吸门控技术。动态多期增强扫描采用TWIST-VIBE技术,扫描参数:TR 3.33 ms,TE 1.3 ms,反转角9°,接受带宽62 dB,矩阵256×128,FOV 38~42 cm,层厚2.0 mm,加速因子为2,激励次数为1,单次采集时间15 s。分别获得双动脉期、门静脉期与平衡期图像。磁共振检查使用的对比剂为钆特酸注射液,经高压注射器注射,剂量为0.2 mmol/kg,注射速率为2 mL/s。
1.2.2 微波消融方法 术前超声造影定位:注射2.5 mL声诺维肝内实性肿块动脉期强化,延迟期消退显像明显,彩超导引实时监视下见微波消融电极针达到肿瘤部位,消融功率调整至60 W,时间确定3~10 min,开始消融治疗,彩超监视下可见肿瘤部位局部回声增强。术后超声造影评价:注射2.5 mL声诺维肝内实性肿块无动脉期强化、延迟期消退显像,停止治疗。
1.2.3 影像学分析 由2名具有10年以上诊断经验的腹部放射学诊断医师分别对DWI和多期增强的MRI图像进行分析,以明确是否存在活性病灶及活性病灶数目。肝脏活性病灶定义为消融病灶内部或边缘仍存在有活性的肿瘤组织。①DWI图像分析。DWI诊断活性病灶的标准如下:治疗后病灶DWI仍存在高信号区域,且ADC图呈低信号,ADC值小于1.3×10mm/s。②多期增强图像分析。多期增强扫描诊断活性病灶的标准为动脉期病灶可见明显强化的实性结节或肿块区域,延迟期持续强化或廓清。单纯边缘强化不是诊断活性病灶的标准。
1.2.4 数字减影血管造影检查 采用飞利浦1000A型血管造影机,高压注射器,右股动脉穿刺,腹腔干造影采用Seldinger技术实施,主要对患者肿瘤病灶血供仔细观察,参考造影所得结果为患者选择合适肿瘤供血动脉。观察DSA造影后病灶内部碘化油沉积、肿瘤血供、肿瘤染色和坏死情况。当DSA造影显示病灶有肿瘤供血动脉及肿瘤染色时提示有活性病灶存在。
1.2.5 实验室检查 微波消融术后,复查AFP明显升高提示存在活性病灶;术前AFP不升高者,复查AFP不升高不做为阴性标准。
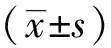
2 结果
2.1 DWI检出肝脏活性病灶的数目和影像学表现 微波消融治疗后凝固性坏死灶TWI高信号、TWI低信号、DWI低信号,中心可见点状高信号,残余癌灶呈“尖角征”或不规则形凸出主体病灶轮廓外,或呈结节状位于原肿瘤内部;活性病灶呈TWI低信号、TWI高信号,DWI呈高信号区域,ADC图呈低信号,平均ADC值(0.85±0.12)×10mm/s(见图1)。 42个病灶中,DWI共检出活性病灶14个,无活性病灶28个。
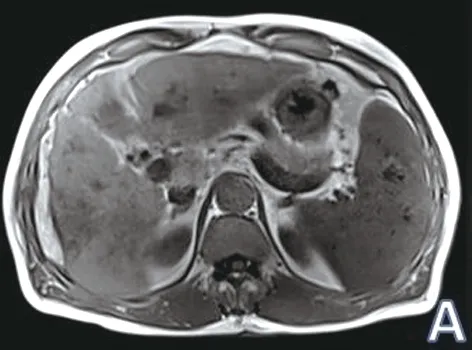
图1 肝癌微波消融术后活性病灶与新发小肝癌MRI检查结果
2.2 多期增强扫描检出肝脏活性病灶的数目和影像学表现 微波消融后残癌活性病灶呈结节状位于肿瘤组织内部或突出于主体病灶外,TWI呈低信号,TWI呈稍高信号,动态增强呈动脉期明显强化,延迟期强化持续或廓清;无活性部分因存在凝固性坏死,表现为TWI高信号、TWI低信号,动态增强扫描无明显强化(见图2A~C、图3A~C)。42个病灶中,多期增强扫描共检出活性病灶8个,治疗后完全无活性病灶34个。多期增强扫描联合DWI共检出活性病灶10个,治疗后无强化、无活性灶32个。
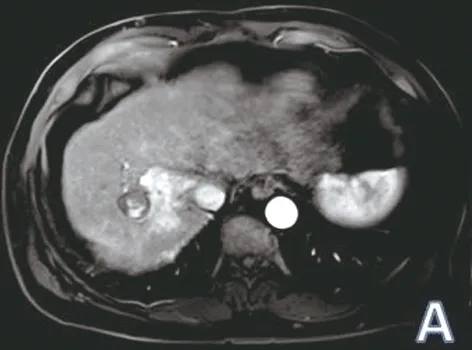
图2 肝癌微波消融术后活性病灶MRI动态增强与DSA肝动脉期表现
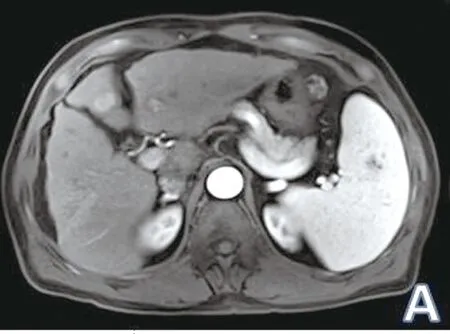
2.3 多模态MRI诊断肝脏活性病灶与DSA的一致性分析 对DWI、多期增强及两者联合检出有活性病灶的肝癌患者分别进行金标准DSA造影,最终确诊8例共12个活性病灶,表现为肝脏动脉期局部肿瘤血管、实质期肿瘤异常染色(见图2D、3D)。其余23例共30个病灶治疗后局部无肿瘤血管染色,提示为无活性病灶。肝内新发肝癌见肿瘤血管染色。DWI检出活性病灶与DSA金标准的一致性检验Kappa值为0.778,多期增强扫描检出活性病灶与DSA金标准的一致性检验Kappa值为0.611,二者联合检出活性病灶与DSA金标准的一致性检验Kappa值为0.877。
3 讨论
MRI具有高分辨率、信号强度不受碘油硬化伪影影响、多序列多方位扫描等优势,微波消融术后肿瘤信号的改变与时间有关,术后初期病灶TWI和TWI均呈混杂信号,这与消融治疗期间病灶发生凝固性坏死、出血及组织细胞脱水有关。随着时间延长病灶TWI信号降低、TWI信号升高,此时主要与凝固坏死有关。当病灶坏死不彻底时则在TWI表现出高低不均的混杂信号,这时难以区分肿瘤活性成分与坏死区,因此补充DWI和多期增强扫描尤为重要。
陈奇峰等使用MRI评估46例患者55个肝癌病灶的微波消融效果,初步研究结果表明术后MRI复查可以精准评估消融的范围,但未对微波消融后活性残灶进行评价。笔者以此为切入点,使用DWI评价肝癌病灶消融后的残灶活性。本研究中微波消融术后DWI呈高信号且ADC值减低的活性病灶共14例,检查的一致性Kappa值为0.778 ,说明DWI可以作为MRI检测肝脏活性病灶的重要补充手段。
MRI增强扫描有助于观察病灶的血供特点,在肝内占位性病变的检出和定性方面有重要作用,也是评估消融术后肝脏活性病灶的重要依据。原发性肝癌增强扫描动脉期表现为明显强化,延迟期多数病灶强化程度下降成为低信号,也有少数病灶因肿瘤的双重血供表现为持续强化。本研究结果表明,使用多期增强MRI扫描评估微波消融治疗后的活性病灶与DSA有较好的一致性,对评估微波消融治疗后的肝癌患者的疗效具有重要意义。
由于微波消融术后病灶平扫TWI表现为高信号,这会影响对增强扫描后病灶是否存在强化的判断。本研究中有2例患者因病灶周边平扫呈高信号影响了判断,造成误诊,因此对于此类TWI高信号结节灶,动态增强检查后处理中应注意采用减影方法显示真实强化状态,以减少漏诊和误诊。
本研究存在下述局限性,首先是总病例数偏少,今后将扩大样本量进行深入研究;其次是未对乏血供肝癌微波消融后复发者进行评价,后续会结合特异性造影剂进行研究。
综上所述,多期增强联合DWI的多模态MRI在检测原发性肝癌微波消融术后活性病灶中与金标准具有较高的一致性,可以作为评估肝癌微波消融治疗后活性病灶的无创影像学检查方法。
