不同时期西门塔尔肉牛生殖激素变化及相关性分析
2021-08-18曲苗闫向民孙亚伟李娜王传军王成成李红波张杨姚刚
曲苗, 闫向民, 孙亚伟, 李娜, 王传军, 王成成, 李红波, 张杨*, 姚刚
(1.新疆畜牧科学院 畜牧研究所,新疆 乌鲁木齐 830000; 2.新疆农业大学 动物医学学院,新疆 乌鲁木齐市 830000;3.伊犁创景犇牛牧业有限公司,新疆 伊宁 835000)
随着生活水平和质量的提高,人们对肉的需求增大,肉牛的养殖规模随之变大,肉牛的规模化养殖也逐渐增多。肉牛的品种有很多,世界上大约有250多种肉牛,美国大约有60种,加拿大约有34种[1],中国现在的品种主要是西门塔尔牛、安格斯牛、夏洛莱牛等[2]。我国的西门塔尔牛是20世纪50年代从国外引进并与我国黄牛杂交后得到的稳定品种[3],在2014年我国杂交牛数量达1 200万头,其中西门塔尔肉牛所占的比例达到90%以上,成为我国主要的肉牛品种。
国外科研人员在20世纪中期就开始研究牛的生殖激素变化,有了较为详尽的数据,牛的FSH与发情周期的变化规律就是由Akbar等[4]在1974年从牛的血浆中测定的。1969年Niswender等[5]对LH的水平进行了测定。在雌激素和孕激素的研究上,Smith[6]在1975年对牛的孕酮进行了研究。国内的研究相对较晚,徐直等[7]在1996年研究了黑白花奶牛生殖激素含量的变化。
目前,有关西门塔尔肉牛不同时期生殖激素变化规律的报道相对较少,为了研究西门塔尔肉牛不同时期的生殖激素变化规律,本文通过酶联免疫吸附法(ELISA)检测西门塔尔肉牛4个时期的E2、PROG、FSH、LH、PGE2、GnRH激素的浓度,分析西门塔尔肉牛不同时期各生殖激素的变化规律,为之后西门塔尔肉牛的繁育和生产性能的提高提供理论参考。
1 材料与方法
1.1 供试材料
供试肉牛是伊宁市某牛场随机选取的产后13 d、生长环境和饲养管理一致的西门塔尔肉牛,共计16头,在产后14、28、42 d使用氯前列醇钠注射液(PG)对其进行同期发情处理,每头牛每次注射PG 3 mL(0.1 mg·mL-1)。每隔1周在10:00 am采血样5 mL,3 000 r·min-1离心10 min,收集血清,液氮保存。
仪器。立式压力蒸汽灭菌器(LDZF-30KB上海申安医疗器械厂),电热恒温鼓风干燥箱(GZX-9070MBE上海博讯实业有限公司医疗设备厂),酶标仪(ST-360:KHB公司)。
试剂。PGE2试剂盒,GnRH试剂盒,LH试剂盒,FSH试剂盒,PROG试剂盒,E2试剂盒均由武汉基因美公司所提供(批号:2020.04),氯前列醇钠注射液(PG宁波第二激素厂,0.2 mg×10支),蒸馏水。
1.2 方法
使用酶联免疫吸附法(ELISA)[8]对产后恢复期(产后0~40 d)和3个发情期(第1发情期:产后41~62 d;第2发情期:产后63~84 d;第3发情期:产后85~106 d)共4个时期的E2、PROG、FSH、LH、PGE2和GnRH浓度进行测定[9-10]。
1.3 数据分析
使用SPSS 21.0对数据进行计算,结果用平均值±标准误进行表示,对数据进行单因素方差分析,两两比较,并进行相关性分析,P<0.01为极显著,P<0.05为显著,P>0.05为不显著,使用Excel对数据进行分析并作图,观察其变化。
2 结果与分析
2.1 不同时期的生殖激素浓度比较
在4个时期中,E2浓度随时间推移逐渐减小,产后恢复期E2浓度最高(图1)。产后恢复期的PROG浓度最高,第2发情期的PROG浓度低于妊娠前期(图2)。FSH浓度在第2发情期最高,在产后恢复期最低(图3)。产后恢复期的LH浓度最高,LH浓度随时间变化而降低(图4)。第1发情期的PGE2浓度最大,之后2个时期的浓度逐渐降低(图5)。产后恢复期的GnRH浓度最高,在第3发情期降低(图6)。西门塔尔肉牛在产后恢复期与第3发情期的LH浓度差异性显著,其他激素各时期差异性均不显著(图4)。
2.2 不同生殖激素浓度的变化规律
产后恢复期E2出现3个峰值,分别在产后16、27和34 d,产后16 d的E2浓度最高,为354.69 pg·mL-1,产后27 d的浓度为170.44 pg·mL-1,产后34 d的为164.74 pg·mL-1,在产后恢复期的浓度呈现稳定的变化规律。之后3个发情期E2的浓度处于稳定的变化范围,在产后68 d时E2浓度最高,为121.97 pg·mL-1,产后72 d最低,为86.75 pg·mL-1(图7)。

0—产后恢复期;1—第1发情期;2—第2发情期;3—第3发情期。图2~6同。图1 E2浓度差异性比较
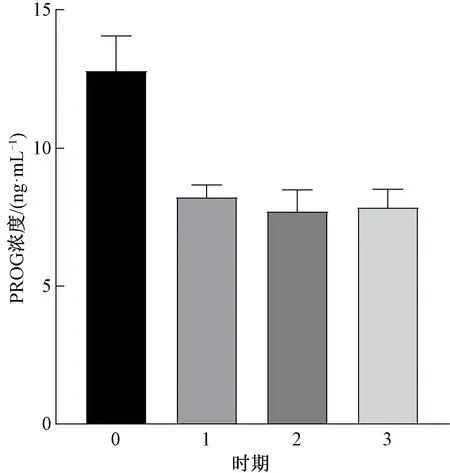
图2 PROG浓度差异性比较

图3 FSH浓度差异性比较
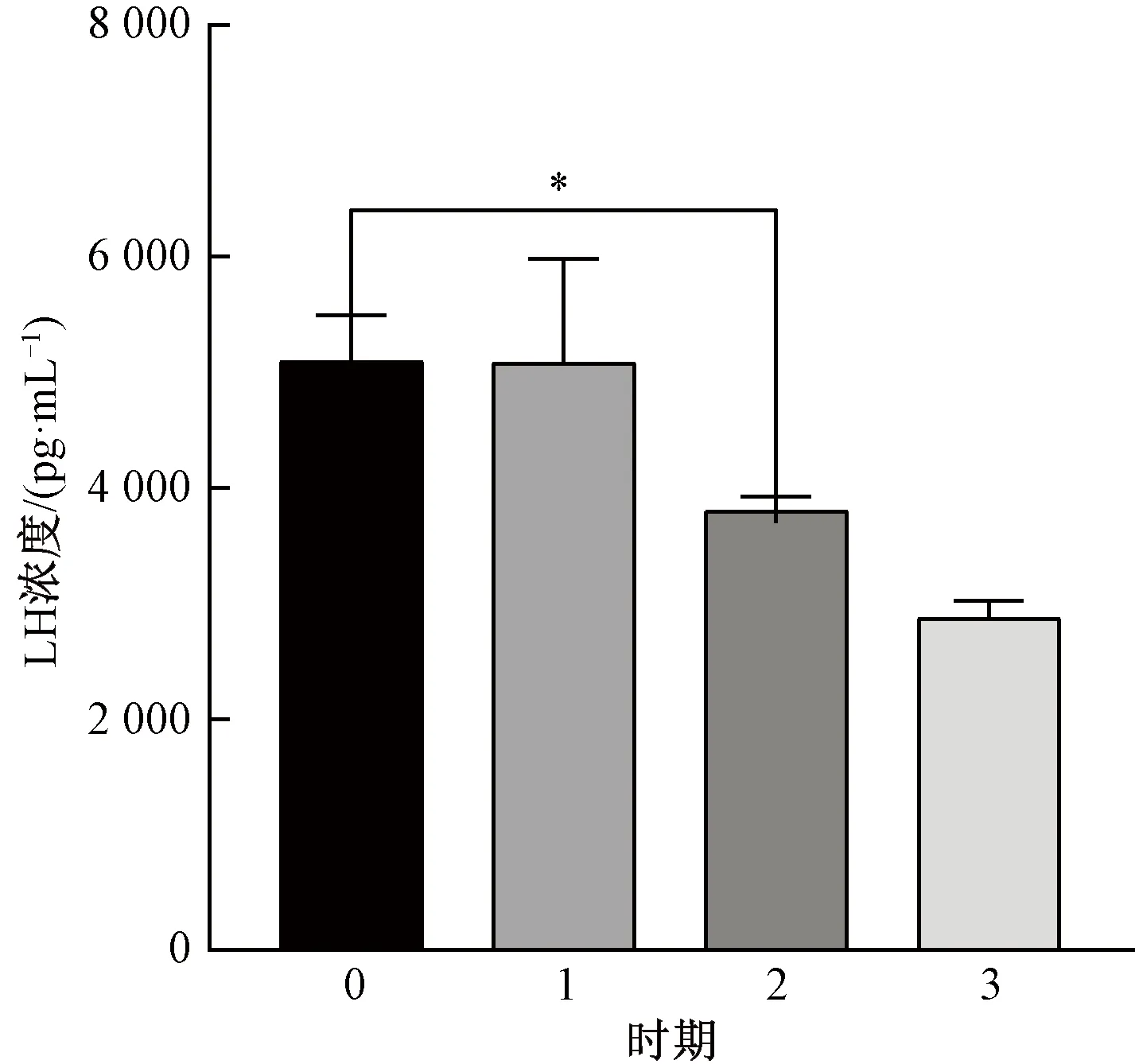
*—差异显著(P<0.05)。图4 LH浓度差异性比较

图5 PGE2浓度差异性比较

图6 GnRH浓度差异性比较
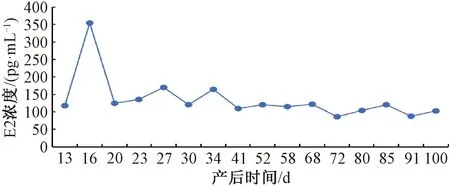
图7 不同时期E2浓度变化
产后恢复期的PROG浓度高于3个发情期,产后恢复期PROG浓度出现3个峰值,其中产后16 d时浓度最高,为19.48 ng·mL-1,产后27 d为13.35 ng·mL-1,产后34 d为13.94 ng·mL-1。发情期的PROG浓度相对稳定,3个发情期均为前期的浓度较高,第1个发情期产后41 d的PROC浓度为9.08 ng·mL-1,第2个发情期产后68 d的为9.25 ng·mL-1,第3个发情期产后85 d的为8.98 ng·mL-1(图8)。

图8 不同时期的PROG浓度变化
产后恢复期前期FSH浓度呈上升趋势,产后20 d后FSH浓度处于平稳状态。在产后13 d FSH浓度最低,为18.97 ng·mL-1,产后27 d FSH浓度最高,为66.28 ng·mL-1。第1发情期FSH浓度逐渐上升,产后58 d浓度最高,为70.42 ng·mL-1。第2发情期FSH浓度由产后68 d的98.60 ng·mL-1上升到产后72 d的100.16 ng·mL-1,之后又下降,在产后80 d时下降到50.76 ng·mL-1。第3发情期FSH浓度处于上升的趋势,但是幅度很小,最终在产后85 d时浓度由75.26 ng·mL-1上升到产后100 d的79.28 ng·mL-1(图9)。

图9 不同时期的FSH浓度变化
产后恢复期23 d时LH浓度出现峰值,浓度为5 889.69 pg·mL-1,最高的LH浓度在产后34 d,为6 363.47 pg·mL-1;产后恢复期前期LH浓度呈下降状态,在产后16 d时浓度下降到3 292.03 pg·mL-1,产后30 d出现第2次下降。第1发情期LH浓度出现1个峰值,且为在整个试验过程中最高,达6 886.56 pg·mL-1,之后LH浓度持续下降,在产后58 d为4 107.66 pg·mL-1。第2发情期产后68 d LH浓度最高,为4 021.72 pg·mL-1,产后72 d LH浓度最小,为3 592.03 pg·mL-1。第3发情期LH浓度逐渐降低,产后91 d时浓度由产后85 d的3 163.13 pg·mL-1降到2 625.63 pg·mL-1,在产后100 d又上升到2 811.25 pg·mL-1。3个发情期的浓度总体呈现下降的趋势(图10)。
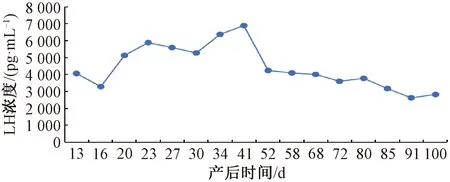
图10 不同时期的LH浓度变化
产后恢复期PGE2的浓度先下降后上升,在产后16 d下降到69.17 pg·mL-1,但下降幅度不明显,之后PGE2的浓度上升,产后23 d上升至175.83 pg·mL-1,产后34 d到达产后恢复期中最高,为177.51 pg·mL-1。第1个发情期产后41 d PGE2出现峰值,也是整个试验过程中的峰值,为254.07 pg·mL-1,之后浓度下降。第2个发情期PGE2的浓度变化不大。第3个发情期PGE2浓度下降,产后100 d为59.79 pg·mL-1。3个发情期的浓度呈下降的趋势(图11)。由图10和图11可知LH和PGE2 2种激素的变化规律相似。

图11 不同时期的PGE2浓度变化
产后恢复期GnRH浓度变化规律与LH和PGE2浓度相似,都是先下降再上升,产后16 d GnRH浓度下降到38.88 pg·mL-1,产后23 d又上升至84.21 pg·mL-1。产后34 d GnRH浓度最高,为87.91 pg·mL-1。3个发情期都出现了1个峰值,分别是在产后52、80和91 d,浓度分别是69.96、79.15和54.32 pg·mL-1(图12)。

图12 不同时期的GnRH浓度变化
2.3 不同生殖激素浓度的相关性
相关性分析发现,E2与PROG正相关,相关性极显著;与FSH负相关,相关性显著;与其他激素的相关性不显著。PROG与FSH、LH、PGE2和GnRH均没有显著性相关关系。FSH与LH、PGE2和GnRH没有显著性相关关系。LH与PGE2正相关,相关性极显著;与GnRH正相关,相关性显著。PGE2与GnRH没有显著性相关关系(表1)。
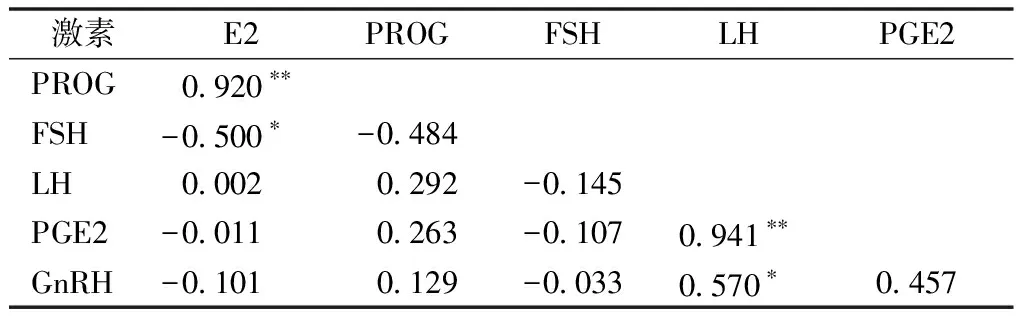
表1 生殖激素的相关性
3 讨论
3.1 不同时期各生殖激素浓度变化规律
生殖激素作用于各靶器官及靶细胞,影响繁殖活动[11]。E2主要用于泌乳,诱导发情,催产,调控卵泡的生长发育[12]、促进子宫内膜的修复[13]、通过下丘脑反馈调节GnRH的含量[14]、治疗胎衣不下等。PROG的作用是促进子宫发育、子宫内膜的增生、维持妊娠[15]等,与E2协同作用于繁殖[16]。FSH的作用是促进卵泡发育、负反馈作用于GnRH的生成。LH的主要作用是促进黄体生成[17]。PGE2在繁育中的主要作用是溶解黄体[18],在其他生命活动中也起作用,使支气管平滑肌得以舒张,降低通气阻力,还有降低血压等一系列作用[19]。GnRH的作用是调节FSH和LH的生成,而FSH和LH又会负反馈调节GnRH的生成与释放[20]。
产后恢复期E2出现最高值,为354.69 pg·mL-1,可能是因为要进行泌乳,所以E2的浓度达到最高,PROG在这一时期也出现了最高值为19.48 ng·mL-1,2种激素的最高值都出现在产后16 d。在试验阶段,4个时期的E2和PROG浓度有相同的变化规律,本结果与王宏娟[21]的研究结果相同,在发情期浓度先上升,之后下降,E2浓度最高值出现在产后恢复期,而PROG与E2极显著正相关,所以浓度变化与E2相同;但在早期的研究报道E2与PROG的变化相反[22],与本试验的结果不同,可能是因为品种的原因。在4个时期中,FSH浓度总体变化规律先上升后下降,在第3发情期的浓度又上升,产后72 d的FSH浓度最高,为100.16 ng·mL-1。第1发情期的产后41 d,LH浓度最高,为6 886.56 pg·mL-1,在发情期前期浓度最高,之后浓度下降。刘楚沛[23]研究表明,在发情周期的15~18 d时出现峰值,间情期分泌的LH高于发情期,与本文的结果相同,但是张佰忠等[24]研究发现,湘西黄牛的LH浓度在发情当天浓度变大,与本文结果不同,分析原因可能品种不同。很多研究都是用PG进行同期发情处理,使家畜得以同期发情[25],本文在试验期间也进行了同期发情,本文的PGE2变化浓度范围是59.79~254.07 pg·mL-1,相对范围大,说明外源PG影响内源PGE2的合成。本研究在发情周期前期PGE2出现峰值,浓度为254.07 pg·mL-1,说明在此时黄体溶解完毕,该进行发情,所以研究结果是正确的。陈阳[26]在2019年研究发现,湖羊血液主要的生化指标与生殖激素在围产期尤其是在分娩前后其变化比较显著,本试验产后恢复期浓度变化相对发情周期大,可以判定与其结果相同。在产后恢复期GnRH出现2个峰值,分别在产后23和34 d,产后34 d的浓度最高。第1发情期出现1个峰值,在产后52 d,第2发情期产后80 d出现峰值,第3发情期也出现了峰值,在产后91 d,在试验期间GnRH共出现5个峰值。
3.2 生殖激素的相关性分析
研究表明,E2与卵泡波紧密相关,在E2下降时,优势卵泡逐渐增长[27],而此时FSH的浓度开始增长[28],与本文结果相同,E2与FSH显著负相关。Evans等[29]的研究表明,卵巢雄激素和雌二醇在卵泡发育波期间对FSH的分泌起关键作用,并且优势卵泡在卵泡波动过程中对循环雌二醇和雄激素的波动也起重要的作用。有研究表明,P4与FSH和LH负相关[30],负反馈调节FSH和LH的释放[31],本试验的PROG与FSH负相关,与研究报道的相同,但是PROG与LH正相关,与其得出的结果相反,具体原因还需要进一步进行研究。Bao等[32]研究发现,在牛的每个卵泡波出现之前,FSH都会出现暂时性的上升,FSH在发情期出现的第1个峰值在LH峰值出现之后,与本研究的结果相同,本文FSH出现的峰值在LH峰值之后,但2个峰值出现时间相差较大,可能是因为采样时间间隔太大,导致未能观察到细微的变化。研究表明,LH对PGE2有影响,在LH刺激后的15 d,育成母羊的子宫内膜只分泌PGE2,由此表明,LH可能参与了母羊早孕期黄体溶解的预防,影响PGE2的分泌[33],这也说明LH与PGE2正相关,与本文的结果相同,本文得出LH与PGE2极显著正相关。LH与GnRH显著正相关,研究表明,GnRH促进LH和FSH的分泌[34]。姚路连[35]研究表明,P4和FSH极显著负相关,本文的FSH与PROG负相关,但是不显著。张泽林[36]检测LH对黄体细胞GnRH的分泌得知,一定浓度的LH会提高黄体GnRH的表达水平,本研究中的FSH与GnRH是负相关的关系,但是LH与其是显著正相关的关系,与张泽林研究的结果相似。本文的GnRH在产后恢复期的变化规律与LH及PGE2相似,是因为GnRH作用于LH的释放,而LH又影响着PGE2的浓度变化,所以3者前期的变化规律相同。GnRH在4个时期的浓度变化范围为37.19~87.91 pg·mL-1,在产后恢复期的变化总体是升高的。在本试验中的GnRH与LH是显著正相关,说明GnRH影响着LH的浓度。
4 小结
在产后恢复期E2、PROG、LH、GnRH的浓度大于3个发情期的浓度,第1发情期PGE2浓度最高,第2发情期FSH浓度最高。产后恢复期和第3发情期LH浓度相关性显著,其他激素各时期相关性不显著,说明LH浓度变化影响着西门塔尔牛配种成功的几率,可以作为西门塔尔牛配种成功与否的标准。不同时期各生殖激素变化规律不同,激素之间具有相关性,可以作为之后西门塔尔肉牛研究的基础,也可以为西门塔尔肉牛的繁殖提供参考。
