姜黄素抑制Wnt信号通路增加胃癌细胞对顺铂的敏感性
2021-08-17黄雅平庄伊凡
黄雅平,庄伊凡,程 晶,李 琴
(1.泉州医学高等专科学校基础医学部,福建 泉州 362000;2.厦门大学附属中山医院胃肠外科,福建 厦门 361000;3.厦门大学医学院胃肠肿瘤研究所,福建 厦门 361000)
胃癌是世界上最具侵袭性的恶性肿瘤之一,虽然近10年来其诊断及治疗已经取得了长足的进步,但患者5年生存率仍只有25%。积极化疗是预防术后复发、转移最重要的治疗手段[1-2]。然而,肿瘤细胞固有或获得性耐药是目前影响化疗效果的关键因素[2]。姜黄素作为一种安全的天然药物,具有抗炎、抗氧化、抗癌等作用。研究表明,姜黄素与西紫杉醇、顺铂、5-氟尿嘧啶等化疗药物联合使用,在前列腺癌、胃癌及结直肠癌等多种人类肿瘤中具有抗癌增敏作用,但是相关机制尚不明确[3-4]。Wnt/β-catenin信号通路不仅在细胞多能性调控和恶变诱导中起关键作用,还与肿瘤细胞的化疗耐药性密切相关[5]。我们前期的研究证实,姜黄素可调控Wnt信号通路,抑制胃癌细胞上皮间质转化(epithelial-mesenchymal transition,EMT),实现抗肿瘤作用[6-7]。因此,本研究拟探讨姜黄素对多药耐药胃癌细胞的化疗增敏作用以及Wnt/β-catenin信号通路的调控机制。
1 材料与方法
1.1 实验材料
姜黄素(美国Sigma公司),顺铂(齐鲁药业有限公司),5-氟尿嘧啶(5-Fu,美国Selleck Chemicals公司),人胃癌耐药细胞株BGC-823/5-Fu(南京科佰生物科技有限公司),噻唑蓝(methyl thiazolyl tetrazolium,MTT)试剂盒(天津百浩生物科技有限公司),Pierce BCA Protein试剂盒(上海碧云天生物技术有限公司),兔抗人E-cadherin、Vimentin、Wnt2、β-catenin、GSK3β克隆抗体(北京博奥森生物技术有限公司)。
1.2 细胞分组
采用姜黄素(10 μmol/L)、顺铂(1 μmol/L)单独或联合干预人胃癌耐药细胞株BGC-823/5-Fu,并分为对照组、姜黄素干预组、顺铂干预组、联合干预组。BGC-823/5-Fu细胞株于37 ℃、5% CO2饱和湿度下含10%胎牛血清RPMI-1640培养基中培养。培养基中加入5 μmol/L 5-Fu维持细胞耐药性进行预处理,实验前1周撤药,取对数生长期细胞进行实验。
1.3 MTT试验检测细胞增殖能力
取对数生长期的BGC-823/5-Fu细胞制备单细胞悬液,调整浓度为2×105/L,每孔200 μL接种于96孔板。按1.2方法干预后,于37 ℃孵育24 h。每孔加入MTT溶液10 μL继续培养,在24 h、48 h、72 h时置酶标仪于570 nm波长处检测各孔的吸光度OD值,评估细胞活力。
1.4 集落形成试验检测细胞克隆成瘤能力
取对数生长期的耐药细胞株BGC-823/5-Fu制备单细胞悬液接种于6孔板(每孔2 000个)孵育24 h。按1.2方法干预后培养24 h。PBS洗涤后继续培养10 d,终止培养,弃培养液,PBS浸洗,甲醇固定,空气干燥,Giemsa染液染色10 min,采用凝胶分析仪分析集落形成情况。
1.5 Transwell小室试验检测细胞迁移能力
按照1.2方法干预诱导72 h后收集各组细胞,调整浓度,去血清饥饿后制备细胞悬液,24孔板每孔上室加200 μL细胞悬液,下室加500 μL 20% FBS培养基,恒温培养24 h。取出小室,弃液洗涤,固定后高倍镜(×200)下观察。随机取5个视野计数平均迁移细胞数。
1.6 Wnt/β-catenin信号通路及EMT相关蛋白表达检测
收集和提取对数生长期的耐药细胞株BGC-823/5-Fu接种于细胞培养瓶中贴壁培养。按1.2方法干预各组细胞后培养24 h,裂解获得总蛋白,BCA法测定蛋白浓度,各取50 μg上样,电泳(80 V,30 min;120 V至结束)转PVDF膜(300 mA,100 min),一抗4 ℃摇床孵育过夜,室温下水平摇床二抗孵育1 h,TBST漂液,ECL显影。以β-actin为内参,Western blot检测E-cadherin、Vimentin、Wnt2、β-catenin、GSK3β蛋白表达。
1.7 统计学方法
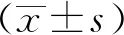
2 结果
2.1 姜黄素下调BGC-823/5-Fu细胞活力
干预后24 h、48 h,姜黄素干预组、顺铂干预组OD值与对照组比较,差异无统计学意义(P>0.05);干预后72 h,姜黄素干预组、顺铂干预组OD值低于对照组(P<0.05)。干预后48 h,联合干预组OD值低于对照组、姜黄素干预组(P<0.05)。干预后72 h,联合干预组OD值低于对照组、姜黄素干预组、顺铂干预组(P<0.05)。在各干预时间点,姜黄素干预组与顺铂干预组比较,差异均无统计学意义(P>0.05),见图1。
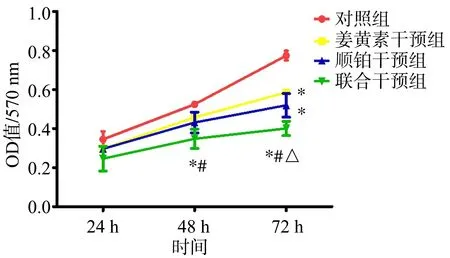
*:与对照组比较,P<0.05;#:与姜黄素干预组比较,P<0.05;△:与顺铂干预组比较,P<0.05
2.2 姜黄素抑制BGC-823/5-Fu集落形成能力
与对照组比较,姜黄素干预组、顺铂干预组、联合干预组干预后24 h集落形成数减少(P<0.05);且联合干预组少于姜黄素干预组、顺铂干预组(P<0.05);姜黄素干预组与顺铂干预组比较,差异无统计学意义(P>0.05),见图2。
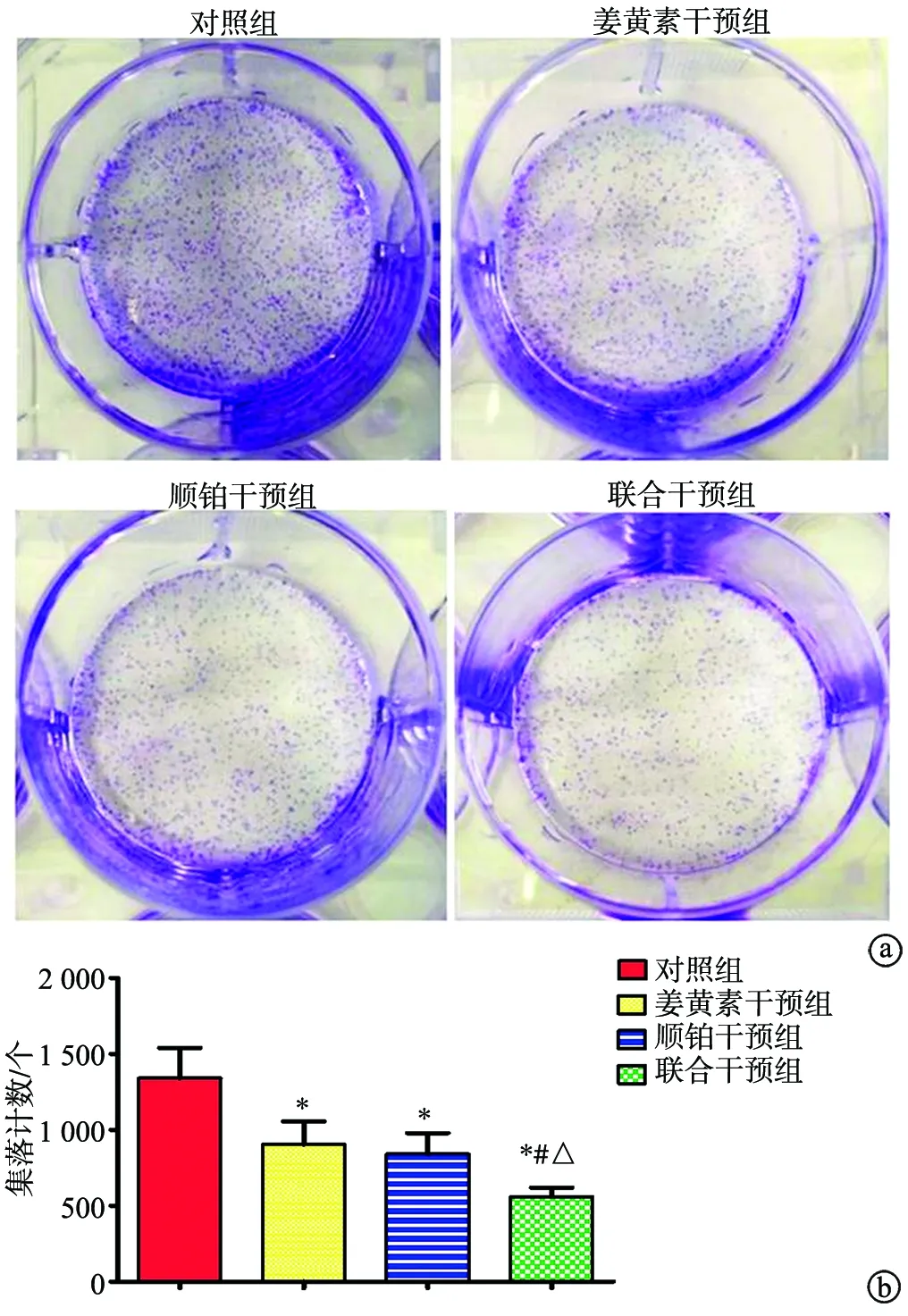
a:各组细胞集落形成情况;b:各组细胞集落计数 *:与对照组比较,P<0.05;#:与姜黄素干预组比较,P<0.05;△:与顺铂干预组比较,P<0.05
2.3 姜黄素抑制BGC-823/5-Fu细胞迁移能力
与对照组比较,姜黄素干预组、顺铂干预组、联合干预组干预后穿膜细胞数减少(P<0.05);且联合干预组少于姜黄素干预组、顺铂干预组(P<0.05),姜黄素干预组与顺铂干预组比较,差异无统计学意义(P>0.05),见图3。
2.4 Wnt/β-catenin信号通路以及EMT相关蛋白表达
姜黄素干预组E-cadherin、Vimentin以及β-catenin蛋白表达与对照组比较,差异无统计学意义(P>0.05),但GSK3β蛋白表达高于对照组,Wnt2蛋白表达低于对照组,差异均有统计学意义(P<0.05)。
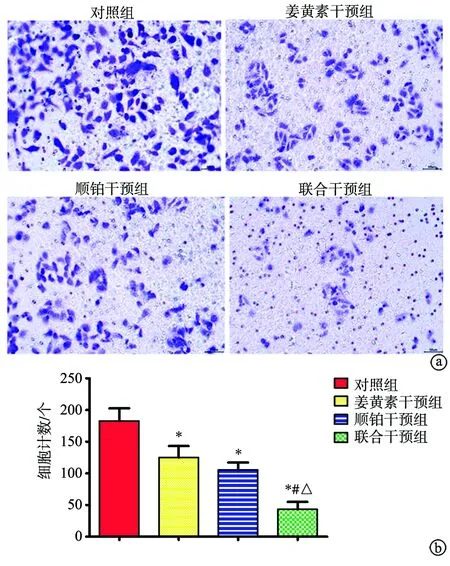
a:各组细胞迁移情况(×200);b:各组细胞迁移计数 *:与对照组比较,P<0.05;#:与姜黄素干预组比较,P<0.05;△:与顺铂干预组比较,P<0.05
顺铂干预组E-cadherin蛋白表达与对照组比较,差异无统计学意义(P>0.05),但GSK3β蛋白表达高于对照组,Vimentin、Wnt2及β-catenin蛋白表达低于对照组,差异均有统计学意义(P<0.05)。与对照组比较,联合干预组E-cadherin、GSK3β蛋白表达增高,Wnt2、β-catenin及Vimentin蛋白表达降低,差异均有统计学意义(P<0.05);联合干预组Wnt2及β-catenin蛋白表达低于姜黄素干预组、顺铂干预组,GSK3β蛋白表达高于姜黄素干预组、顺铂干预组,差异均有统计学意义(P<0.05);联合干预组Vimentin蛋白表达低于姜黄素干预组(P<0.05),与顺铂干预组比较,差异无统计学意义(P>0.05);联合干预组E-cadherin蛋白表达与姜黄素干预组和顺铂干预组比较,差异无统计学意义(P>0.05),见图4。
3 讨论
对于临床分期为T2~4N0~3M0且可行手术切除的胃癌患者,新辅助化疗是目前美国综合肿瘤网络中心(National Comprehensive Cancer Network,NCCN)指南推荐的首选治疗策略[8]。顺铂是一种无机铂剂,可诱导DNA-蛋白、链间和链内DNA交联,抑制细胞增殖并促进细胞凋亡,是进展期胃癌新辅助化疗方案的重要组成[9-10]。然而,由于肿瘤细胞的化疗耐药性,顺铂的疗效与发展受到了很大的限制。因此,亟需寻找增强化疗药物敏感性的方法,以提高疗效。天然产物是目前公认的最重要的生物活性物质和药物先导物来源。1981~2006年,73%的癌症批准药物都是天然产品或是基于天然产品研发[11]。姜黄素作为姜黄属植物中的主要活性成分,具有清除自由基、抗炎、抗氧化、抗癌、抗微生物等多方面药理作用,在心血管系统、消化系统中应用广泛[12]。研究证实,姜黄素可通过多种机制抑制肿瘤细胞增殖、侵袭、转移,诱导细胞死亡[12-13]。除了在体内外模型中观察到的抗肿瘤活性,姜黄素单独或与已批准的其他抗癌药物(如多西紫杉醇、奥沙利铂、5-氟尿嘧啶等)联合使用,可发挥化学预防、减轻副作用以及增强化疗药物敏感性等多方面的作用[13]。

a:Western blot检测相关蛋白结果;b:各组蛋白表达定量分析 *:与对照组比较,P<0.05;#:与姜黄素干预组比较,P<0.05;△:与顺铂干预组比较,P<0.05
本研究采用姜黄素联合顺铂在体外干预5-Fu负荷诱导的多药耐药胃癌细胞株BGC-823/5-Fu,结果显示,联合干预组集落形成数、穿膜细胞数较姜黄素干预组、顺铂干预组减少,说明与顺铂单药干预相比,联合给药抑制细胞增殖及迁移的作用更强;与对照组比较,联合干预组E-cadherin蛋白表达上调,Vimentin蛋白表达下调,表现出抑制经典的EMT标志蛋白改变作用。EMT过程可促进细胞迁移和侵袭,诱导干细胞特性,有助于诱导耐药及免疫抑制,与患者预后不良密切相关[14]。Huang等[15]在乳腺癌细胞EMT研究中发现,20 μmol/L浓度的姜黄素干预能使脂多糖诱导的乳腺癌细胞MCF-7重塑E-cadherin表达,下调Vimentin表达,从而发挥抑制肿瘤细胞增殖、侵袭、转移的作用。与顺铂单独使用相比,姜黄素与顺铂联合使用能够下调体内外FEN1的表达,抑制受损碱基剔除和DNA的损伤修复,增强乳腺癌细胞对顺铂的敏感性[16]。在卵巢癌的研究中,Zhu等[17]的研究显示,姜黄素与顺铂联合化疗具有显著的协同作用,能够有效下调Twist 1蛋白的表达,发挥抗肿瘤活性。Twist 1是间质表型的主要调控因子,与细胞转移密切相关,Twist 1转录激活下游效应蛋白,抑制E-cadherin的表达,从而促进EMT过程[18]。已有研究发现,EMT调控机制涉及Wnt/β-catenin等多种信号通路,异常激活的Wnt/β-catenin是促进多种癌细胞增殖和药物抗性的重要元凶[13,19]。因此,靶向Wnt/β-catenin的药物可能成为多靶点联合化疗方案的重要组成。研究证实,姜黄素是Wnt信号的有效抑制剂[7,20],姜黄素单药或联合干预均能下调胃癌细胞Wnt/β-catenin介导的转录信号,上调下游分子钙依赖性跨膜糖蛋白E-cadherin(具有抑制癌细胞向外侵袭的作用)的表达,本研究结果与之一致。这种抑制作用亦在A549、HCT116、MCF7、A375等多个癌细胞系中得到证实,研究发现,姜黄素不仅能够单独作用,负性调控Wnt/β-catenin信号通路,抑制增殖,促进凋亡,还能与槲皮素(天然活性物质)协同发挥作用[21]。
此外,本研究发现,联合干预组OD值及Wnt2、β-catenin表达低于顺铂干预组,提示在多药耐药细胞株BGC-823/5-Fu的体外培养中,姜黄素联合顺铂化疗较单一顺铂化疗具有更显著的Wnt/β-catenin信号通路关键蛋白抑制作用,Wnt/β-catenin信号失活进而降低胃癌细胞活力与迁移能力。类似的化疗增敏作用在姜黄素联合5-Fu、顺铂的化疗方案对人胃癌细胞株MGC-803的抗癌研究中得到证实,与单药治疗组相比,多药联合组胃癌细胞活力、集落形成和细胞迁移均显著降低[22]。在头颈部鳞癌的在体研究中,研究人员将脂质体姜黄素与亚治疗剂量顺铂静脉注射到生长在异种移植瘤的裸鼠体内,结果显示,这两种药物协同作用,激活PPARγ受体(姜黄素抗癌的另一重要靶点)[20],能有效抑制肿瘤生长,同时降低顺铂的毒副作用[23]。
值得关注的是,在姜黄素联合化疗药物对Ph+急性淋巴细胞白血病细胞的研究中,Santana-Bejarano等[24]发现,姜黄素的化学增敏效应可能存在不同程度剂量和时间依赖的增效/协同作用。本研究参照文献选择低浓度进行干预,关于姜黄素的浓度依赖性效应未做比较。近年来,随着纳米封装、胶束形成等制药技术的应用,姜黄素与Zn2+、Cu2+、Mg2+等金属离子络合可以提高姜黄素的生物利用度[13]。因此,姜黄素的最佳给药浓度尚需结合给药方式和药物配伍等进一步研究。
综上所述,姜黄素通过下调Wnt/β-catenin信号通路,增强多药耐药胃癌细胞株BGC-823/5-Fu对顺铂的敏感性,抑制胃癌细胞EMT过程。本研究将天然抗癌药物与传统化疗药物联合应用,改进了化学抗肿瘤治疗方案,解决了化疗过程中肿瘤细胞耐药问题,为姜黄素应用于胃癌的临床治疗提供了新的基础。