小麦条锈菌侵染过程中小麦质外体中糖的定量分析
2021-08-17刘秀峰杨兆顺楼辰军许高平邵凤武
刘秀峰 ,杨兆顺 ,楼辰军 ,许高平 ,邵凤武
(1.天津市农业科学院农作物研究所,天津300381;2.天津市农作物遗传育种重点实验室,天津300381)
由条形柄锈菌小麦专化型(Puccinia striiformisf.sp.tritici,Pst)引起的小麦条锈病是一种重要的病害,其会造成小麦产量损失巨大[1-2],在我国曾发生多次大流行,严重危害小麦生产安全[3-5]。Pst需要从寄主小麦获取包括糖类在内的多种营养物质用于菌体生长发育,目前对Pst吸收小麦糖类的机理并不清楚。现在已经明确,包括Pst在内的活体营养专性寄生真菌在侵染寄主过程中由菌丝高度特化形成吸器,同位素标记饲喂以及转录表达数据均表明吸器具有吸收寄主营养物质的功能[6-8]。显微结果表明,Pst吸器穿透小麦细胞壁后并未真正破坏小麦细胞质膜,而是被小麦细胞质膜形成的鞘所包裹,其吸器颈处会产生一个颈环连同吸器外基质形成一个特殊封闭的质外体[9]。已有研究结果表明,质外体是植物病原菌与寄主竞争糖类的重要场所,病原菌侵入寄主质外体干扰寄主糖信号传导,调控被侵染组织成为强力的库器官,促使寄主植物源器官产生的糖类物质流向菌体侵入的组织,造成有利于病原菌侵染繁殖的环境[10-14]。目前,小麦质外体中糖浓度的变化与Pst致病性的关系尚未报道。
本研究根据Pst吸器的颈环封闭形成独立的特殊质外体的特点,分别提取贵农22 和杂46 叶片质外体溶液,定量分析Pst接种后 0、1、2、3、4、8、14 d小麦质外体中葡萄糖浓度,旨在明确小麦质外体中糖浓度的变化与Pst致病性的关系,为探究Pst获取小麦糖类的关键基因奠定基础。
1 材料和方法
1.1 试验材料
供试小麦条锈菌(Puccinia striiformisf.sp.tritici)为CYR32,小麦条锈菌繁殖品种为铭贤169。供试小麦分别为杂46(感)和贵农22(抗)。
1.2 试验主要试剂与仪器
主要试剂为葡萄糖-6- 磷酸脱氢酶(G6PDH)、D- 己糖-6- 磷酸转移酶(HKX)、葡萄糖标准品、4-羟乙基哌嗪乙磺酸(HEPES)、烟酰胺腺嘌呤二核苷酸(NAD+)、二硫苏糖醇(DTT)、还原型 β- 烟酰胺腺嘌呤二核苷酸二钠盐(β-NADH 二钠)、腺嘌呤核苷三磷酸(ATP)、牛血清白蛋白(BSA)、草酰乙酸、山梨糖醇等,均购自Sigma 公司。酶标仪及Softmaxpro软件购自美谷分子仪器有限公司(MolecularDevices)。
1.3 试验方法
1.3.1 小麦条锈菌接种及小麦叶片质外体溶液提取 22 ℃(光/暗为16 h/8 h)恒温培养至杂46 和贵农22 第7 叶完全展开,用微型喷雾器分别喷雾接种小麦条锈菌CYR32 孢子悬浮液(0.125 mg/mL),分别组成亲和组合和非亲和组合。以蒸馏水喷雾杂46 和贵农22 为对照。10 ℃下黑暗保湿24 h,然后盖上隔离罩放置于人工气候室内,22 ℃下(光/暗为 16 h/8 h)培养。取接种后 0、1、2、3、4、8、14 d 完整的小麦叶片,用75%酒精轻轻擦拭各处理小麦叶片表面,参照PERIYANNAN 等[15]的方法室温下提取质外体溶液;收集质外体溶液后取5 μL 进行糖的定量分析,2 μL 检测细胞质污染,其余部分放于-20 ℃保存。
1.3.2 小麦质外体中葡萄糖浓度分析 酶标板每孔加入 5 μL 小麦质外体溶液和 185 μL 新鲜配置的 HEPES 缓冲液(100 mmol/L HEPES,pH 值 7.5,5 mmol/L MgCl2,1 mmol/L DTT,0.02%(m/V)BSA,8 mmol/L NAD+,4 mmol/L ATP)混合均匀后340 nm下测量吸光值,记录稳定吸光值A0。葡萄糖含量分析参照 SCHOLES 等[16]和 PERIYANNAN 等[15]的方法进行。
1.3.3 葡萄糖标准工作曲线制作 葡萄糖在HKX催化下与ATP 发生磷酸化反应,生成葡萄糖-6-磷酸(G-6-P)和二磷酸腺苷二钠(ADP),其中,G-6-P在G6PDH 催化下脱氢生成6- 磷酸葡萄糖酸内酯,并使NAD+还原成NADH。该反应中葡萄糖的消耗与NADH 的生成呈等摩尔关系,NADH 在340 nm处有特征吸收峰。将葡萄糖标准品进行反应一定时间,终止时NADH 的摩尔数等于葡萄糖标准品的摩尔数,测定其吸光值即可求得实际摩尔吸光系数。
精确称取葡萄糖标准品并配置成终浓度分别为 0.05、0.10、0.20、0.40、0.60、1.00 mmol/L 的溶液,分别取5 μL 按照1.2.2 方法测量吸光值,绘制图形,计算线性回归方程。
1.3.4 质外体溶液的细胞质污染检测 提取小麦叶片质外体溶液时可能发生细胞质膜受损,导致细胞质污染提取液。为评估细胞质污染的影响,本研究根据细胞质内的苹果酸在苹果酸脱氢酶作用下生成草酰乙酸,NADH 氧化脱氢导致340 nm 下吸光值下降,对细胞质污染率进行了检测。质外体溶液中细胞质污染检测采用苹果酸脱氢酶测定方法进行。分别取100 mg 未接种或接种Pst的小麦叶片,加入1 mL 0.2 mol/L 山梨糖醇研磨,作为100%细胞质污染对照。酶标板每孔加入2 μL 研磨所得滤液或小麦质外体溶液和196 μL 苹果酸脱氢酶缓冲液(100 mmol/L Tris-HCl,pH 7.5,0.1 mmol/L β-NADH 二钠),340 nm 下测定吸光值,记录稳定吸光值为A1CK或A1样品。然后每孔加入 2 μL 草酰乙酸,记录稳定的吸光值为A2CK或A2样品。
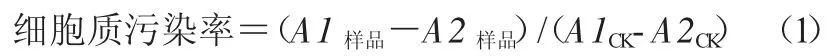
1.4 数据分析
数据采用Microsoft Excel 统计插件PHStat v 4.1处理;采用Duncan 氏新复极差法测验法进行数据差异显著性分析(P<0.05)。
2 结果与分析
2.1 葡萄糖标准品工作曲线
葡萄糖标准品 3 次重复配置的 0.05、0.10、0.20、0.40、0.60、1.00 mmol/L 溶液的吸光值平均值分别为 0.007 8、0.011 7、0.014 1、0.037 3、0.077 4、0.103 8,各浓度吸光度最小值和最大值分别为0.003 7 和 0.014 9、0.008 9 和 0.016 4、0.010 3 和0.019 3、0.031 5 和 0.043 5、0.070 1 和 0.082 8、0.087 4和0.122 0。吸光度—葡萄糖浓度呈线性部分的拟合方程为y=8.892 0x+0.018 1(R2=0.965 6)(图 1)。
2.2 受Pst 侵染的小麦质外体中葡萄糖的浓度变化
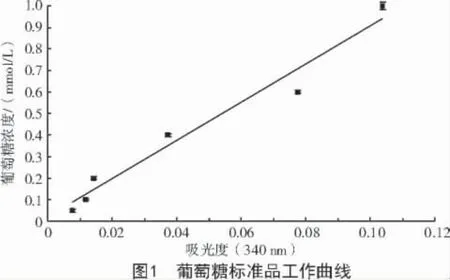
杂46 和贵农22 在蒸馏水喷雾、接种CYR32后 0、1、2、3、4、8、14 d 提取的质外体溶液中细胞质污染率最大为0.293 7,最小为0.125 9;总体上,对照贵农22 和杂46 蒸馏水喷雾后0~3 d 的细胞质污染率差异显著(P<0.05),接种后3~14 d 各处理的细胞质污染率差异不显著(表1),各处理间的细胞质污染率未呈现规律性变化。
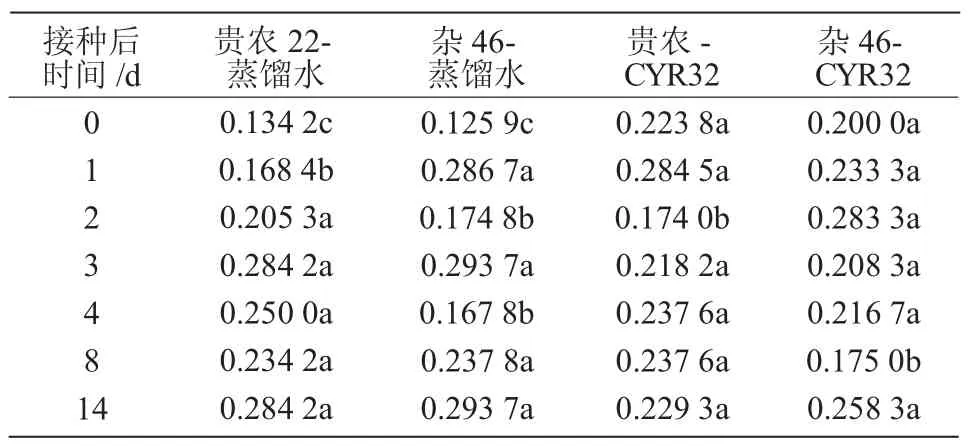
表1 接种CYR32 后提取的质外体溶液中细胞质污染率
由图2 可知,对照蒸馏水喷雾处理后0、1、2、3、4、8、14 d 贵农 22 和杂 46 质外体中葡萄糖浓度波动幅度较小,均未出现明显的浓度峰值,平均值分别为0.047 3、0.053 0 mmol/L;葡萄糖最高浓度分别为 0.056 3、0.066 6 mmol/L,最低浓度分别为0.035 9、0.036 2 mmol/L。贵农22- 蒸馏水与杂46-蒸馏水的质外体中葡萄糖浓度差异不显著。
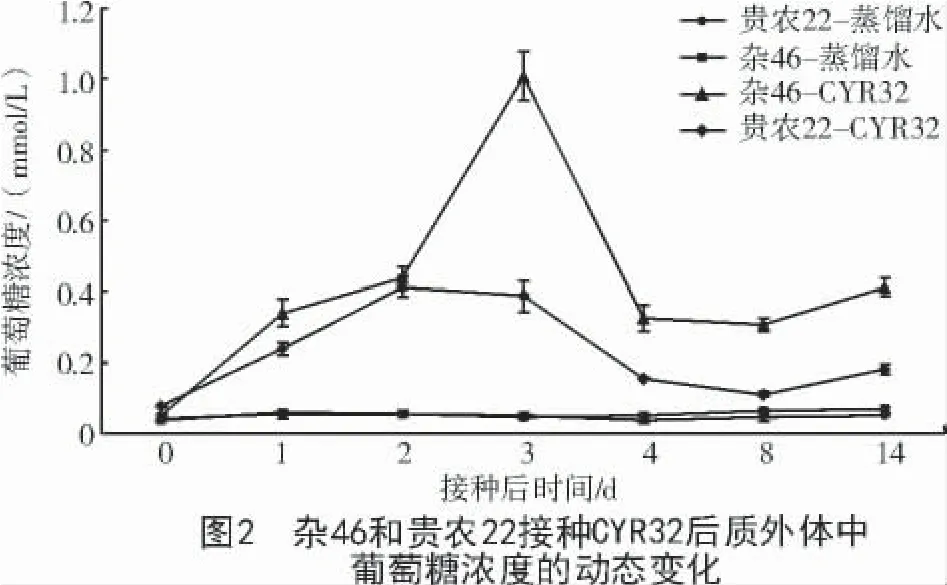
杂 46 接种 CYR32 后 0、1、2、3、4、8、14 d 质外体中葡萄糖浓度呈现明显的波动,接种后0~3 d浓度急剧升高,接种后3 d 葡萄糖浓度达最高值(1.006 9 mmol/L),是接种后 0 d 浓度(0.047 4 mmol/L)的21.23 倍;接种后4 d 浓度约为最高值的1/3(0.325 8 mmol/L),随后小幅升高;接种后14 d 浓度(0.412 8 mmol/L)约为最高值的0.41 倍。贵农22 接种 CYR32 后 0、1、2、3、4、8、14 d 叶片质外体中葡萄糖浓度平均值为0.223 0 mmol/L,接种后2 d 葡萄糖浓度从0.077 1 mmol/L(接种后0 d)上升到最高值0.412 2 mmol/L(接种后 2 d),为杂 46 接种 CYR32浓度峰值的0.41 倍;接种后3 d 浓度略有下降(0.386 7 mmol/L),随后浓度下降为该组合浓度峰值的0.38 倍,并保持相对稳定至接种后14 d(图2)。CYR32 接种的组合均与对照蒸馏水处理的组合质外体中葡萄糖浓度差异显著(P<0.05);杂46 与贵农22 接种CYR32 后质外体中葡萄糖浓度除接种后0、2 d 外其余时间点差异均显著(P<0.05)。
3 结论与讨论
目前,对Pst如何从小麦寄主将糖类吸收进入菌体尚不清楚。在大麦柄锈菌Puccinia hordei-大麦、白锈菌Albugo candida-拟南芥、玉米黑粉菌Ustilago maydis-玉米、黄曲霉菌Aspergillus flavus- 玉米等多种病原菌- 寄主互作中,均检测到蔗糖酶基因转录上调和蔗糖酶表达量明显增加[17-19]。最近研究发现,Pst中编码蔗糖酶的PsINV基因在Pst- 小麦亲和与非亲和互作中均大量表达,该基因产物可以高效分解蔗糖[20]。蔗糖酶主要功能是将蔗糖水解成葡萄糖和果糖,Pst侵染过程中蔗糖酶基因表达量增加可能有利于Pst将小麦质外体中的蔗糖分解成葡萄糖和果糖。Pst基因组中已发现编码葡萄糖转运蛋白的基因[21],但未发现预测编码果糖转运蛋白的基因,因此,Pst分解蔗糖产生的果糖累积可能将激发小麦的抗性反应。笔者发现,Pst侵染过程中预测编码磷酸葡萄糖变位酶、甘露糖-1- 磷酸鸟苷酰转移酶等与糖代谢相关的基因被诱导高度表达并且在不同毒力菌株间表达差异显著,甘露糖-1- 磷酸鸟苷酰转移酶具有专化的转运甘露糖功能。如果果糖在变位酶、甘露糖-1- 磷酸鸟苷酰转移酶等催化下转化为甘露糖,甘露糖-1- 磷酸鸟苷酰转移酶转运甘露糖,进而在甘露醇脱氢酶作用下还原为甘露醇,既避免了由于果糖与蔗糖的比例升高介导的小麦抗性,又可以将产生的甘露醇作为病原菌的碳源储备和淬灭寄主的活性氧。Pst如何调节小麦质外体中糖浓度和比例使之有利于菌体生长发育还需要进一步研究。
质外体是植物细胞间营养交流的基础空间,也是成功侵染的病原菌获取寄主糖类的重要场所。目前研究表明,受病原菌侵染的寄主植物质外体中的糖变化与其抗性表型相关,例如葡萄受到白粉菌Plasmopora viticola和霜霉菌Erysiphe cichoracearum侵染时质外体中糖含量降低限制了病原菌扩散[22]。受玉蜀黍黑粉菌Ustilago maydis侵染的玉米叶片中糖减少激发了水杨酸介导的对Ustilago maydis的抗性[23]。与此相似,本研究显示,感病和抗病小麦接种Pst后质外体中葡萄糖浓度均发生动态变化,但抗病小麦比感病小麦的质外体中葡萄糖浓度低,感病的杂46 接种后4 d 质外体中葡萄糖浓度从0.047 4 mmol/L 急剧升高到1.006 8 mmol/L,接种后14 d 葡萄糖浓度虽然比峰值时下降,但依然高于蒸馏水喷雾的杂46 质外体中葡萄糖浓度。而抗CYR32 的贵农22 接种后叶片质外体中葡萄糖浓度虽然也表现升高,但峰值仅为杂46 接种后峰值的0.41 倍。抗性小麦是否通过降低质外体中葡萄糖浓度限制Pst获取糖类,还需要结合Pst糖转运相关基因的表达等进一步研究。
