两株解磷菌的GFP 标记及其在复垦土壤中的定殖
2021-08-17王向英高建华孟会生洪坚平
王向英 ,高建华 ,孟会生 ,张 杰 ,武 欣 ,洪坚平
(1.山西农业大学生命科学学院,山西太谷030801;2.山西农业大学资源环境学院,山西太谷030801)
山西是煤炭大省,煤炭开采和复垦过程中的工程措施都会对土壤造成扰动,导致重构(复垦)土壤生产力低下,养分极度缺乏[1]。复垦土壤常因缺磷使固氮效率很低,磷素已成为限制矿区复垦土壤养分提升的主要因子[2-3],施用的磷肥也常因土壤的固定作用而效果不佳[4]。解磷微生物可将土壤中的难溶磷(有机磷或无机磷)转化为植物可利用的有效磷[5-6]。一些解磷菌还可以固氮,产生吲哚乙酸(IAA)、铁载体来促进植物生长[7-9]。因此,施用解磷微生物对复垦土壤中磷素活化以及促进植物对氮、磷的吸收具有积极作用。CHEN 等[10]从山西复垦土壤中筛选得到解磷菌S32,该菌株对难溶磷有较高的溶解能力,可明显提高复垦土壤中有效磷含量,显著提高水稻的株高、生物量、根系生长和磷的吸收。栗丽等[11]研究发现,与未接种解磷菌的处理相比,解磷菌能够促进磷矿粉和磷酸钙在复垦土壤中磷的生物有效性,提高盆栽油菜对磷的吸收。乔志伟等[12]研究表明,复垦土壤中施用解磷菌,可以改善土壤磷素的解吸特征,有利于土壤快速培肥,增加作物产量。孟会生等[13]研究表明,解磷菌肥与有机无机肥配施能够提高复垦土壤有效磷含量及碱性磷酸酶活性,促进土壤微生物群落多样性恢复,进而改善复垦土壤结构和肥力。
为准确回收投放到环境中的功能微生物,检测微生物在植物根际和土壤中的定殖情况,首先要对微生物进行标记。在诸多标记法中,绿色荧光蛋白(GFP)标记因具有基因小、灵敏度高、稳定性好、可以实时原位监测等优点,在研究微生物与环境、宿主相互作用,基因表达调控等方面得到广泛的应用[14-15],是目前理想的报告基因。但在实践中常出现解磷微生物田间作用效果不稳定的现象,制约了解磷菌肥的推广使用[5]。施用到土壤中的解磷微生物首先能够在土壤或植物根际有效定殖,才能发挥其解磷功能[16]。因此,研究解磷微生物在土壤及植物根际的定殖能力,对阐明其在土壤中的实际解磷效果具有重要意义。
本研究将含有GFP 的质粒转入前期分离的解磷菌w134 和w137 中,通过测定标记前后菌体的生长曲线和解磷能力变化来评估GFP 标记对菌株的影响,并初步研究其在复垦土壤中的定殖能力,为后期研究其在复垦土壤中的实际应用提供基础。
1 材料和方法
1.1 材料
解磷菌w134 和w137 分离自山西襄垣的矿区土壤,经鉴定2 株菌均为荧光假单胞菌(Pseudomonas fluorescence)。质粒 pRTGFP 为组成型 GFP基因(1.4 kb)克隆到广宿主载体pTR102 上,具有氨苄青霉素(Amp)和四环素(Tet)抗性,保存在大肠杆菌DH5α 中,由南京农业大学钟增涛教授惠赠。试验所用抗生素购自北京索莱宝科技有限公司。内切酶KpnⅠ和BglⅡ购自纽英伦生物技术(北京)有限公司(NewEngland Biolabs)。
含GFP 质粒的大肠杆菌DH5α 与解磷菌w134和 w137 均采用 LB 培养基,分别在 37、30 ℃条件下培养。测定w134 和w137 解磷能力时采用NBRIP培养基,配方为:葡萄糖10 g、Ca(3PO4)25 g、MgCl·22H2O 5 g、MgSO4·7H2O 0.25 g、KCl 0.2 g、(NH4)2SO40.1 g,蒸馏水 1 000 mL,pH 值为 7.0。
定殖试验的土壤取自山西襄垣采煤塌陷区生土,土壤类型为石灰性褐土,取回的土壤风干后过2 mm 筛,备用。有机肥为腐熟鸡粪,购自太谷鸿昊养殖场。
1.2 方法
1.2.1 GFP 标记菌株构建 将含GFP 质粒的大肠杆菌DH5α 活化,挑取单菌落于3 mL 含有Amp 50 μg/mL 和 Tet 50 μg/mL 的 LB 培养液中,37 ℃,180 r/min 过夜培养。按照质粒提取说明书(TIANGEN)步骤提取质粒,1%的琼脂糖凝胶电泳,Nanodrop 2000 测定质粒浓度,-20 ℃保存备用。
w134 和w137 的感受态制备和高压电击转化按照李晓婷[16]的方法进行;电击后迅速加入800 μL的 LB 培养液,30 ℃、100 r/min 培养 2 h;随后取100 μL 培养液涂布到含有 Amp 50 μg/mL 和 Tet 50 μg/mL 的 LB 平板上,30 ℃培养,观察是否有转化子长出;从有转化子长出的平板上随机挑取单菌落,接入含有相应抗生素浓度的LB 液体中,30 ℃、180 r/min 培养过夜;在荧光显微镜(OLYMPUS)下观察菌株是否有绿色荧光,并提取质粒。配置30 μL的酶切体系:10×Buffer 3 μL、酶BglⅡ0.5 μL、酶KpnⅠ0.5 μL、质粒 DNA 26.0 μL,置于 37 ℃,水浴30 min,后用1%的琼脂糖凝胶电泳。
1.2.2 标记菌株的稳定性检测 在非选择压力下检测标记菌的稳定性[17]。用不含抗生素的LB 液体培养基进行培养,对GFP 标记菌株在指数期以1%的接种量连续转接15 代,相当于连续平板传代培养100 代[18];后蘸取第15 代培养的菌液在含有抗生素的LB 平板上划线,挑取单菌落,小摇,提质粒。并且在荧光显微镜下观察菌株是否还有绿色荧光。
1.2.3 标记前后菌株生长曲线比较 分别挑取野生菌和GFP 标记菌的单菌落于3 mL LB 中培养,当OD600值约0.5 时,按1%接种量接入含100 mL LB的三角瓶中,3 次重复,30 ℃、180 r/min 连续培养,每1 h 取样一次,于600 nm 下测定其OD 值。
1.2.4 标记前后菌株解磷能力比较 平板测定:将野生菌和GFP 标记菌分别点种在NBRIP 固体平板上,30 ℃培养7 d,测定菌落直径和透明圈直径,计算透明圈与菌落直径比。
液体培养测定:按1%的接种量接入NBRIP 液体培养基中,设 3 个重复,30 ℃、180 r/min 培养 7 d;每天取样5 mL,于10 000 r/min 离心 10 min,用钼蓝比色法测定上清液中有效磷含量。
1.2.5 标记菌株在复垦土壤中的定殖 将标记菌w134GFP、w137GFP 分别接入复垦土壤中,试验设未灭菌土壤(N)、未灭菌土壤+有机肥(NM)、灭菌土壤(S)、灭菌土壤+有机肥(SM)共 4 个处理,观察菌株在90 d 内的定殖动态以及土壤灭菌和施加肥料对定殖的影响(表1)。每盆装650 g 土,按照5%(V/m)的接种量接入标记菌的菌悬液(1.0×109cfu/mL),土壤中菌体的初始含量为5.0×107cfu/g,每处理3 个重复。前42 d 每7 d 进行一次涂板计数,之后每10 d 进行一次涂板计数,期间保持土壤含水量在12%左右。
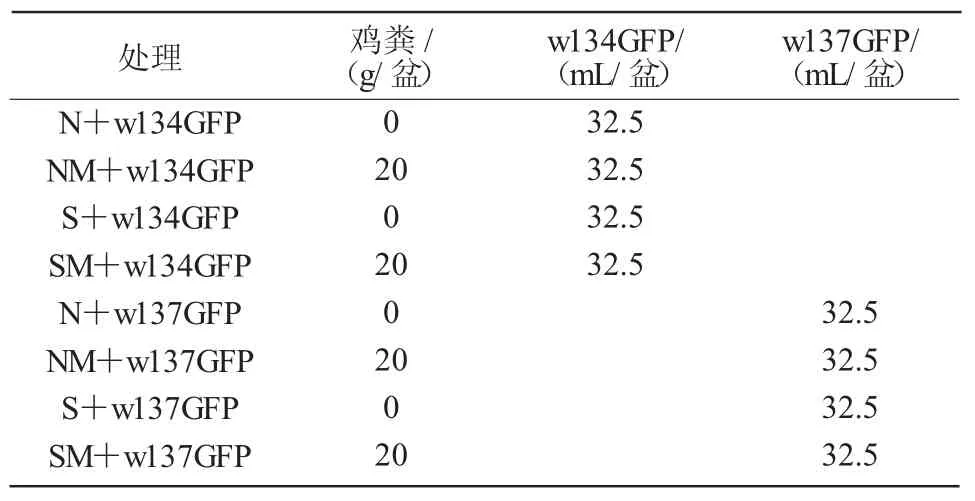
表1 标记菌在复垦土壤中定殖试验设计
每次涂板计数之前将盆中的土混合均匀,每盆取10 g 土,按照平板稀释涂布法,涂布于含Amp 50 mg/L 和 Tet 50 mg/L 的 LB 平板上,30 ℃培养36~48 h,观察计数。
1.3 数据处理
采用Excel 进行数据和图表处理;方差分析利用SPSS 21.0 软件进行。
2 结果与分析
2.1 GFP 标记菌株的构建与检测鉴定
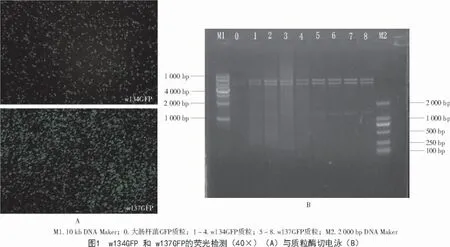
野生菌w134 和w137 均不能在Amp 50 mg/L和Tet 50 mg/L 的双抗平板上生长,而GFP 质粒具有Amp 和Tet 抗性,电击转化后能在LB 双抗平板上生长的菌落即为转化子,记为w134GFP 和w137GFP。荧光显微镜中可以观察到转化子都带有强烈的绿色荧光(图1-A),说明质粒pTRGFP 已分别转入w134 和w137 中且GFP 基因成功表达。提质粒酶切后的条带如图1-B 所示,与大肠杆菌DH5α的GFP 质粒酶切后的条带相同,且都有一个大约1.4 kb 的条带,与组成型的GFP 大小一致,再次证明GFP 质粒已成功转入w134 和w137 中。
2.2 标记菌的稳定性试验
在不加抗生素的条件下,将连续传代培养15 代后的w134GFP 和w137GFP 进行荧光检测和质粒提取,仍可以看见强烈的绿色荧光,并提取出相应的质粒。说明GFP 质粒在w134GFP 和w137GFP 传代过程中可稳定表达,可进行后续的定殖试验。
2.3 GFP 标记前后菌株生长情况比较
由图 2 可知,2 株解磷菌 w134 和 w137 在 GFP标记前后的生长曲线基本一致,0~2 h 为延迟期,2~8 h 是对数生长期,8 h 后进入稳定期。值得注意的是,w134GFP 的 OD 值在前 8 h 内略低于 w134,w137GFP 的OD 值在前7 h 内略低于w137。可见,GFP 标记对解磷菌的生长速度略有影响,但均未影响2 个菌株最终的生长量。

2.4 GFP 标记前后菌株的解磷能力比较
溶磷圈可以展现解磷菌解磷能力的大小,溶磷圈直径与菌落直径比值越大,说明解磷能力越强[19]。
由表 2 可知,w134 的 D/d 高于 w134GFP,分别为 1.37 和 1.29;w137 的 D/d 高于 w137GFP,分别为1.66 和1.57,且标记前后的D/d 无显著差异(P>0.05)。说明GFP 标记后均在磷酸三钙平板上的解磷能力略有下降,但差异不显著(P<0.05)。
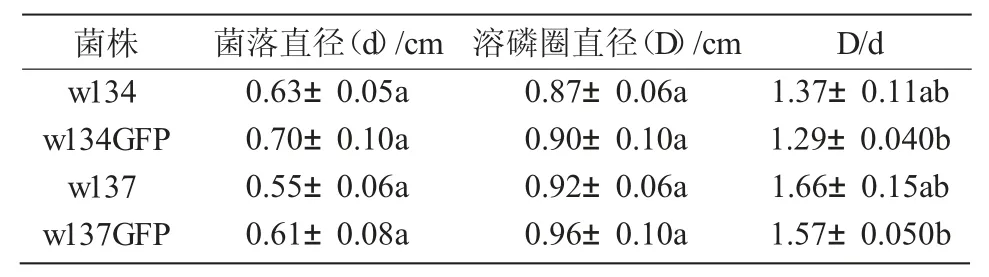
表2 GFP 标记前后菌株在NBRIP 平板上的溶磷圈
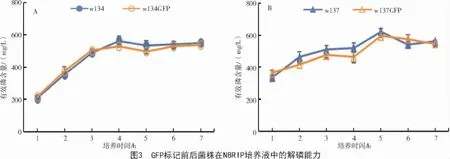
菌株的解磷能力一般以NBRIP 培养液中有效磷的多少来衡量[19]。由图3 可知,标记菌在NBRIP培养液中有效磷含量的变化曲线和对应的野生菌基本一致;w134 和w134GFP 在NBRIP 培养液中最大有效磷含量分别为 562.07、529.68 mg/L(图3-A),w137 和 w137GFP 在 NBRIP 培养液中最大有效磷含量分别为624.35、596.32 mg/L(图3-B)。可见,GFP 标记后w134 和w137 的解磷能力均有所降低,但是没有造成菌株解磷能力的显著降低或者丧失。
2.5 标记菌在复垦土壤中的定殖动态
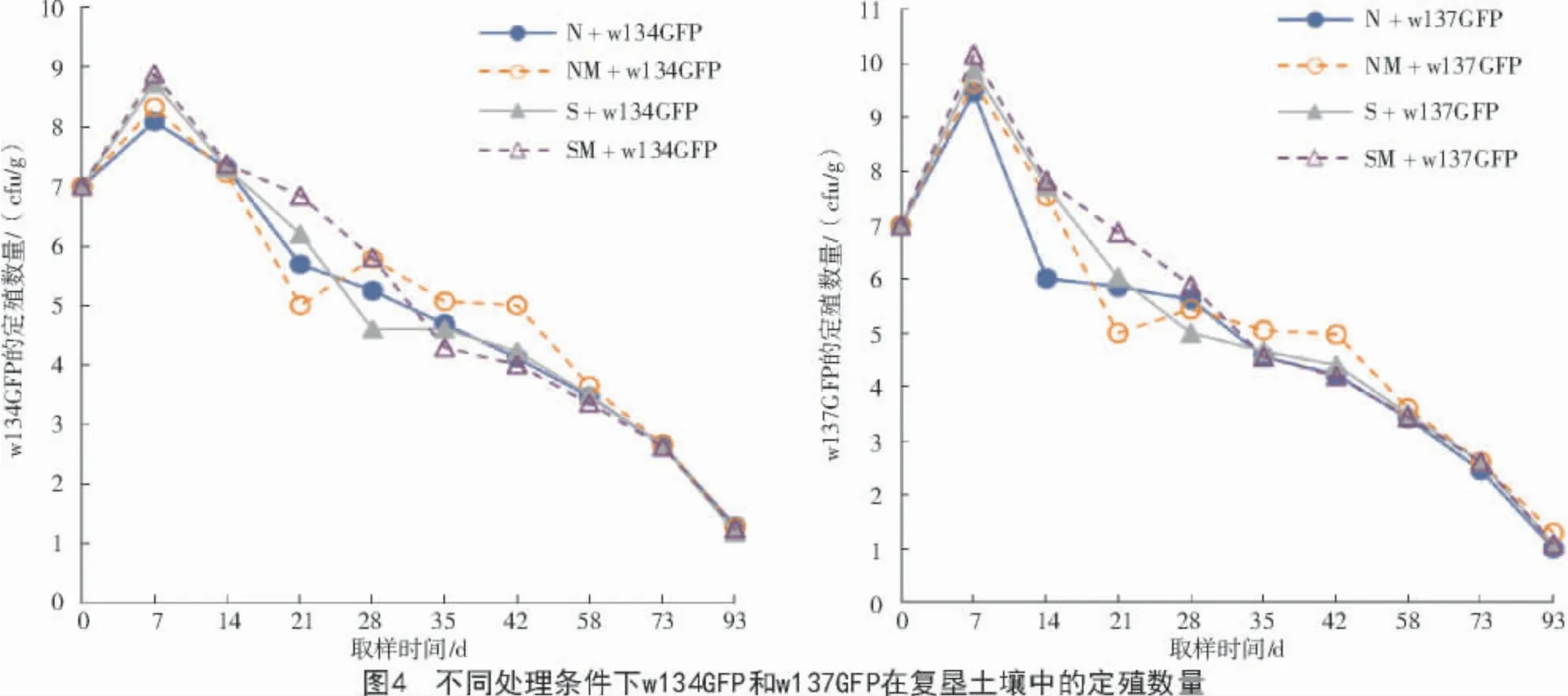
不同处理条件下标记菌在复垦土壤中90 d 定殖动态变化如图4 所示,从总体上看,不论土壤是否灭菌、是否添加有机肥,w134GFP 和w137GFP 的定殖数量都是随时间的延长逐渐降低。2 株菌在接种7 d 达到定殖数量的最高值,w134GFP 的数量在7.6×108cfu/g,w137GFP 的数量在 9.8×109cfu/g;接种 35 d 时,2 株菌数量分别降到 4.6×104、4.5×104cfu/g;接种 93 d,2 株菌数量已降至 10~20 cfu/g,达到检测的下限。
进一步分析发现,未灭菌土壤+有机肥(NM)处理下的菌体数量在28~58 d 时高于未灭菌土壤不施肥(N)处理,即NM+w134GFP>N+w134GFP,NM+w137GFP>N+w137GFP;而灭菌土壤+有机肥(SM)处理下的菌体定殖数量在0~28 d 高于灭菌土壤不施肥(S)处理,即SM+w134GFP>S+w134GFP,SM+w137GFP>S+w137GFP。可见,添加有机肥可以促进w134GFP 和w137GFP 在复垦土壤中的定殖。
不施有机肥时,在0~21 d,灭菌土壤(S)中的标记菌数量高于未灭菌土壤(N),即S+w134GFP>N+w134GFP,S+w137GFP>N+w137GFP;到 28 d 时灭菌土壤(S)处理均低于不灭菌土壤(N)处理;28 d后土壤灭菌和不灭菌处理间的菌体数量基本持平。添加有机肥(M)时,在0~28 d 灭菌土壤+有机肥(SM)处理中标记菌数量高于不灭菌土壤+有机肥(NM)处理的,即 SM+w134GFP>NM+w134GFP,SM+w137GFP>NM+w137GFP;在 28~58 d 时生长发生逆转,不灭菌土壤+有机肥(NM)处理中的标记菌数量高于灭菌土壤+有机肥(SM)处理,58 d之后二者菌体数量持平。
从2 株标记菌的整个定殖过程来看,4 个处理的定殖效果也不尽相同,0~28 d,灭菌土壤+有机肥(SM)处理的菌体数量高于其他3 个处理;28~58 d,不灭菌土壤+有机肥(NM)的菌体数量高于其他3 个处理;58 d 之后4 个处理之间菌体数量差异不大。
3 讨论
3.1 GFP 标记对菌体生长和解磷能力的影响
绿色荧光蛋白(GFP)以标记基因小、基因表达产物对细胞没有毒害的作用、安全稳定、荧光标记检测方便等优点[14],成为研究功能微生物在自然环境中存活与定殖状况的有效手段。许多研究证实[15-17,20],GFP 可对不同物种进行标记,而且标记菌株与出发菌株的生长速率无明显差别,功能活性相当,连续培养条件下标记菌株的GFP 可稳定遗传。本试验也采用了GFP 标记,而且经过连续15 代的无选择压力的传代培养,荧光显微镜下仍能看见强烈的绿色荧光,并能提取出相应的质粒。说明GFP质粒表达稳定,解磷菌w134 和w137 的GFP 标记菌株构建成功。
从生长曲线来看,标记菌的生长曲线与野生菌的基本一致,只是标记菌在前7~8 h 的OD 值略低于野生菌。可见,引入的GFP 质粒还是稍微增加了细胞的代谢负荷,削弱了菌株的适应性。这与李晓婷[16]的研究结果一致。
虽然有研究认为,解磷圈的大小不能准确反映解磷能力的强弱[19],但对于同一菌株来说,溶磷圈仍旧可以粗略地展现GFP 标记前后解磷能力的变化。本研究中,标记菌的D/d 值略小于野生菌,应该是受导入质粒的影响。通常,研究解磷能力还是以NBRIP 培养液中有效磷的多少来衡量。本研究结果表明,标记菌和野生菌在NBRIP 培养液中解磷能力没有显著差别,说明GFP 质粒转入对w134 和w137的解磷能力影响不大。张磊等[20]和张霞等[21]的研究也发现,GFP 基因的导入基本不影响解磷菌的解磷能力。总之,GFP 标记对w134 和w137 的生长和解磷能力没有显著影响,而且GFP 质粒遗传稳定,可以用于后续的定殖试验。
3.2 解磷菌在复垦土壤中的定殖
外来功能菌在自然土壤中定殖的典型特征是:在接种后最初几天细菌群体的生长呈增加趋势,然后开始持续下降直至检测下限(约50 cfu/g)。本研究结果表明,w134GFP 和w137GFP 在复垦土壤中的定殖数量在接种7 d 时达最大值分别为7.6×108、9.8×109cfu/g;之后逐渐降低,35 d 降到 4.5×104cfu/g;93 d 降到 10~20 cfu/g。乔志伟[19]研究发现,在磷细菌+葡萄糖+尿素+基质处理的土壤中,磷细菌数量在接种7 d 达到最大值1.0×108cfu/g,随后逐渐降低,60 d 降到约3.3×104cfu/g,与本研究定殖规律类似。但也有研究发现,解磷菌在土壤中的定殖数量一直呈下降趋势,没有增加现象。李晓婷等[16]研究发现,解磷菌K3 在土壤中数量在35 d内从 1.0×109cfu/g 降低到 1.0×103cfu/g 左右;张霞等[21]研究发现,GFP 标记菌与出发菌株在土壤中的消长动态相似,随时间延长定殖数量下降,接种60 d 的数量分别为 1.63×104、3.30×102cfu/g,100 d检测不到。王珍等[22]研究也发现,解磷菌WY4-GFP在小白菜根际及土壤中的定殖规律是随时间的增加定殖数量逐渐减少。外来微生物定殖数量缓慢下降是一个共性的现象,但不同菌株在土壤中定殖的数量和时间,以及会不会在接种的最初几天里数量增加,都不尽相同。这可能是由于植物根系与微生物[23]、微生物之间相互作用的复杂性,以及土壤质地、水分特征等理化性质的影响[24],因此,很难对所观察到这一现象进行理论上的分析,要揭示环境因子对菌株定殖的影响,还有待今后深入研究。
在土壤是否灭菌上,韦兵等[25]研究发现,灭菌土壤中JK45-L 菌的数量下降的速度明显比不灭菌土壤中慢;王平等[24]也研究发现,荧光假单胞菌X16L2 在灭菌土壤中的存活量要显著高于不灭菌土壤。本试验研究也发现,在接菌的前28 d内,灭菌土壤组中w134GFP 和w137GFP 的定殖数量高于对应的未灭菌土壤中的定殖数量。可见,与自然土壤相比,灭菌土壤中因没有土著微生物的拮抗作用和竞争作用,也没有原生动物的捕食作用以及噬菌体引起的细胞溃溶,外来微生物更容易定殖。但随着时间延长,土壤灭菌和不灭菌对定殖的影响逐渐减小。58 d 时,土壤灭菌组的标记菌数量在(2.3~3.1)×103cfu/g,未灭菌土壤组的标记菌数量在(2.6~4.5)×103cfu/g,差别不大。余旋[26]研究也有类似的发现,灭菌土和未灭菌土中接种的磷细菌数量在60 d 后分别为 3.38×103、3.40×103cfu/g,灭菌土和未灭菌土中接种的磷细菌数量相当。
外来微生物施入土壤发挥作用的一个前提条件就是要能够进行有效定殖,在诸多影响外来菌株根际定殖的因素中,首先是土壤或根系分泌的营养物质对外来微生物的影响。NINWE 等[27]将GFP 标记的荧光假单胞菌SBW25 施入土壤中,结果发现,SBW25 的很大一部分变得不活跃或者死亡,这可能表明细胞在土壤中进入休眠状态,类似于在纯培养的饥饿条件下观察到的。NORMANDE 等[28]也研究发现,将荧光假单胞菌DR54-BN14 接种到土壤中21~28 d 后,DR54-BN14 细胞大部分处于饥饿状态。而虞伟斌[29]则研究发现,添加有机肥能促进解磷菌GFPK3 在土壤中的定殖。本研究也发现,在配施有机肥的处理中,灭菌土壤中标记菌的数量在21~35 d 高于不施肥处理,类似地自然土壤中标记菌数量在28~42 d 高于对应的不施肥处理,这可能是由于配施有机肥的作用。复垦土壤养分贫瘠,可供微生物生长的能源物质较少,解磷菌从室内分离培养到释放复垦土壤中,营养条件发生巨大的反差,容易造成菌体死亡或休眠,而有机肥可以给菌株提供合适的碳氮源以及生存空间,增强其在复垦土壤中的定殖能力。
本试验利用电击转化法获得了遗传稳定的GFP 标记菌株w134GFP 和w137GFP,并且标记菌和野生菌在生长曲线和解磷能力上无显著差异。对标记菌在复垦土壤中的定殖能力进行研究,结果发现,w134GFP 和 w137GFP 均在接种 7 d 达到定殖数量的最高值,分别为 7.6×108、9.8×109cfu/g,之后标记菌数量逐渐下降,可在复垦土壤中定殖93 d左右。说明w134GFP 和w137GFP 可以作为研究解磷菌在复垦土壤中定殖能力的特征材料,对进一步揭示解磷菌在复垦土壤中的生态功能奠定基础。
