In2S3-ZnIn2S4复合结构的光动力抗菌效果研究
2021-08-17钱海生
阮 娟,章 军,钱海生
(1.合肥工业大学 食品与生物工程学院,安徽 合肥 230009;2.安徽医科大学 生物医学工程学院,安徽 合肥 230032)
引言
地球上的细菌数量约为5×1030种,大大超过了动植物的总数[1-2]。虽然b细菌对人类无害甚至有益,但相当多的细菌具有传染性,甚至可导致致命疾病,传染病对公共卫生、经济和精神健康造成了巨大负担[3-4]。例如,新冠肺炎(COVID-19)疫情在全球范围内爆发,严重威胁全球公共卫生安全。最新的临床报告显示,许多COVID-19患者死于继发感染,包括耐抗生素细菌感染,而不是病毒本身[5-6]。一旦细菌接触到伤口,它们就会利用伤口周围的营养物质,并开始以惊人的速度生长,导致伤口感染和发炎。近年来抗生素已成为治疗细菌感染性疾病最常用的抗菌药物。尽管抗生素本身具有杀灭细菌的能力,而且容易获得,但抗生素的过度使用和滥用在很大程度上抑制了它们的有效性,导致细菌耐药性,甚至超级细菌的出现[7]。因此,探索无抗生素治疗方案对治疗细菌感染性疾病具有重要意义。
光动力疗法(PDT)是目前用于治疗恶性肿瘤的一种重要方法,近年来,由于其独特的作用机制,PDT在对抗细菌感染方面引起了广泛的关注。PDT使用一种无毒的光敏剂在光激活时原位产生高毒性的活性氧(ROS),这种新出现的方法也被称为光动力抗菌,它被认为是治疗感染性疾病(特别是局部感染引起的疾病)的一种有希望的替代方法。与常规抗菌药物治疗相比,光动力抗菌试剂具有疗效快、选择性好、可忽略全身毒性、反复光敏治疗不存在耐药性等明显优势。迄今为止,人们研究了大量的光敏化合物[8]。Li等人设计了Bi2S3/Ti3C2Tx的肖特基结构,在808nm的近红外光照射下可杀死99.86%的金黄色葡萄球菌和99.92%的大肠杆菌[9]。Sun等人设计了BiOI纳米片,具有较好的电子结构,在808nm光照射下具有更高的杀灭大肠杆菌的活性[10]。构建具有优异光催化性能的复合纳米结构是光动力抗菌的重要研究方向。
ZnIn2S4具有良好的可见光吸收是一种具有优异光催化性能和生物相容性的三元硫化物。然而,单一的ZnIn2S4光生电子和空穴的复合率较高,导致光催化效率较低,限制了其实际应用。为了提高ZnIn2S4的光催化活性,采用了各种策略,如构建异质结、控制形貌、掺杂过渡金属等[11-13]。本文设计了一种In2S3-ZnIn2S4复合结构,掺杂了In2S3后,带隙变窄,在可见光的照射下,电子跃迁更容易发生,在可见光的照射下产生ROS的效率更高。我们选择了大肠杆菌和金黄色葡萄球菌作为细菌模型,体外抗菌实验证明In2S3-ZnIn2S4复合结构比单一的ZnIn2S4具有更高的抗菌活性。
1 实验部分
1.1 试剂与仪器
十六烷基三甲基溴化铵(CTAB,99%),亚甲基蓝(MB,90%),L-抗坏血酸(AA,99%),对苯二甲酸(TA,99%)均购于上海麦克林生化科技有限公司。9,10-蒽基-双(亚甲基)二丙二酸(ABDA,99%)购于南京哈柏医药科技有限公司。LB琼脂培养基购于上海博微生物科技有限公司。乌洛托品(HMTA,99%),六水合硝酸锌(Zn(NO3)2·6H2O,99.99%),硫代乙酰苯胺(TAA,98%)六水合氯化铟(InCl3·6H2O,99.0%)均购于上海阿拉丁生化科技股份有限公司。
透射电子显微镜(TEM,JEM-2100F,日本日立),高分辨率透射电子显微镜(HRTEM,JEM-2100F,日本日立),场发射扫描电子显微镜(FESEM,SU8020,日本日立),X-射线粉末衍射仪(XRD,X’Pert PRO MPD,Cu靶作为辐射源,扫描范围2θ为10°~70°,荷兰),X射线光电子能谱(XPS, ESCALAB250Xi,Thermo Scientific,美国),紫外分光光度计(U-5100,日立高新技术公司,日本)。
1.2 In2S3-ZnIn2S4复合结构的合成
以之前报道的高活性AA-[Zn(OH)4]2-纳米球为硬模板,采用水热法合成了In2S3-ZnIn2S4复合纳米结构。将40mg AA-[Zn(OH)4]2-纳米球分散在20mL去离子水中,随后加入10mL溶有InCl3·6H2O(0.8mmol)和TAA(3.2mmol)的水溶液,在常温下搅拌1h后,将上述溶液转移到50mL的聚四氟乙烯内衬的不锈钢高压反应釜中,密封并且在180℃下反应4h,随后,自然冷却至室温,用去离子水离心洗涤三次,冷冻干燥后收集备用。
1.3 单一组分的In2S3和ZnIn2S4的合成
ZnIn2S4的合成是将高活性的AA-[Zn(OH)4]2-锌源换成Zn(NO3)2·6H2O。将0.2mmol的Zn(NO3)2·6H2O充分溶解于20mL去离子水中,随后加入10mL溶有0.4mmol的InCl3·6H2O和0.8mmol的TAA的去离子水,在常温下搅拌1h后,在180℃下通过水热反应4h,随后,自然冷却至室温,用去离子水离心洗涤三次,冷冻干燥后收集备用。In2S3的合成是将0.4mmol的InCl3·6H2O和0.8mmol的TAA溶于30mL的去离子水中,在常温下搅拌1h后,在180℃下通过水热反应4h,随后,自然冷却至室温,用去离子水离心洗涤三次,冷冻干燥后收集备用。
1.4 In2S3-ZnIn2S4体外光动力效果检测
(1)亚甲基蓝(MB)降解实验
通过活性氧检测探针MB来检测In2S3-ZnIn2S4体外光动力效果。在40mL的MB(10μg/mL)溶液中加入200μg/mL的In2S3-ZnIn2S4纳米粒子,在黑暗中搅拌1h,达到吸附-脱附平衡。接着用功率密度为100mW/cm2氙灯(相当于一个太阳光强度)模拟外源光光照(滤光片滤去波长<400nm的紫外光)照射上述溶液,每隔5min取一次溶液,离心去除In2S3-ZnIn2S4纳米粒子,取上清液用紫外-可见分光光度计测定上清液在665nm处的吸光度。
(2)羟基自由基(·OH)检测
引入对苯二甲酸(TA)作为标准试剂来评估·OH的产生,·OH会使TA氧化形成具有强荧光的羟基对苯二甲酸(TAOH),用荧光光谱仪检测荧光的强度间接检测·OH的产生;首先,称取830mg对苯二甲酸加入到50mL NaOH溶液(0.01M)中超声溶解。然后,将10.00mg In2S3-ZnIn2S4加入TAOH溶液中,避光搅拌1h,使溶液达到吸附-脱附平衡。然后,用100mW/cm2氙灯模拟外源光光照,每隔10min取出3mL的反应液,离心后取上层清液并测定荧光光谱。
(3)单线态氧(1O2)检测
引入9,10-蒽二甲双(亚甲基)二丙二酸(ABDA)通过UV-Vis光谱来检测1O2的产生。首先,将0.5mg In2S3-ZnIn2S4添加到2mL ABDA的PBS溶液(0.1M,pH=7.4)中,黑暗搅拌1h,使溶液达到吸附-脱附平衡,用100mW/cm2氙灯模拟外源光光照,每隔10min取出3mL的溶液,离心后取上清液测其在379nm处的吸光度。
1.5 In2S3-ZnIn2S4抗菌效果检测
首先于锥形瓶中按比例配置一定量的琼脂培养基与肉汤培养基(50mL),将其与后续实验所需的试剂及培养皿等于高压灭菌锅中灭菌(121℃,20min)。灭菌结束后,在洁净工作台中,将琼脂培养基倒入培养皿,待其冷却凝固至室温,紫外灯照射后,备用。然后取大肠杆菌悬液50μL加入已灭菌的肉汤培养基中,并将其置于37℃恒温培养箱培养12h。接着用无菌水将材料In2S3-ZnIn2S4(ZnIn2S4或In2S3)配置为1mg/mL母液,超声使其分散均匀,于紫外灯照射30min,备用。在超净工作台中,点燃酒精灯,用无菌水将材料稀释至200μg/mL,将9mL材料溶液与培养12h后的大肠杆菌悬液1mL于试管中混合均匀,避光条件下,在恒温摇床中(37℃,转速180r/min)培养1h,使其达到吸附-脱附平衡。然后用100mW/cm2的氙灯模拟外源光照射,每隔10min取样品1mL,逐级稀释至105倍,接着吸取100μL In2S3-ZnIn2S4水溶液涂布在琼脂培养基表面,置于37℃恒温培养箱中培养24h,最后对菌落个数进行统计分析。
2 结果与讨论
2.1 花状结构In2S3-ZnIn2S4的形貌表征
采用高活性AA-[Zn(OH)4]2-非晶纳米球作为硬模板,在含有铟源和硫源的水溶液中通过阳离子交换策略合成了花状结构的In2S3-ZnIn2S4。采用SEM对合成AA-[Zn(OH)4]2-进行表征。如图1a所示,AA-[Zn(OH)4]2-非晶纳米球的SEM照片显示其直径约350nm,且大小均一,单分散性良好。在获得AA-[Zn(OH)4]2-复合微球的基础上,采用水热法进一步制备了In2S3-ZnIn2S4复合结构。
如图1d所示,In2S3-ZnIn2S4复合结构的主体是片层组装的花状结构的ZnIn2S4纳米球(图1b,c)。图1e放大的TEM图像显示,在二维ZnIn2S4片层上附着一些无定型的小颗粒。如图1f所示,HRTEM图像显示复合结构中存在两种不同的晶格。其中3.01Å的晶格条纹对应In2S3的(215)晶面,1.96Å的晶格条纹对应ZnIn2S4的(110)晶面,该结果证明了附着的小颗粒为In2S3。通过扫描透射电子显微镜(STEM)分析复合结构中的元素分布。如图1i~k所示,元素映射图表明Zn,In和S的元素均匀分布在复合结构中,但是各元素的分布没有出现明显的分界,所以该复合机构的物相需要进行进一步的验证。

图1 形貌图((a)AA-[Zn(OH)4]2-的SEM图像;ZnIn2S4的(b)SEM图像和(c)TEM图像;In2S3-ZnIn2S4复合结构的(d)(e)TEM图像,(f)HRTEM图像,(h)STEM图像和(i-k)元素分布图)
2.2 In2S3-ZnIn2S4复合结构的物相分析和元素分析
采用XRD对样品的物相进行进一步分析,图2a中的In2S3-ZnIn2S4的XRD图像显示样品与六方相的In2S3晶体(JCPDS No.25-0390)和ZnIn2S4晶体(JCPDS No.48-1778)的标准衍射峰分别对应,表明In2S3-ZnIn2S4复合结构的成功制备。利用XPS对In2S3-ZnIn2S4的元素组成和各元素的化学价态进行了分析。如图2b,c,d所示,在452.53eV和444.93eV处的结合能对应着In3+3d,在1022.98eV和1046.08eV处的结合能对应着Zn2+2p,在1161.68eV处的结合能对应着S2-2p。由上述结果可以确定样品中的元素分别为In3+,Zn2+和S2-。

图2 In2S3-ZnIn2S4复合结构的物相和元素图谱((a)XRD图谱;XPS图谱:(b)In;(c)Zn;(d)S)
为了得到各个元素的具体占比,我们利用能量色散X射线光谱仪(EDX)对各个元素含量进行定量分析(图3)。如表1所示,In∶Zn∶S的原子组成百分比约为5∶1∶8,其中Zn的原子百分比少,证明了该复合结构中不完全是ZnIn2S4,还存在In2S3。

图3 In2S3-ZnIn2S4复合结构的EDX能谱

表1 In2S3-ZnIn2S4复合结构的EDX元素比例分析
2.3 In2S3-ZnIn2S4复合结构的光吸收
如图4的In2S3-ZnIn2S4复合结构和ZnIn2S4的紫外-可见-近红外吸收谱所示,单一的ZnIn2S4的最大吸收峰约在450nm处(可见光区域),与单一的ZnIn2S4相比,In2S3-ZnIn2S4复合结构的最大吸收峰向长波长方向移动,发生了红移,带隙减小到2.3eV。说明掺杂了In2S3后,带隙变窄,在可见光的照射下,电子跃迁更容易发生,光催化效率更好。
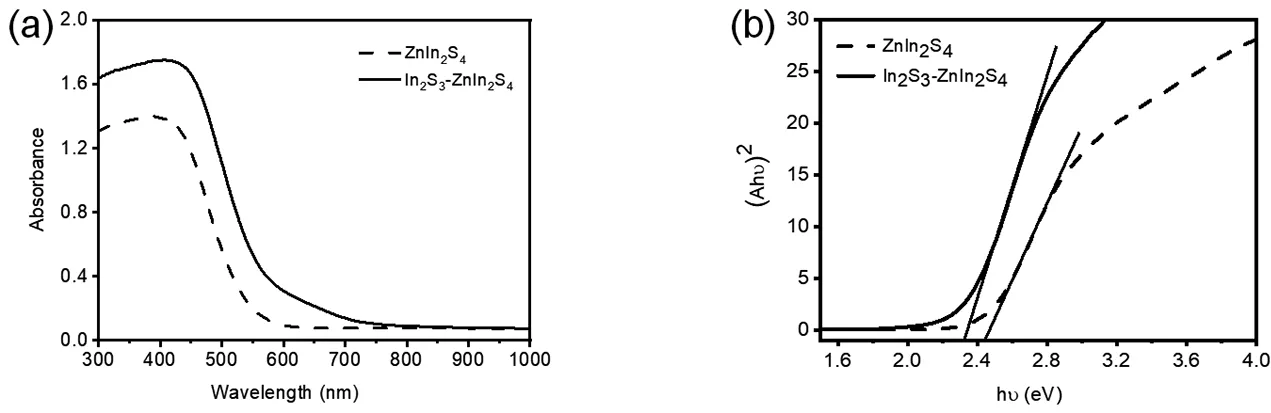
图4 In2S3-ZnIn2S4和ZnIn2S4的光吸收((a)吸收光谱;(b)库伯卡-曼克反射函数)
2.4 In2S3-ZnIn2S4复合结构在可见光照射下产生活性氧性能分析
为了验证In2S3-ZnIn2S4复合结构在可见光照射下可以产生ROS,我们采用ROS检测探针MB,通过观察其颜色变化和在664nm处特征吸收峰的变化可以判断是否产生了活性氧。从图5a中可以看出随着光照时间的延长,MB在664nm处的特征峰值逐渐下降,表明In2S3-ZnIn2S4在可见光照射下具有良好的产生活性氧能力。由图5b,c的降解速率曲线和反应动力学曲线分析可发现,与单一组分的In2S3和ZnIn2S4相比,In2S3-ZnIn2S4复合结构显示出更优异的光催化能力。光照35min后In2S3-ZnIn2S4复合结构对MB的降解率为93%,而单一结构的In2S3和ZnIn2S4对MB的降解率只有65%和70%。说明In2S3的掺杂降低了ZnIn2S4的带隙,提高了其光动力产生活性氧能力。如图5d所示,In2S3-ZnIn2S4在光照三次后,依旧具有较高的产生活性氧的能力,表明该复合结构具有良好的光稳定性。
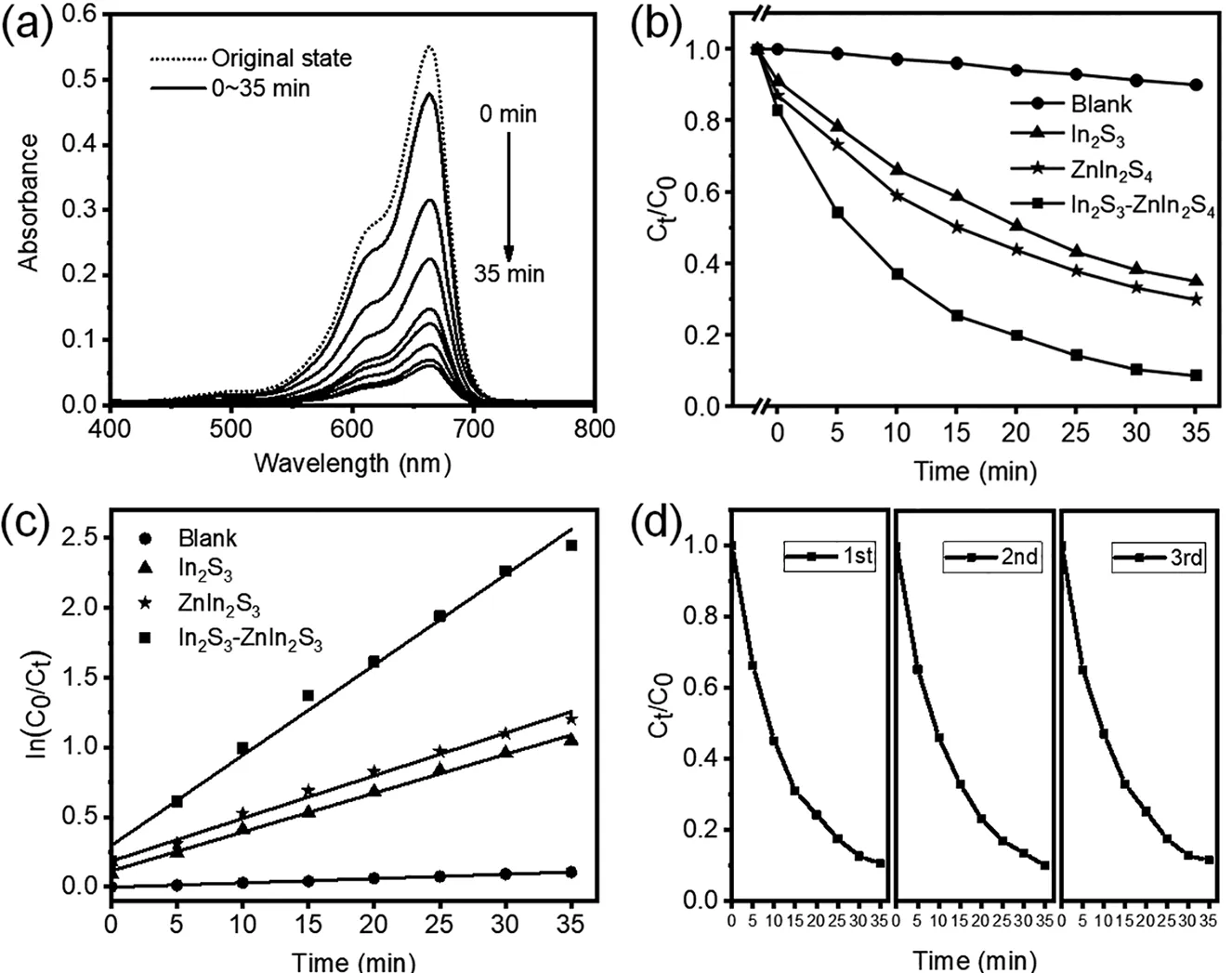
图5 (a)In2S3-ZnIn2S4降解MB不同时间的吸收光谱;In2S3,ZnIn2S4和In2S3-ZnIn2S4复合结构在可见光照射下降解MB的(b)降解速率曲线和(c)反应动力学曲线(C0和Ct分别是第0、5、10、15、20、15、35分钟MB溶液在664nm处的吸光度);(d)In2S3-ZnIn2S4复合结构对MB的降解三次循环实验
为了更进一步探究其机理,我们引入TA和ABDA检测所产生活性氧的种类。图6a显示加光照后随时间延长,荧光没有明显增加,说明只有少量羟基自由基(·OH)产生,·OH不是主要的活性氧物质。图6b显示,ABDA紫外吸收随时间延长呈现明显下降趋势,说明光照下In2S3-ZnIn2S4复合纳米结构持续产生单线态氧(1O2)将ABDA氧化,证明1O2为主要产物。

图6 在In2S3-ZnIn2S4处理下不同时间光谱图((a)TA的荧光光谱;(b)ABDA溶液的UV-Vis吸收光谱(100mW/cm2的氙灯照射))
2.5 In2S3-ZnIn2S4抗菌性能
基于所制备的In2S3-ZnIn2S4复合纳米结构良好的光照产生ROS性能,我们展开了光动力抗菌检测。如图7a,b所示,对于革兰氏阴性菌大肠杆菌在没有光照下In2S3、ZnIn2S4和In2S3-ZnIn2S4都不能有效抑制大肠杆菌的生长,在100mW/cm2的氙灯照射10min后,单独In2S3或ZnIn2S4能抑制大肠杆菌生长,但不能将其有效消灭。In2S3-ZnIn2S4复合纳米结构能够完全抑制大肠杆菌的生长,将大肠杆菌有效消灭;对于革兰氏阳性菌金黄葡萄球菌,得到与大肠杆菌相类似的抗菌结果(图7b,c)。

图7 抗菌性能测试(在没有和有氙灯照射下用In2S3、ZnIn2S4和In2S3-ZnIn2S4处理后(a)大肠杆菌菌落的照片;(b)孵育后的大肠杆菌相对活力;(c)金黄色葡萄球菌菌落的照片;(d)孵育后的金黄色葡萄球菌相对活力(通过Image J菌落计数法统计细菌数量;In2S3、ZnIn2S4和In2S3-ZnIn2S4的浓度为150μg/mL,100mW/cm2的氙灯照射10min))
接下来我们进一步探究In2S3-ZnIn2S4复合纳米结构的有效杀菌浓度(MBC),设置系列浓度梯度的In2S3-ZnIn2S4复合纳米结构与细菌共孵育24h后加100mW/cm2的氙灯照射10min,并用稀释涂布平板法统计各组细菌生长情况,用Image J统计各组细菌数量,进而得出最小杀菌浓度。如图8所示,In2S3-ZnIn2S4复合纳米结构在100mW/cm2的氙灯照射下(10min)对于大肠杆菌和金黄葡萄球菌最小杀菌浓度均在200μg/mL。
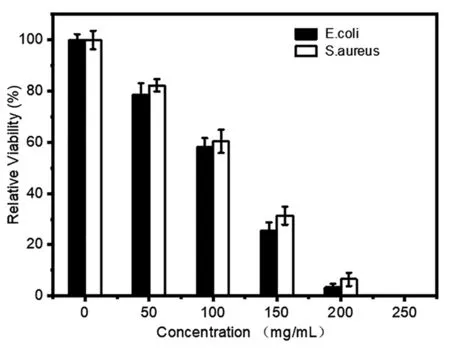
图8 In2S3-ZnIn2S4复合纳米材料对大肠杆菌和金黄葡萄球菌最小杀菌浓度测试Fig.8 Minimum bactericidal concentration test of In2S3-ZnIn2S4 composite nanomaterials against E.coli and S.aureus
3 结论
本文利用高活性的AA-[Zn(OH)4]2-纳米球作为模板,通过水热法制备了花状结构的In2S3-ZnIn2S4复合纳米球。体外的MB降解实验显示与单一的In2S3和ZnIn2S4结构相比,In2S3-ZnIn2S4复合结构的带隙更窄,能够产生更有效的电荷-空穴分离,在可见光照射下产生活性氧能力更强。单线态氧探针ABDA检测出该复合结构产生的活性氧种类为1O2。体外光动力抗菌结果显示,在100mW/cm2的氙灯照射10min后,In2S3-ZnIn2S4复合纳米结构能完全抑制革兰氏阴性大肠杆菌和革兰氏阳性金黄葡萄球菌的生长,最小杀菌浓度均在200μg/mL,是一种优异的光动力抗菌材料。
