油酸囊泡尺度多分散性及二元醇对其pH窗口的影响
2021-08-16范梦琦潘红阳夏咏梅
樊 晔,范梦琦,方 云,李 磊,潘红阳,夏咏梅
(1.江南大学化学与材料工程学院,合成与生物胶体教育部重点实验室,2.食品科学与技术国家重点实验室,无锡 214122)
脂肪酸囊泡(FAV)独特的中空[1]和脂质双层结构[2,3]可有效包载各种酶、药物或其它大分子,在药物载体[4]、史前细胞膜模型[5,6]、微反应器[7]及制备纳米粒子[8,9]等方面具有重要应用前景,但FAV仅在其砌块脂肪酸的表观pKa附近很窄的pH范围内稳定[5,10],使理论研究和应用均受到限制.研究发现脂肪醇类会拓宽FAV形成的碱性pH窗口[11~16],而含多羟基的烷基糖苷则会拓宽FAV的酸性pH窗口[17].同属含羟基的长链极性物同样借助疏水插入,但拓宽pH窗口的效果却不相同,这一现象引起研究者对介于两者之间的二元醇的兴趣.现已有多官能团小分子[18,19]对pH窗口影响的报道,如油酸和二乙烯三胺的混合体系在pH=8.0~11.5间均存在囊泡相[20],表明拓宽其碱性pH窗口,但尚未见二元醇影响脂肪酸囊泡化的研究.油酸(OA)是一种天然不饱和脂肪酸,成本低廉、生物相容性好.1973年,Gebicki和Hicks[21]首次报道了OA囊泡的形成,其形成FAV的pH范围为8.2~10.0[22],目前OA囊泡是研究最多的一类FAV,由于表征手段的局限,通常认为其多形成微米级的多层巨囊泡[20~22].因此,本文以OA为模型脂肪酸,利用多种尺度的形貌表征方法表征OA囊泡的尺度多分散性,并考察了系列短链二元醇对其形成FAV的pH窗口的影响,以期探究二元醇的碳桥长度与FAV的pH窗口间的构效关系.
1 实验部分
1.1 试剂与仪器
油酸(A.R.级),上海阿拉丁生化科技股份有限公司;乙二醇(A.R.级),上海泰坦科技股份有限公司;1,3-丙二醇(纯度98%),上海麦克林生化科技有限公司;1,4-丁二醇(A.R.级)和1,2-己二醇(纯度99.3%),国药集团化学试剂有限公司;1,6-己二醇(纯度98%)和甘油(A.R.级),北京伊诺凯科技有限公司;其它试剂均为分析纯,国药集团化学试剂有限公司;超纯水(电阻率18.2 MΩ·cm)利用美国Millipore Synergy UV超纯水系统自制.
VHX-1000C型超景深三维显微镜,Keyence(香港)有限公司;TSC-SP8型激光共聚焦显微镜(CLSM),德国Leica公司;EM ACE900型冷冻断裂设备,德国Leica公司;JEM-2100型透射电子显微镜(TEM),日本JEOL株式会社;PHS-3C型数显酸度计,上海宇隆仪器有限公司;DDSJ-308A型电导率仪,上海仪电科学仪器股份有限公司;SHZ-B型水浴恒温振荡器,上海博迅医疗生物仪器股份有限公司.
1.2 FAV的pH窗口确定
参考文献[23]的方法测定二元醇-OA碱性水溶液的pH滴定曲线.用0.1 mol/L的NaOH溶液配制二元醇-OA储备液200 mL,其中OA浓度为5 mmol/L,二元醇与OA的摩尔比在0.1~1.0间变化.将储备液按每份7 mL进行等分,每份置于样品瓶中,向其中加入不同体积的0.1 mol/L的HCl溶液,并用超纯水补充至8 mL,混匀后在室温下静置24 h后精确测定各样品溶液的pH值和电导率(k),绘制pH曲线和电导率曲线.依据目测激光丁达尔现象在pH滴定曲线上划分相区,确定形成FAV的pH窗口,并用电导率曲线验证.而确定参照物OA(5 mmol/L)的pH窗口时仅依据目测激光丁达尔现象和pH滴定曲线.
1.3 FAV的制备及超景深三维显微镜表征
用0.1 mol/L的NaOH溶解OA,配制5 mmol/L的OA溶液50 mL,以微量HCl调节体系pH值为8.7,混匀后在室温下静置自组装24 h制备OA囊泡.二元醇-OA囊泡的制备方法与之类似,其中OA浓度为5 mmol/L,二元醇与OA的摩尔比在0.1~1.0间变化.取5μL上述FAV溶液滴于载玻片上,用超景深三维显微镜观察FAV的形貌及粒径.
1.4 荧光染色法激光共聚焦显微镜的表征
将16μL 0.1%尼罗红溶液或罗丹明B溶液加入到上述8 mL的OA囊泡溶液(pH=8.7)中,静置24 h对FAV染色.将罗丹明B染色的FAV溶液装入透析袋(截留分子量3500)中,置于200 mL pH=8.7的水溶液中,于37℃和80 r/min恒温培养振荡器中透析2 h.取8μL染色FAV溶液滴于载玻片上,封片处理后将载玻片倒置放在样品台上,用CLSM观察FAV的形貌及粒径.
1.5 冷冻刻蚀-透射电子显微镜的表征
将上述pH=8.7的OA囊泡溶液用液氮瞬间冷冻,并迅速转移至-150℃下冷冻断裂设备内进行低温高真空劈裂和制备喷镀复型膜,Pt/C沉积角度为45°,碳沉积角度为90°.将复型膜转移到碳支持膜(T10023,北京新兴百瑞有限公司)上,并在加速电压200 kV下用冷冻刻蚀-透射电子显微镜(FFTEM)观察FAV的形貌及粒径.
2 结果与讨论
2.1 油酸囊泡的pH窗口确定
图1中OA的pKa值约为9.2,当pH>10.1时,OA溶液澄清透明,代表胶束相形成.pH在pKa附近时,体系呈现强烈的乳光且具有明显的丁达尔现象,推断其进入囊泡相[23~25].pH<8.2时,体系呈乳液状态并逐渐过渡到有油相析出,推断形成OA囊泡的pH范围为8.2~10.1,这与文献[22]的报道基本一致.
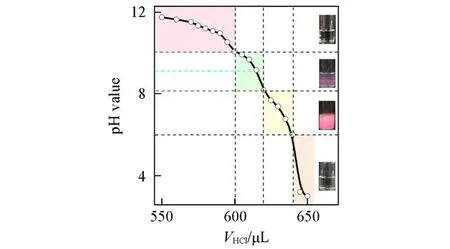
Fig.1 pH titration curve of the alkaline solution of oleic acid(5 mmol/L)and observation of Tyndall effects corresponding to different phase regions(inset)
2.2 油酸囊泡尺度多分散性的表征
采用多种尺度的形貌表征手段表征了OA囊泡的形貌和尺度.从图2(A)的OA囊泡的光学显微照片可以观察到5μm左右的中空球体,初步推断为OA囊泡,并得到CLSM影像的佐证:图2(B)和(C)为油溶性尼罗红[26]染色后样品的CLSM明场和暗场照片,均能够观察到与图2(A)相似的、清晰的中空结构,这是由于尼罗红被增溶在FAV的疏水壳层中.图2(D)和(E)为水溶性罗丹明B[27]染色后样品的CLSM明场和暗场照片,均观察到实心球状结构,这是由于罗丹明B被包埋在FAV的内腔中.图2(B)和(D)中其它亮度不同的红色小点可能是不在CLSM分辨率范围内的更小的囊泡.图3中FF-TEM表征发现,体系中微米[图3(A)和(B)]、亚微米[图3(C)和(D)]和纳米[图3(E)和(F)]尺度的FAV共存,其中微米和亚微米级尺度的OA囊泡为多层囊泡[图3(A)~(C)],根据1个典型囊泡估计其壁厚为11.5 nm[图3(D)],远大于文献[25]报道的OA单层囊泡的壁厚(3.6±0.8)nm;而图3(E)和(F)中粒径约为90 nm的纳米尺度OA囊泡更接近单层囊泡.上述结果表明,OA囊泡呈现从几十纳米至数微米的尺度多分散性,而且其粒径比我们[28]前期研究的共轭亚油酸囊泡大,符合脂肪酸饱和度越高,形成的FAV粒径越大的规律[29].

Fig.2 Optical micrograph(A)and confocal laser microscope(CLSM)images of oleic acid vesicles in bright(B)and dark(C)field stained with Nile Red,bright(D)and dark(E)field stained with Rhodamine B

Fig.3 FF-TEMimages of oleic acid vesicles(pH=8.7)
2.3 二元醇对FAV的pH窗口的影响
由图4可见,乙二醇-OA混合体系的外观随着pH降低遵从透明-乳光-浑浊-油滴的变化规律[21,22],对应于胶束-囊泡-乳液-分相的相区递进.囊泡相具有明显的丁达尔现象且电导率曲线的谷底对应于囊泡相,因此结合三者判断二元混合体系形成FAV的pH窗口,结果列于表1.
通过超景深三维显微镜验证了pH窗口两端FAV的存在(图5).不同乙二醇添加量的FAV的pH窗口均在8.0~11.7左右,图5(A)表明其pH窗口两端均存在(5±2)μm的FAV.而OA自身的囊泡化pH范围为8.2~10.1,说明乙二醇的加入能够使囊泡化pH窗口明显向碱性拓宽,图5(B)~(F)证实加入其它二元醇后OA在各自相应的pH窗口两端处均存在FAV.

Fig.4 pH titration curves,conductometric curves and observation of Tyndall effects of diol-OA(molar ratio 0.1∶1.0)aqueous solutions composed of ethylene glycol(A),1,3-propanediol(B),1,4-butanediol(C),1,6-hexanediol(D),1,2-hexanediol(E)and glycerol(F)
表1结果表明,加入二元醇总体上使FAV的pH窗口有所拓宽,但未观察到改变二元醇加入量的明确效应.二元醇使FAV更稳定的原因可能为:(1)二元醇插入多层囊泡的层间分别与相邻双分子层的内外叶发生氢键作用将有利于FAV稳定;(2)pH窗口的拓宽方向将由二元醇的羟基在FAV表面的作用方式决定,可能的作用机制如Scheme 1所示.表1中乙二醇、1,3-丙二醇和1,4-丁二醇影响FAV的pH窗口平均在8.0~11.5,即碱性窗口从10.1拓宽到11.5,表明三者与OA分子的作用机理基本一致,这可能是由于它们分子中的碳桥较短,但自由度较大,2个羟基与FAV表面的羧基通过双位点氢键结合后没有自由羟基,虽然这几乎不能增强酸性pH窗口一侧囊泡表面的微极性,因此酸性pH窗口拓宽不明显,但是在碱性pH窗口一侧通过屏蔽OA的羧酸根间的静电斥力,使OA分子所占界面面积减小且堆积参数P增大,从而拓宽碱性pH窗口.表1中2种己二醇和甘油均使FAV的酸性pH窗口从8.2拓宽到7.6左右,但对碱性pH窗口的影响则不尽相同,除了1,6-己二醇能使其略微拓宽到10.5左右外,其它两种均无作用.可能的影响机制也示于Scheme 1:(1)1,6-己二醇采取Bola型的疏水插入方式在酸性pH窗口发挥了类似APG[17]的作用,2个自由羟基增加了囊泡表面环境的亲水性,从而稍微拓宽酸性pH窗口;而在碱性pH窗口其间隔的二元羟基排布在表面上发挥了类似长链脂肪醇[13]的作用,屏蔽了OA的羧酸根间的静电斥力,使其所占界面面积减小且P参数增大,故稍微拓宽碱性pH窗口,导致了pH窗口双向拓宽的效果;(2)1,2-己二醇的疏水插入方式无论在酸性或碱性pH窗口均发挥了类似APG[17]的作用,因此只能拓宽酸性pH窗口,且疏水插入后囊泡表面的自由羟基比APG少,故无论是酸性pH窗口拓宽还是碱性pH窗口收缩均不如APG明显;(3)由于甘油的空间密集的三羟基构造使其可能也像短链二元醇一样与囊泡表面发生双位点氢键结合或单位点氢键结合,残留的自由羟基的作用更接近于1,2-己二醇,因此只能略微拓宽酸性pH窗口.

Scheme 1 Schematic illustration of the mechanism for FAV formation of diol-OA vesicles

Table 1 pH window for FAV formation of diol-OA mixed systems

Fig.5 Optical micrographs of diol-OA(molar ratio 0.1∶1.0)vesicles on the acidic(A—F)and the alkaline(A′—F′)pH window composed of ethylene glycol(A,A′),1,3-propanediol(B,B′),1,4-butanediol(C,C′),1,6-hexanediol(D,D′),1,2-hexanediol(E,E′)and glycerol(F,F′)pH:(A)8.1;(A′)11.6;(B)8.0;(B′)11.4;(C)7.9;(C′)11.6;(D)7.6;(D′)10.7;(E)7.7;(E′)9.8;(F)7.5;(F′)10.2.
3 结 论
依据目测激光丁达尔现象在pH滴定曲线上划分相区,确定OA囊泡形成的pH范围为8.2~10.1.用光学显微镜、CLSM并结合FF-TEM证明了pH=8.7的OA溶液中微米、亚微米和纳米尺度的囊泡共存,且微米和亚微米级FAV为多层囊泡,纳米级FAV为单层囊泡,呈现尺度多分散性特征.依据目测激光丁达尔现象在pH曲线上划分相区,确定二元醇-OA囊泡的pH窗口,并由电导率曲线验证,探究了短链二元醇的碳桥长度与FAV的pH窗口拓宽之间的构效关系,结果表明,乙二醇、1,3-丙二醇及1,4-丁二醇均只能拓宽FAV的碱性pH窗口,碳桥增长的1,6-己二醇使FAV的pH窗口向两端拓宽,而羟基位置及数目不同的1,2-己二醇和甘油均只能拓宽FAV的酸性pH窗口.因此,短链二元醇总体而言有助于FAV的pH窗口拓宽,而拓宽的方向取决于二元醇与OA囊泡的表面氢键作用方式或疏水插入方式,以及作用后二元醇在FAV表面残留的自由羟基数.在酸性条件下FAV表面残留的羟基多有助于拓宽酸性pH窗口.在碱性条件下表面残留的羟基若能有效屏蔽OA离子间的静电斥力,则有助于拓宽碱性pH窗口.因此,二元醇碳桥长度对OA囊泡化pH窗口的表观影响,本质上由两者间的相互作用方式决定.本文为选择可调控FAV的pH窗口的二元醇提供了理论依据,也为开发FAV作为缓释载体提供了参考.
