N-草酰基-D-苯丙氨酸对小鼠造血系统辐射损伤的防护作用
2021-08-16唐海孟媛媛孟鑫龙伟周晓靓徐文清
唐海 康 孟媛媛 孟鑫 龙伟 周晓靓 徐文清
中国医学科学院北京协和医学院放射医学研究所,天津市放射医学与分子核医学重点实验室 300192
造血系统包括造血细胞、造血微环境(又称为造血干细胞龛)和造血刺激因子,其对电离辐射非常敏感。电离辐射主要破坏或抑制造血细胞的增殖能力,而骨髓抑制是造血系统辐射损伤的主要表现。造血干细胞(hematopoietic stem cell,HSC)具有自我更新、增殖和分化生成全血细胞的功能,其受损伤后将引起骨髓持久性抑制,甚至造成个体死亡[1]。大量研究结果表明,HSC 储存在造血干细胞龛中[2]。哺乳动物HSC 在骨髓乏氧区骨内膜龛中保持静止状态[3]。正常HSC 能够保持细胞内低氧浓度并稳定表达低氧诱导因子(hypoxia-inducible factor,HIF)。在缺少HIF-1α 的小鼠中,HSC 退出细胞循环的静止期,在骨髓移植、骨髓抑制等情况下HSC数量明显降低[4-5]。提高HIF-1α 的表达水平,可以提高HSC 的归巢和移植再生能力[6-7]。
HIF 是一种在低氧浓度下被激活的转录因子,由α 亚基和β 亚基构成。HIF-1α 的转录活性受环境氧浓度的调节。低氧诱导因子抑制因子(factor inhibiting hypoxia-inducible factor,FIH)又名天冬酰胺酰羟化酶,是体内调节HIF-1α 转录活性的主要因子。在正常氧浓度下,FIH 通过使HIF-1α 的C 末端反式激活结构域内第803 位的天冬氨酸残基羟基化,阻止HIF-1α 与转录辅助激活因子CBP/P300 结合,从而抑制HIF-1α 的转录激活;在低氧浓度下,FIH的活性降低,激活HIF-1α 的转录活性,启动低氧应激调控网络[4-6]。研究结果表明,提高HIF-1α 蛋白的稳定性,可以缓解辐射引起的造血系统损伤和胃肠功能障碍,减轻放射性胃肠损伤[5,8-9]。
N-草酰基-D-苯丙氨酸(N-oxalyl-D-phenylalanine,NOFD)是FIH 的特异性抑制剂[10],能提高HIF-1α的转录活性。我们的前期研究结果表明,NOFD能够降低辐射后人结肠癌细胞(HCT116)和仓鼠卵巢细胞(CHO-K1)的细胞内活性氧(reactive oxygen species,ROS)水平,减轻辐射引起的DNA 损伤和细胞凋亡;NOFD 能够促进HCT116 细胞中HIF-1α调控的下游基因的表达,包括促红细胞生成素(EPO)、血红素氧合酶1(HO-1)、葡萄糖转运蛋白1(Glut-1)、血管内皮生长因子(VEGF)、Notch2 和Notch1;体内实验结果表明,以5 mg/kg 的剂量腹腔给予NOFD,可以明显提高辐射损伤小鼠的存活率[11]。本研究旨在系统评价NOFD 对小鼠造血系统辐射损伤的防护作用,以期为FIH 抑制剂作为新型辐射防护药的研发提供实验依据。
1 材料与方法
1.1 仪器与试剂
抗小鼠Sca-1-PE、CD117(c-kit)APC、CD3-APC 抗体购自美国eBioscience 公司;Streptavidin-PerCP 抗 体,抗 小 鼠 CD11b-PerCP、Gr1-PerCP、B220-PE、Ter119 抗体,抗小鼠B220、Gr1、CD11b、CD4、CD8、CD11b 抗体均购自美国Biolegend 公司;荧光染料MitoSOX(10 μmol/L)购自美国Life Technologies 公 司;FACSTM裂 解 溶 液、anti-γ-H2AX 抗体(γ-H2AX 为磷酸化组蛋白H2AX)购自美国BD 公司;乙二胺四乙酸二钾(EDTA)购自美国Sigma 公司。NOFD 由中国医学科学院北京协和医学院放射医学研究所辐射防护与药物室合成。
Gammacell®40 Exactor137Cs γ 射线照射源购自加拿大Best Theratronics 公司,剂量率为0.99 Gy/min;MEK-7222K 全自动血液分析仪购自日本光电工业株式会社;Accuri C6 流式细胞仪购自美国BD公司。
1.2 实验动物、分组及处理方法
18 只C57BL/6 雄性小鼠,体重20~22 g,6~8周龄,由北京维通利华实验动物中心提供[许可证号为SCXK(京)2016-0011],饲养在中国医学科学院北京协和医学院放射医学研究所动物中心,在标准条件[温度(22±2)℃,12 h 光明、12 h 黑暗交替,湿度(50±10)%]下自由饮用无菌水和进食无特定病原体级鼠繁殖饲料。动物实验开展前获得了中国医学科学院北京协和医学院放射医学研究所动物伦理委员会的批准(批准号:IRM-DWLL-2017109)。所有小鼠饲养1 周适应环境后,按照区组随机法分为3 组:对照组、4 Gy γ 射线全身照射组(简称照射组)和4 Gy γ 射线全身照射+ 5 mg/kg NOFD 组(简称照射给药组),每组6 只。照射给药组于照射前2、16 h 及照射后3 d 分别腹腔给予5 mg/kg NOFD,对照组和照射组给予等量生理盐水,给药时间和次数与照射给药组相同。
1.3 外周血血细胞和骨髓有核细胞(bone marrow nucleated cell,BMNC)的计数
照射后第9 天脱颈处死小鼠,采集外周血和双侧股骨。股骨用PBS 冲洗并收集骨髓细胞,分别置于事先加入乙二胺四乙酸二钾溶液作抗凝处理的1.5 mL 离心管中,经全自动血液分析仪测定并计数小鼠外周血血细胞和BMNC。
1.4 外周血中的B 细胞、T 细胞和髓系细胞的百分比分析
取0.5 mL 外周血加入乙二胺四乙酸二钾抗凝剂后,在室温下用B220、CD3-APC、Gr1、CD11b的混合液孵育30 min。用FACSTM裂解溶液除去红细胞。用流式细胞仪检测并计数B 细胞、T 细胞和髓系细胞,并应用Accuri C6 软件对数据进行采集和分析。
1.5 造 血 祖 细 胞(hematopoietic progenitor cell,HPC)(Lineage- Sca1- c-kit+)和HSC(Lineage-Sca1+ c-kit+)的分析及测定
用PBS 将小鼠骨髓中的骨髓细胞冲出,过滤并计数后将5×106个骨髓细胞与CD11b-PerCP、Gr1-PerCP、B220-PE、Ter119、CD4、CD8 抗体的混合液孵育30 min,用PBS 清洗1 次后弃上清,加入Sca-1-PE、CD117(c-kit)APC、Streptavidin-PerCP与PBS 的混合液4 μL,室温避光染色20 min,加入1 mL 含2%胎牛血清的PBS,1000 r/min 离心(离心半径35 cm)5 min 后弃上清,加入300 μL PBS 重悬细胞,用流式细胞仪计数HPC 和HSC,并应用美国BD 公司Accuri C6 软件对数据进行采集和分析。
1.6 骨髓细胞线粒体ROS 水平的分析
将骨髓细胞与0.5 μmol/L MitoSOX 在37℃水浴中孵育10 min 后,用流式细胞仪分析各组细胞内线粒体ROS 自由基(MitoSOX)的平均荧光强度(median fluorescence intensity,MFI), 并应用Accuri C6 软件对数据进行采集和分析。
1.7 骨髓细胞DNA 损伤程度的分析
在室温下用anti-γ-H2AX 抗体对骨髓细胞进行染色孵育1 h,用流式细胞仪分析各组细胞的γ-H2AX MFI, 并应用Accuri C6 软件对数据进行采集和分析。
1.8 粒细胞-巨噬细胞集落形成单位(colonyforming units-granulocyte-macrophage, CFUGM)实验
分离小鼠骨髓细胞,取对照组1×104个细胞,照射组、照射给药组5×104个细胞于M3534 培养基中培养5 d 后进行集落形成单位分析,以细胞数≥30 个为阳性集落进行计数。
1.9 脾集落形成单位(colony-forming units-spleen,CFU-S)实验
照射后第9 天脱颈处死小鼠并取脾脏,用Bouin 液(饱和苦味酸溶液15 mL、甲醛5 mL、冰醋酸1 mL,混匀即得)固定24 h 后,取肉眼可见的集落进行计数。
1.10 统计学分析
应用GraphPad prism 8 软件进行统计学分析。符合正态分布的数据以±s表示;在方差齐的条件下,组间两两比较采用Studentt检验。P<0.05 为差异有统计学意义。
2 结果
2.1 NOFD 对辐射损伤小鼠外周血各项指标的影响
由图1 可见,与对照组相比,照射组小鼠外周血中WBC、血小板和RBC 数量均明显减少,且差异均有统计学意义(均P<0.05);与照射组相比,照射给药组小鼠外周血中血小板[(234.7±15.81)×106个/mL 对(315.5±32.57)×106个/mL]和RBC 数量 [(9.05±0.16)×109个/mL 对(9.57±0.15)×109个/mL] 明显增加,且差异均有统计学意义(均P<0.05);与对照组相比,照射组小鼠淋巴细胞、T 细胞和B 细胞的百分比均明显下降,中性粒细胞和髓系细胞的百分比均明显上升,且差异均有统计学意义(均P<0.05);与照射组相比,照射给药组小鼠T 细胞的百分比[(11.54±0.20)%对(15.31±1.88)%]明显升高,髓系细胞的百分比[(32.67±2.87)%对(24.90±2.19)%]明显降低,且差异均有统计学意义(均P<0.05)。以上结果表明,NOFD改善了小鼠辐射所致的髓系-淋巴系分化失衡,并使外周血细胞的数量得到部分恢复。
2.2 NOFD 对辐射损伤小鼠骨髓细胞的影响
由图2 可见,与对照组相比,照射组小鼠的BMNC 数量、HPC 数量及百分比、HSC 数量及百分比均明显降低,且差异均有统计学意义(均P<0.05);与照射组相比,照射给药组小鼠的HSC 数量 及 百 分 比[(2.24±0.54)×103个/股 骨 对(6.77±1.67)×103个/股骨;(0.09±0.02)%对(0.59±0.13)%]、HPC 百分比[(0.62±0.14)%对(1.82±0.43)%]均明显升高,且差异均有统计学意义(均P<0.05)。以上结果表明,NOFD 能够缓解电离辐射对小鼠骨髓中HSC 和HPC 的损伤,提高HSC 的数量,使HSC和HPC 在骨髓细胞中的百分比得到恢复,维持照射后造血系统的平衡。
2.3 NOFD 对辐射损伤小鼠骨髓细胞中线粒体ROS水平的影响
由图3 可见,与对照组相比,照射组小鼠的BMNC、HPC 中线粒体ROS 自由基(MitoSOX)的MFI 明显升高,且差异均有统计学意义(均P<0.05);与照射组相比,照射给药组小鼠的BMNC 和HPC 中线粒体ROS 自由基(MitoSOX)的MFI 明显降低[(6.66±0.56)×103对(3.19±0.25)×103;(2.51±0.46)×103对(1.20±0.35)×103],且差异均有统计学意义(均P<0.05)。以上结果表明,NOFD能清除骨髓细胞中线粒体的ROS,减轻辐射所致的损伤。

图 2 N-草酰基-D-苯丙氨酸对辐射损伤小鼠骨髓细胞的影响 a 表示与对照组比较,差异均有统计学意义(t=4.503~8.770,均P<0.05);b 表示与照射组比较,差异均有统计学意义(t= 2.683、2.581、3.633,均P<0.05)。对照组为未照射且不给药;照射组为4 Gy γ 射线全身照射;照射给药组为4 Gy γ 射线全身照射+ 5 mg/kg N-草酰基-D-苯丙氨酸。BMNC 为骨髓有核细胞;HSC 为造血干细胞;HPC 为造血祖细胞Figure 2 Effects of N-oxalyl-D-phenylalanine on bone marrow cells in irradiated mice
2.4 NOFD 对辐射损伤小鼠骨髓细胞中DNA 损伤的影响
由图4 可见,与对照组相比,照射组小鼠的BMNC、HPC 和HSC 中γ-H2AX 的MFI 明显增加,且差异均有统计学意义(均P<0.05),这表明4 Gy的电离辐射对小鼠骨髓细胞DNA 的损伤较为严重;与照射组相比,照射给药组小鼠的BMNC、HPC 和HSC 中γ-H2AX 的MFI 明显降低[(10.25±0.77)×103对(7.22±0.15)×103;(18.37±2.52)×103对(12.44±0.34)×103;(26.05±2.64)×103对(17.16±1.20)×103],且差异均有统计学意义(均P<0.05)。以上结果表明,NOFD 可以减轻辐射损伤小鼠骨髓细胞中DNA 的双链断裂。
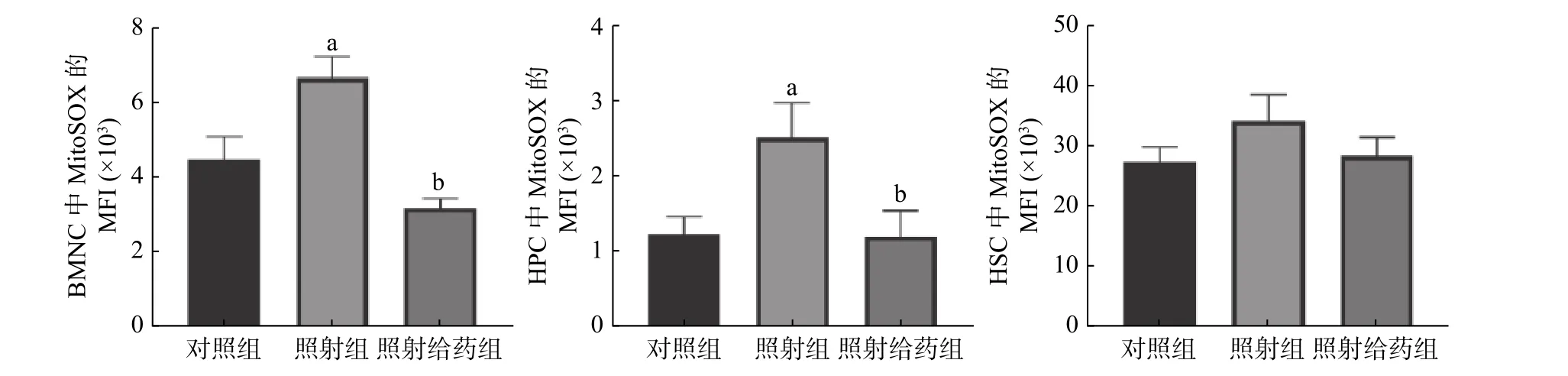
图 3 N-草酰基-D-苯丙氨酸对辐射损伤小鼠骨髓细胞中线粒体活性氧水平的影响 a 表示与对照组比较,差异均有统计学意义(t=2.538、2.331,均 P<0.05);b 表示与照射组比较,差异均有统计学意义(t=6.350、2.282,均 P<0.05)。对照组为未照射且不给药;照射组为4 Gy γ 射线全身照射;照射给药组为4 Gy γ 射线全身照射+ 5 mg/kg N-草酰基-D-苯丙氨酸。BMNC 为骨髓有核细胞;MitoSOX 为一种荧光染料;MFI 为平均荧光强度;HPC 为造血祖细胞;HSC 为造血干细胞Figure 3 Effects of N-oxalyl-D-phenylalanine on the level of mitochondrial reactive oxygen species in bone marrow cells of irradiated mice

图 4 N-草酰基-D-苯丙氨酸对辐射损伤小鼠骨髓细胞DNA 损伤的影响 a 表示与对照组比较,差异均有统计学意义(t=5.964、4.029、3.465,均 P<0.05);b 表示与照射组比较,差异均有统计学意义(t=4.356、2.577、3.070,均 P<0.05)。对照组为未照射且不给药;照射组为4 Gy γ 射线全身照射;照射给药组为4 Gy γ 射线全身照射+ 5 mg/kg N-草酰基-D-苯丙氨酸。BMNC 为骨髓有核细胞;γ-H2AX 为磷酸化组蛋白H2AX;MFI:平均荧光强度;HPC 为造血祖细胞;HSC 为造血干细胞Figure 4 Effects of N-oxalyl-D-phenylalanine on DNA damage of bone marrow cells in irradiated mice
2.5 NOFD 对辐射损伤小鼠骨髓细胞增殖能力的影响
由图5 可见,与对照组相比,照射组小鼠的骨髓细胞的CFU-GM 明显减少,且差异有统计学意义(P<0.05),这表明4 Gy 照射能明显降低骨髓细胞的增殖能力;与照射组相比,照射给药组小鼠骨髓细胞的CFU-GM 明显增多(12.33±1.48 对24.00±3.92),且差异有统计学意义(P<0.05)。与对照组相比,照射组小鼠的骨髓细胞的CFU-S 增加,且差异有统计学意义(P<0.05);与照射组相比,照射给药组小鼠CFU-S 明显增加(6.00±1.07 对10.83±1.01),且差异有统计学意义(P<0.05)。以上结果表明,NOFD 可增强辐射损伤小鼠骨髓细胞的增殖能力。

图 5 N-草酰基-D-苯丙氨酸对辐射损伤小鼠骨髓细胞的CFU-GM 和CFU-S 的影响 a 表示与对照组比较,差异均有统计学意义(t=4.193、2.350,均 P<0.05);b 表示与照射组比较,差异均有统计学意义(t=2.788、3.288,均 P<0.05)。对照组为未照射且不给药;照射组为4 Gy γ 射线全身照射;照射给药组为4 Gy γ 射线全身照射+ 5 mg/kg N-草酰基-D-苯丙氨酸。CFU-GM 为粒细胞-巨噬细胞集落形成单位;CFU-S 为脾集落形成单位Figure 5 Effects of N-oxalyl-D-phenylalanine on colonyforming units-granulocyte-macrophage and colony-forming unitsspleen in irradiated mice
3 讨论
随着我国核能应用的不断发展,放射性同位素和射线检测技术的广泛应用,以及核恐怖威胁的持续存在,人们暴露在辐射下的风险不断升高。中高剂量照射引起的骨髓抑制成为辐射致死的主要原因。在肿瘤的临床治疗中,放疗的不良反应之一即为引起骨髓抑制,进而影响患者的治疗效果和生活质量。因此,临床上迫切需要使用辐射防护剂,特别是辐射损伤后的治疗药物,以提高患者辐射损伤的治疗效果,满足辐射损伤人群救治的需要。
HIF 是由Semenza[12]发现的一类氧敏感性异二聚体蛋白,其对机体在低氧浓度下发生的一系列生理学改变起着关键性的调控作用。研究结果显示,在组织贫(缺)血和炎症疾病中,HIF 蛋白的稳定表达对缓解病情具有重要作用[13]。对辐射损伤的研究结果显示,通过稳定HIF-1α 可以改善辐射造成的造血系统损伤[2]和胃肠功能障碍[8]。
研究结果显示,电离辐射可导致造血系统损伤[14-15],HSC 和HPC 的再生和分化能力受到影响,引起造血细胞数量减少及其在骨髓细胞中的百分比降低,导致外周血中髓系-淋巴系分化的失衡[16],表现为外周血细胞及淋巴细胞减少,髓系细胞增多。电离辐射还能够直接导致DNA 损伤或介导ROS 间接损伤DNA,γ-H2AX 是评估DNA 双链断裂损伤的一种重要标志物。细胞在受到照射后,ROS 水平会显著升高[17]。受到辐射损伤的线粒体的通透性会发生改变,并将这一损伤通过Ca2+传递给邻近的线粒体,导致线粒体内ROS 水平升高[18],因此,线粒体内ROS 自由基的清除能力是评价辐射防护效果的重要指标。
在本研究中,我们探讨了调控HIF-1α 转录活性的FIH 抑制剂NOFD 在小鼠辐射损伤中的作用,评价其对辐射诱导的造血系统损伤的防护效果。结果显示,NOFD 能缓解辐射损伤小鼠的骨髓抑制,保护HSC 和HPC,刺激HSC 增殖,通过降低骨髓细胞线粒体中ROS 水平来减轻DNA 损伤。
然而,目前关于NOFD 的生物活性及作用机制的研究报道并不多见。我们的研究团队首次发现了NOFD 具有较好的辐射防护作用,其作用机制可能与其促进HIF-1α 的转录活性和HIF 下游基因,如促红细胞生成素(EPO)、血管内皮生长因子(VEGF)等的表达有关[19]。因为重组促红细胞生成素(EPO)被报道具有明显的辐射防护作用[20-22],而血管内皮生长因子(VEGF)可以促进缺氧环境下的血管生成[23]。
FIH 在蛋白-蛋白相互作用过程中能识别多个蛋白底物,FIH 除了调控HIF-1 通路转录活性外,FIH 蛋白底物还可富集至核因子κB、Notch 等信号通路中。FIH 对Notch 有很高的亲和力,可以羟化Notch 的天冬酰胺残基,影响Notch 途径的下游靶基因。HIF-1α 和Notch 信号通路在FIH 处相互联系,敲除FIH 可激活Notch 信号通路。Notch 作为一条高度保守的信号通路,在细胞增殖、分化和凋亡过程中发挥着重要作用[24]。研究结果表明,Notch受体和配体在哺乳动物造血系统中广泛表达[25]。其中,Notch1 和Notch2 在HSC 中高表达,Notch 配体在造血微环境中高表达。Notch 信号通路能够促进HSC 的“干性”维持,其靶基因发状分裂相关增强子在HSC 中高表达[26]。在造血微环境中高表达的Notch 配体与HSC 上的Notch 受体直接接触,激活Notch 信号通路,平衡HSC 的自我更新和分化,避免HSC 耗竭,促进造血重建[27]。我们之前的研究结果也证实了NOFD 能够显著促进Notch mRNA 的表达[11]。因此,NOFD 发挥辐射防护作用的机制可能与其抑制FIH 激活Notch 信号通路有关。
近些年,HIF-1α 与HSC 的辐射损伤、修复之间的关系逐渐引起了研究者的广泛兴趣。研究结果表明,辐射可以导致机体内产生大量ROS,异常增多的ROS 可抑制HSC 的自我更新,诱导HSC衰老,同时又可影响HIF-1α 的转录活性[28-29];而上调HIF-1α 可以降低细胞中的ROS 水平[30]。由此可见,ROS 与HIF-1α 之间可以相互影响。清除照射产生的ROS 一直是辐射损伤防护的重要策略。本研究结果表明,NOFD 能够降低BMNC 和HPC中线粒体ROS 水平,减轻HSC 的DNA 损伤,增强HSC 的增殖能力,调节髓系-淋巴系分化失衡。
综上,本研究结果证实,NOFD 促进了辐射损伤小鼠造血系统的恢复,改善了细胞内的氧化应激,发挥了辐射防护作用。然而,关于NOFD 的作用机制仍有待深入地研究。
利益冲突本研究由署名作者按以下贡献声明独立开展,不涉及任何利益冲突。
作者贡献声明唐海康负责数据的统计、图表的制作、论文的撰写与修改;孟媛媛、孟鑫负责现场的实验;龙伟、周晓靓负责数据的统计与分析;徐文清负责论文的审阅与修改。
