新型米诺环素外用制剂治疗中重度丘疹脓疱型玫瑰痤疮疗效与安全性Meta 分析
2021-08-16熊健霞李成媛钱薇露
熊健霞,王 萍,李成媛,钱薇露,蔡 涛
(重庆医科大学附属第一医院皮肤科,重庆 400016)
玫瑰痤疮是一种好发于面中部的慢性炎性疾病,主要表现为面中部(额部、面颊、鼻部、下颌部)阵发性潮红、持久性红斑、毛细血管扩张,伴或不伴丘疹、脓疱、鼻部皮脂腺增生及眼部病变[1],给患者带来严重的心理负担。玫瑰痤疮分为4 种临床亚型,包括红斑毛细血管扩张型、丘疹脓疱型、鼻部增生型和眼型[2]。其发病机制尚未阐明,普遍认为是在遗传背景的基础上,受到外界刺激(如紫外线、微生物感染、饮食刺激、不规律使用外用药物等)导致神经血管功能失调、先天性及获得性免疫功能紊乱[3]。四环素治疗玫瑰痤疮疗效确切,特别是对丘疹脓疱型玫瑰痤疮(PPR)的治疗效果明显,但系统使用四环素可能会导致肝毒性、狼疮样综合征、药物超敏反应综合征、自身免疫性肝炎、结节性多发性动脉炎、胃肠道不适、皮肤色素沉着等[4],极大地降低了患者的用药依从性。国外研发的米诺环素外用制剂(米诺环素泡沫剂、米诺环素凝胶)治疗中、重度寻常型痤疮疗效显著,已有其治疗中、重度PPR 的临床试验,但缺乏系统、有效的安全性及有效性证据。本研究中对已公开发表的随机对照试验(RCT)进行Meta 分析,以评价其米诺环素外用制剂治疗中、重度PPR 的安全性及有效性。现报道如下。
1 资料与方法
1.1 文献纳入与排除标准
1.1.1 纳入标准
研究类型:国内外公开发表的RCT,无论是否采用盲法均可纳入,语言限定为中文和英文。
研究对象:1)纳入。年龄≥18 岁;符合 2002 年美国国家玫瑰痤疮协会专家委员会制订的玫瑰痤疮诊断标准;面部有15 ~75 个丘疹或脓疱,研究者总体评估(IGA)评分不低于3 分;自愿加入试验,并愿配合完成随访及评估。2)排除。面部存在任何会干扰玫瑰痤疮的诊断或评估的情况和/或面部毛发过多;面部片状水肿性红斑;对米诺环素、其他四环素类药物或制剂中任何成分过敏;合并其他感染性疾病,需系统予以抗菌药物治疗;依从性差,不能按时随访。
干预措施:试验组采用米诺环素外用药物(包括米诺环素凝胶、米诺环素泡沫剂),对照组采用赋形剂,均匀涂于面部,每天1 次,疗程12 周。
结局指标;12 周时面部炎性皮损(丘疹、脓疱)平均减少的数量;治疗成功率,IGA 评分达到0/1 分的患者例数;药品不良反应(ADR)与不良事件的发生情况,包括头痛、呼吸道感染、症状加重、瘙痒等。
1.1.2 排除标准
回顾性研究或非 RCT;非中、重度 PPR 患者;接受了除米诺环素外用制剂以外的治疗;研究数据缺失或无相关结局指标;综述、个案报道或会议摘要;非中英文文献。
1.2 检索策略
计算机检索 PubMed,Clinctrials.gov,The Cochrane Library,Web of Science,Embase,CNKI 数据库。英文检索词为“Rosacea”“Acne Rosacea”“Papulopustular Rosacea”“Minocycline Foam”“FMX 103”“Minocycline Gel”“BPX”;中文检索词为“酒渣鼻”“玫瑰痤疮”“米诺环素泡沫剂”“米诺环素凝胶”“外用米诺环素”。检索时间自建库起至2020 年6 月。
1.3 文献筛选、资料提取与纳入研究偏倚风险评估
由2 位研究者依据预先制订的纳入与排除标准,独立阅读文献题目、摘要,筛选文献,剔除重复发表或明显不合格的文献,对不能肯定的文献,通过进一步阅读全文后评估是否可纳入分析。2 位研究者依据预先制订的特征表,对纳入的文献进行数据提取,包括发表时间、第一作者、样本量、平均年龄、女性占比、干预措施、对照措施和疗程等。由2 位研究者独立完成纳入文献的偏倚风险评估,如遇分歧,通过讨论协商解决。
1.4 统计学处理
采用RevMan 5.3 软件进行分析。连续型变量采用均数差(MD)为效应分析统计量;二分类变量(IGA、不良反应发生率)采用相对危险度(RR)及95%置信区间( CI)估计联合效应大小。采用 χ2检验对纳入研究进行异质性检验,若异质性较低(I2≤50%),则选择固定效应模型分析;反之,则选择随机效应模型。若各研究结果间存在异质性,则采用敏感性分析法寻找异质性来源。P < 0.05 为差异有统计学意义。
2 结果
2.1 文献检索流程与筛选结果
按文献检索策略,最初共检索到相关文献255篇,其中 PubMed 157 篇,Embase 43 篇,The Cochrane Library 27 篇,Clincaltrails.gov 15 篇,Web of Science 5 篇,CNKI 8 篇。逐篇阅读全文,根据文献纳入与排除标准,最终纳入 3 篇[5-7]进行 Meta 分析。文献检索流程及筛选结果见图1。共纳入3 个RCTs,均为前瞻性研究,时间跨度为2018 年至2020 年,涉及多个地区。共纳入2 024 例中、重度PPR 患者。纳入研究的基本特征见表1。

表1 纳入研究的基本特征Tab.1 Basic characteristics of included studies

图1 文献检索流程及筛选结果Fig.1 Flow chart and results of literature screening
2.2 文献质量评价
对纳入的3 项研究进行偏倚风险评估,均采用随机双盲对照研究。文献[7]并未提及明确的随机方法,文献[6]解释了详细的分配隐藏方式;试验过程中均有因ADR退出研究的患者,均采用意向性分析;3 项研究均未提及是否进行选择性结局报道。详见图2。

图2 纳入研究偏倚风险评估Fig.2 Bias risk assessment of included studies
2.3 Meta 分析结果
炎性皮损减少:共纳入 3 项研究[5-7],涉及 2 024 例患者。异质性检验提示异质性较高(P =0.03,I2=71%),故采用随机效应模型分析。米诺环素外用制剂减少炎性皮 损 的 疗 效 显 著 优 于 赋 形 剂 [ MD = 4.78,95% CI(1.44,8.13),P = 0.005]。详见图 3。2 项研究[5-6]对比了高浓度与低浓度米诺环素外用制剂减少炎性皮损的疗效,异质性检验提示组间异质性小(P =0.86,I2=0%),故采用固定效应模型分析。高浓度米诺环素外用制剂减少炎性皮损的效果与低浓度米诺环素外用制剂无显著差异[MD =0.70,95%CI(-2.52,3.91),P =0.67]。详见图4。

图3 米诺环素外用制剂与赋形剂炎性皮损减少Meta 分析森林图Fig.3 Forest plot of Meta - analysis:Effect of minocycline topical preparation and excipient on the reduction of inflammatory lesions

图4 高浓度与低浓度米诺环素外用制剂炎性皮损减少Meta 分析森林图Fig.4 Forest plot of Meta-analysis:Effect of high -concentration and low -concentration minocycline topical preparation on the reduction of inflammatory lesions
IGA 评分:共纳入 3 项研究[5-7],涉及 2 015 例患者。异质性检验提示异质性较小(P =0.14,I2=50% ),故采用固定效应模型分析。米诺环素外用制剂在治疗终点时,患者IGA 评分达到0/1 分的数量显著多于赋形剂[ RR = 1.29,95% CI(1.15,1.45),P < 0.000 1]。详见图 5。2 项[5-6]研究对比了高、低浓度米诺环素外用制剂在治疗终点时IGA 评分达到0/1 分的患者数量,共涉及337 例患者,异质性检验提示异质性小(P =0.56,I2=0%),故采用固定效应模型分析。高、低浓度米诺环素外用制剂治疗12 周时,IGA 评分达到0/1 分的患者数量比较无显著差异[ RR = 1.26,95% CI(0.93,1.71),P = 0.13]。详见图 6。
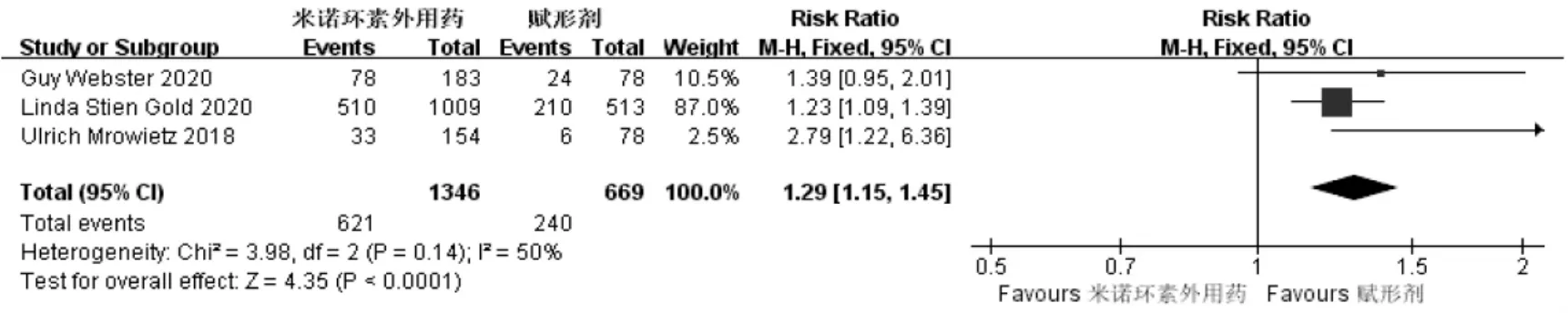
图5 米诺环素外用制剂与赋形剂的IGA 评分达到0 /1 分的患者数量Meta 分析森林图Fig.5 Forest plot of Meta - analysis:Comparison of the number of patients′ IGA score reached 0 or 1 point between minocycline topical preparation and excipient

图6 高浓度米诺环素外用制剂与低浓度米诺环素外用制剂的IGA 评分达到0/1 分的Meta 分析森林图Fig.6 Forest plot of Meta - analysis:Comparison of the number of patients′ IGA score reached 0 or 1 point between high - concentration and low-concentration minocycline topical preparation
不良事件发生情况:3 项研究[5-7]均报道米诺环素与赋形剂的总不良事件发生情况,异质性检验提示各研究间异质性大(P =0.64, I2=58% ),故采用随机效应模型分析;ADR 异质性小(I2< 50% ),故采用固定效应模型。Meta 分析结果显示,米诺环素外用制剂与赋形剂相比,ADR 无显著差异(P >0.05)。高浓度与低浓度米诺环素外用制剂 ADR 发生率无显著差异(P > 0.05)。详见表 2。
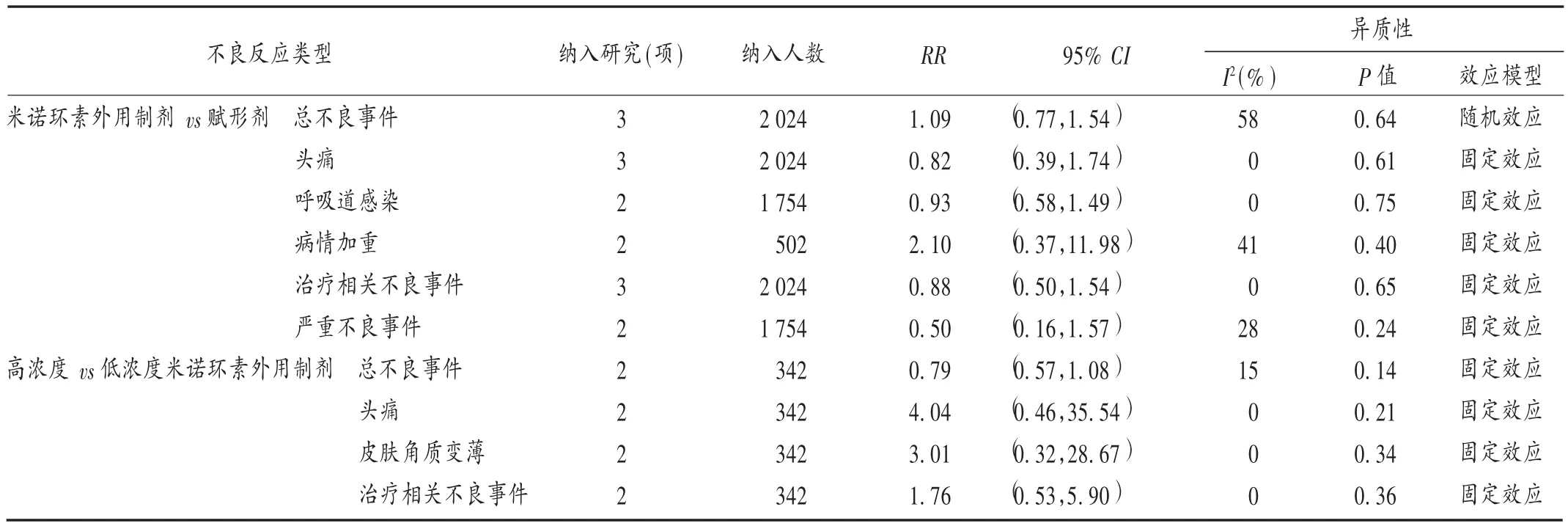
表2 药品不良反应与不良事件的Meta 分析Tab.2 Meta-analysis of adverse drug reactions and adverse drug events
2.4 敏感性分析和发表偏倚分析
炎性皮损减少的异质性检验结果为 I2>50%,异质性较大,通过逐篇排除法进行敏感性分析。发现排除研究[6]后,I2<50%,提示这项研究可能是异质性的来源。予以剔除,采用随机效应模型进行分析,发现合并效应量并不受单项研究的影响,表明结果稳定。依据Cochrane 手册,应当对此次Meta 分析纳入的研究进行发表偏倚评估,本研究中共纳入3 项研究,数量少于10项,未进行发表偏倚评估。
3 讨论
玫瑰痤疮是一种以面中部阵发性潮红或持久性红斑为特征的常见皮肤病。其好发于中青年女性,世界各地报道的患病率为不足1%到超过20%不等[8],全球5.46% 的人群受到影响[9]。2020 年,中国长沙进行了一项基于人群的流行病学调查,患病率为 3.48%[10]。PPR是常见亚型,主要表现为面中部红斑基础上出现炎性丘疹或脓疱,其发病机制尚未完全阐明,但炎性反应是重要组成部分。大量研究证明,微生物在诱导和维持玫瑰痤疮的炎性反应中扮演重要角色[11]。国内外专家共识中已将口服多西环素联合外用抗菌药物作为治疗中、重度 PPR 的一线方案[12-13]。多西环素可通过抑制白细胞趋化、中性粒细胞激活和脱颗粒、诱发炎症的细菌产物及磷脂酶 A2产生等途径发挥治疗作用[14-15],但口服多西环素ADR 大,患者依从性低。目前批准用于治疗玫瑰痤疮的外用抗菌药物有甲硝唑、壬二酸、伊维菌素等[13],但临床应用均有局限,如有一定刺激性,停药后易复发,耐药性逐渐增高等。国内外尚无外用四环素被批准用于治疗玫瑰痤疮。米诺环素是第2 代半合成四环素,具有抗菌和抗炎双重作用,能通过抑制基质金属蛋白酶的活性、抑制免疫细胞的活化和增殖、抑制诱导型一氧化氮合酶活性来降低玫瑰痤疮患者的炎性级联反应[16-17]。尽管米诺环素未被批准用于治疗玫瑰痤疮,但临床广泛应用,且米诺环素的疗效不逊于多西环素[15]。研究表明,与多西环素相比,米诺环素发生严重ADR 如药物性狼疮、血清病样反应、药物超敏反应综合征等的可能性更大[18]。一项为期21 d 的关于4%米诺环素泡沫剂的药代动力学研究中发现,健康成人全身每天1 次外用4%米诺环素泡沫剂,并不能引起体内米诺环素的蓄积[19]。因此,外用米诺环素可能是治疗玫瑰痤疮的新选择。
本研究结果显示,米诺环素外用制剂的疗效显著优于赋形剂;同时,ADR 发生情况与赋形剂并无显著差异,证实了外用米诺环素的安全性及有效性。现已有大量米诺环素外用制剂治疗寻常型痤疮的临床研究,最常见的ADR 为头痛、轻度红斑、色素沉着及轻度干燥等[7],与本研究结果一致,但总体发生率低,提示米诺环素外用制剂在治疗中、重度PPR 安全性好。其中,有2 项研究[5-6]比较了高、低浓度米诺环素外用制剂治疗中、重度PPR 是否存在差异,结果显示,高浓度组与低浓度组疗效相当,虽然高浓度的米诺环素外用制剂的ADR 发生率高于低浓度组,但无显著差异。提示米诺环素的浓度并不是诱发ADR 的主要因素,局部皮肤轻度红斑、色素沉着、干燥等可能与赋形剂相关。
本研究还存在如下不足,纳入病例数量足够,但研究项目少,还需更多大样本、多中心的临床试验加以验证;本研究主要针对白色人种,未对不同种族的人群进行分析;1 项研究为米诺环素凝胶,2 项研究为米诺环素泡沫剂,赋形剂存在差异;1 项研究并未对比不同浓度米诺环素外用制剂的疗效和安全性,存在较高的异质性。
综上所述,不同浓度的米诺环素外用制剂治疗中、重度PPR,可显著减少炎性皮损,降低IGA 评分,且ADR 小,发生率低,安全有效。但仍需更多高质量、大规模的多中心临床研究来获得更可靠的循证医学证据。
