腹部推拿对慢传输型便秘大鼠神经递质及5-HT 受体表达的调节作用∗
2021-08-16王栋良马鑫文
王栋良,马鑫文
新疆维吾尔自治区中医医院推拿科,新疆,乌鲁木齐830000
慢传输型便秘(slow transit constipation,STC)是由于大肠功能紊乱,传导失常而导致的排便周期延长和排便困难,属慢性、原发性、功能性、结肠性和传输缓慢性便秘。其发病机制可能与肠神经系统及Cajal 间质细胞、中枢神经及自主神经系统调节功能障碍、激素水平异常等有关[1-3]。此外,长期不良的生活习惯,如起居无规律、饮食过于精细、减肥、节食及缺少运动等,均可使肠道受刺激不足,排便动作缺乏,粪便在肠腔内滞留时间过久而形成STC[4-6]。近年研究[7-10]发现,5-羟色胺(5-hydroxyptrytamine,5-HT)受体表达异常与STC 等多种胃肠道疾病的发生及发展密切相关,因此调节5-HT相关受体表达水平可能是治疗STC 的潜在有效途径。
腹部推拿是中医特色疗法之一。有研究表明,腹部推拿能改善STC 患者的临床症状,缓解患者疾病状态[11-15],但其作用机制及对神经递质及5-HT受体表达的作用目前尚没有明确报道。本研究通过探讨腹部推拿对STC 大鼠体内神经递质及5-HT受体表达的影响,为腹部推拿在STC 治疗中的临床应用提供依据。
1 材料与方法
1.1 动物与药物健康雄性SD 大鼠39 只,SPF级,6 周龄,体质量(180±20)g,购自新疆医科大学动物实验中心,实验动物合格证号:SCXK(新)2018-0002),自由进食、饮水饲养于实验动物房。涉及动物实验的操作遵照新疆医科大学实验动物管理和使用委员会相关规定(批号:IACVC 20180516-57)。5-HT3R、5-HT4R 和GAPDH 抗体均购自Proteintech公司;RIPA 蛋白裂解液、SP、NOS 及VIP 检测ELISA试剂盒购自上海碧云天公司;ECL 显色液购自Thermo 公司;酶标仪购自北京岛津公司;双垂直电泳仪、转印电泳仪、凝胶成像仪均购自伯乐生命医学产品有限公司。
1.2 STC 大鼠模型建立及分组将39 只大鼠随机分为对照组、模型组及推拿组,每组13 只。模型组及推拿组大鼠采用肠神经节消融术造模:将动物麻醉后仰卧于手术台上,无菌条件下取腹部正中切口,长约4 cm,充分暴露结肠,取宽度约1 cm双层纱布,使用生理盐水完全浸湿,包绕全部结肠,纱布长度与肠管相当,保持纱布湿润,每5 min沿纱布长轴间隔约1 cm 各滴3 滴0.25%苯扎氯铵溶液,其余器官用湿纱布覆盖、隔离,共30 min,术后逐层关腹,对照组不做处理,相同条件下继续喂养。术后12 h 恢复大鼠正常饲养,自由进食、饮水,给予青霉素钠抗炎1 周,观察大鼠排便及精神和营养状况。为确保实验结果可靠性和减少误差,所有模型制备均由指定动物实验员完成,且以粪粒干燥、粒形缩短、排便费力、日排便量低于对照组大鼠作为造模成功的标准。
1.3 按摩方法造模成功后,根据文献方法[16],选用腹部推拿中核心手法中“按法”“摩法”作为主要干预手法。为保证手法的一致性,实验前应用YF-3 手法测定仪事先采集操作手法信息,对手法的用力大小、频率等进行标定,建立手法操作模型。实验过程中手法由专人操作,手法操作者除掌握手法要点外,还需应用YF-3 手法测定仪进行评测,待其手法的力度大小、频率形成的波形轨迹与手法模型基本一致后,方可于实验大鼠身上操作。取穴参考《实验推拿学》[17]选取大鼠的关元穴、中脘穴。腹部按法:手法操作者以右手食指、中指二指叠按置于关元穴上,余指并拢。以右手腕关节为支点,食、中二指掌指部主动施力,向耻骨联合脊柱方向徐徐按下,力量自轻至重,待指面可感觉到大鼠腹部动脉轻微搏动,按而留之,完成此过程大约30 s,后维持此时的压力及其所达到的深度,静待1 min后手法操作者掌指部徐徐上提,直至完全离开受压部位,此过程大约持续30 s。如此反复操作2 次,共4 min。腹部摩法:手法操作者肘关节自然屈曲,腕部放松,指掌自然伸直,食指、中指并拢。以食指、中指指面着于施术部位,以腕关节为中心,连同掌、指作环形摩动,并以中脘穴为圆心,做顺时针方向节律性环旋运动,频率宜缓,每分钟20~30 次,如此反复操作6 min,每天治疗1 次,连续治疗14 天。对照组及模型组只摆相同体位,不进行腹部推拿。实验期间大鼠正常饮食,每日收集各组大鼠粪便,称重后记为湿重,然后置于90℃恒温干燥箱内干燥3 h 至恒重后再次称重,记为干重,并按照以下公式计算各组大鼠粪便含水率,且在最后一次推拿24 h 后进行后续实验。粪便含水率(%)=(湿重-干重)/湿重×100%。
1.4 大鼠血浆中SP、NOS 及VIP 水平测定大鼠眼眶后静脉丛取血至肝素润洗过的离心管中,室温静置5 min,然后置于离心机中,4℃,离心半径13.5 cm,3500 r/min 离心10 min,取上清液,按ELISA试剂盒说明书检测SP、NOS及VIP含量。
1.5 首粒黑便排出时间测定每组取6 只大鼠,禁食不禁水24 h 后,每只大鼠灌胃2 mL 浓度为100 g/L的活性炭悬液,记录各组大鼠首粒黑便排出时间。由于大鼠禁食后粪便呈黑色,排出黑便不易看出,可每过半小时换1 次底盆,并将粪便倒入水池中放水,用棍子挤压粪便,如果有黑色活性炭粉末漂出则记录时间。结束后各组大鼠用于后续结肠组织蛋白水平的测定。
1.6 大鼠肠推动率每组取6 只大鼠,禁食不禁水24 h后,每只大鼠灌胃1 mL浓度为100 g/L的活性炭混悬液,灌胃1 h 后用乌拉坦腹腔注射麻醉,立即解剖,取出从幽门到直肠末端的全部肠道,测量肠道全长以及幽门至黑色物质前端的距离,计算肠推动率。
肠推动率(%)=幽门至黑色物质前端的距离/肠道全长×100%
1.7 大鼠结肠组织样本采集及组织蛋白提取每组取6 只大鼠,颈椎脱臼处死后迅速分离结肠组织,用生理盐水小心清洗干净肠道内容物,用滤纸吸干表面水分后将一部分结肠组织放入10%中性甲醛中固定,其余放入玻璃匀浆器中,加入RIPA 蛋白裂解液,用玻璃匀浆器匀浆,直至充分裂解,置于4℃离心机以离心半径13.5 cm,12 000 r/min离心10 min,用移液枪将上清液移至另一干净离心管中,并加入SDS 上样缓冲液,混匀后放入100℃水浴5 min,然后放入-20℃储存备用。
1.8 苏木精-伊红(Hematoxylin-eosin staining,HE)染色将在10%中性甲醛中固定24 h 后的结肠组织转移至75%的酒精中,经自动组织脱水机脱水、透明处理,在石蜡包埋机中浸蜡、包埋,进行5µm 切片,水浴展开、捞片、沥干,放温箱中烘干,置于烘箱中60℃烤2 h,常规HE 染色,在显微镜下进行组织病理学观察。HE 染色步骤:1)脱蜡:将石蜡切片依次置于二甲苯(I)5 min→二甲苯(Ⅱ)5 min;2)复水:依次置于100%乙醇2 min→95%的乙醇1 min→80%乙醇1 min→75%乙醇1 min→蒸馏水洗2 min,各2次,然后吸干水份;3)苏木精染色:置于苏木精溶液中2 min,自来水流水冲洗2 min,把水吸干;4)分化:1%盐酸乙醇分化30 s,自来水浸泡15 min,吸干水份;5)伊红染色:置于伊红溶液中2 min;6)脱水:依次置于95%乙醇(I)5 min→95%乙醇(Ⅱ)5 min→100%乙醇(I)5 min→100%乙醇(Ⅱ)2 min;7)封片:置于通风橱,待乙醇彻底干后依次置于二甲苯(I)5 min→二甲苯(Ⅱ)5 min,待载玻片上残留二甲苯挥干后用中性树胶封片。
1.9 蛋白浓度测定将冻存的结肠组织蛋白液于室温下融化,采用BCA 法测定蛋白浓度,处理好待测样品后,取50 µg 蛋白进行SDS-PAGE 电泳分离,转膜,将分离的蛋白电转移至PVDF 膜上。封闭液室温封闭1 h,经5-HT3R、5-HT4R 及GAPDH 抗体(1∶1000)孵育后,4℃过夜。PBST 充分洗膜后,加入二抗(1∶2000)室温孵育1 h,PBST清洗后显色液显影,利用凝胶成像仪成像后进行灰度值检测。
1.10 统计学方法应用SPSS 19.0统计软件分析数据,应用Graphpad prism 5 作图,应用Image J软件进行免疫印迹灰度值检测,计量资料以±s表示,组间比较采用单因素方差分析,P<0.05表示差异有统计学意义。
2 结果
2.1 各组大鼠粪便含水率模型组大鼠粪便含水率为(60.11±1.14)%,低于对照组的(65.29±1.01)%(P<0.05),推拿组大鼠粪便含水率为(64.97±0.98)%,高于模型组(P<0.05),提示腹部推拿能够改善STC大鼠粪便含水率,缓解STC大鼠的疾病状态。
2.2 各组大鼠血浆SP、NOS 及VIP 水平与对照组相比,模型组大鼠血浆SP 水平下降(P<0.05),VIP及NOS水平升高(P<0.05),提示STC 大鼠发病机制可能与体内神经递质水平改变有关;与模型组相比,推拿组大鼠体内SP 水平升高(P<0.05),VIP及NOS水平降低(P<0.05),提示对STC 大鼠连续腹部推拿14 天能够调节其体内相关神经递质水平,改善STC大鼠疾病进展与转归。见表1。
表1 各组大鼠血浆SP、VIP及NOS水平(±s)

表1 各组大鼠血浆SP、VIP及NOS水平(±s)
注:*表示与对照组比较,P<0.05;#表示与模型组比较,P<0.05
组别对照组模型组推拿组鼠数13 13 13 SP 65.41±0.76 31.62±1.46*63.89±2.31#VIP 31.62±0.84 86.19±1.13*33.98±0.72#NOS 0.61±0.29 4.17±1.13*0.83±0.18#
2.3 各组大鼠首粒黑便排出时间模型组STC大鼠首粒黑便排出时间为(10.68±2.11)h,长于对照组的(5.13±1.51)h(P<0.05),提示造模成功;推拿组大鼠首粒黑便排出时间为(6.12±1.39)h,短于模型组,推拿组与对照组比较差异无统计学意义(P<0.05);提示腹部推拿可以改善STC大鼠的首粒黑便排出时间,改善STC大鼠的病理状态,改变疾病状态。
2.4 各组大鼠肠推动率与对照组相比,模型组大鼠肠推动率降低(P<0.05),提示STC 大鼠发病机制与肠推动率改变有关;与模型组相比,推拿组大鼠肠推动率升高(P<0.05),提示腹部推拿可改善大鼠肠推动率。见表2。
表2 各组大鼠肠推动率(±s)
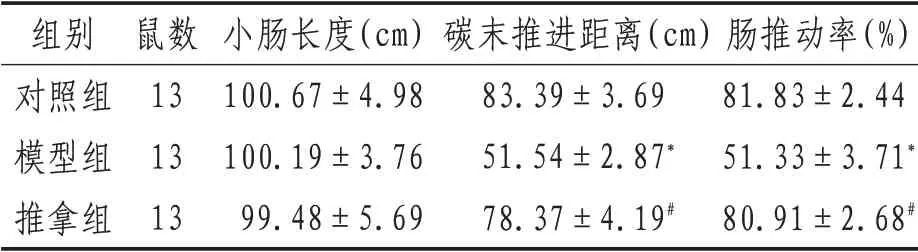
表2 各组大鼠肠推动率(±s)
注:*表示与对照组比较,P<0.05;#表示与模型组比较,P<0.05
组别对照组模型组推拿组鼠数13 13 13小肠长度(cm)100.67±4.98 100.19±3.76 99.48±5.69碳末推进距离(cm)83.39±3.69 51.54±2.87*78.37±4.19#肠推动率(%)81.83±2.44 51.33±3.71*80.91±2.68#
2.5 各组大鼠结肠组织病理学与对照组相比,模型组大鼠结肠组织黏膜层及肌层染色浅,厚度增加,结肠绒毛上皮细胞可见脱落,提示造模成功;与模型组相比,推拿组STC 大鼠结肠组织黏膜层及肌层染色深,偶见结肠绒毛上皮细胞脱落,细胞排列整齐,细胞形态圆润,细胞间隙缩小;提示对STC 大鼠进行连续14 天的腹部推拿,有利于STC大鼠结肠组织细胞的恢复,改善STC大鼠结肠组织的病理学转归。见图1。
2.6 各组大鼠结肠组织5-HT3R、5-HT4R 水平与对照组相比,模型组大鼠结肠组织5-HT3R、5-HT4R水平降低(P<0.05);提示STC 大鼠发病机制可能与5-HT 受体表达有关;与模型组相比,推拿组大鼠5-HT3R、5-HT4R水平升高(P<0.05),提示腹部推拿可能通过调节STC大鼠体内神经递质水平,进而调节大鼠结肠组织5-HT3R、5-HT4R水平。见图2。

图2 各组大鼠结肠组织5-HT3R、5-HT4R水平
3 讨论
5-HT是参与调节胃肠道分泌和运动功能的重要神经递质和旁分泌信号分子。其中5-HT3、5-HT3R、5-HT4R与胃肠道动力紧密联系,其分泌、转运异常都能引起胃肠道疾病[5-8]。现代研究显示肠神经递质失调是导致功能性便秘的主要病理变化。5-HT、NO、SP、VIP 是调节肠道功能的重要神经递质,通过兴奋或抑制作用调节肠道运动[9-10]。
本研究首次采用大鼠肠神经节消融术建立STC大鼠模型,探讨腹部推拿对STC大鼠体内神经递质水平及5-HT 受体表达的影响,结果表明,与模型组相比,推拿组大鼠粪便含水率升高,提示腹部推拿可能通过改变STC 大鼠肠道细胞通透性增加粪便含水率;推拿组大鼠体内SP 水平升高,VIP及NOS 水平降低,首粒黑便排出时间缩短,肠推动率升高,提示腹部推拿可能通过刺激STC 大鼠胃肠道调节体内相关神经递质水平,进而改善大鼠胃肠道蠕动功能;推拿组大鼠结肠组织黏膜层及肌层染色深,偶见结肠绒毛上皮细胞脱落,细胞排列整齐,形态圆润,细胞间隙缩小,提示腹部推拿有利于STC大鼠结肠组织细胞的恢复,改善STC大鼠结肠组织的病理学转归;推拿组大鼠5-HT3R、5-HT4R 水平升高,提示腹部推拿可能通过调节STC大鼠体内神经递质水平,进而调节STC 大鼠结肠组织5-HT3R、5-HT4R 水平,从而改善STC 大鼠疾病状态及疾病转归。
综上所述,腹部推拿能够改善STC 大鼠疾病状态,同时调节其体内神经递质及5-HT受体表达。
