植物乳杆菌+菊粉合生元缓解DSS 诱导小鼠溃疡性结肠炎的研究
2021-08-15高擎燏崔雷鸿朱晓峰朱崇淼杭苏琴
张 桢,高擎燏,崔雷鸿,朱晓峰,朱崇淼*,杭苏琴*
(1.南京农业大学动物科技学院,国家动物消化道营养国际联合研究中心,江苏省消化道营养与动物健康重点实验室,南京农业大学消化道微生物研究室,江苏南京 210095;2.南京致润生物科技有限公司,江苏南京 211200)
症性肠病(Inflammatory Bowel Diseases,IBD)主要包括溃疡性结肠炎(Ulcerative Colitis,UC)和克罗恩病(Crohn's Disease,CD),其中UC 引起病变处黏膜充血、溃烂,临床表现为腹泻和血便[1]。抗生素治疗UC 易出现耐药性,长期服用抗生素可能增加CD 的患病概率[2]。因此,安全无副作用的微生态制剂受到极大关注。微生态制剂主要包括益生菌、益生元和合生元,其中益生菌能调节肠道菌群,而益生元可为益生菌提供营养底物[3]。研究表明,益生菌与益生元组合成的合生元能促进肠道微生态平衡[4],如嗜酸乳杆菌、鼠李糖乳杆菌与菊粉组成的合生元能有效缓解小鼠结肠炎症,并提高肠道有益菌属比例[5-6],但不同微生态制剂治疗UC的效果有很大差异[7]。因此,有必要通过动物试验对微生态制剂的疗效进行验证。
本实验室前期体外研究表明,植物乳杆菌L47+菊粉组合能够提高体外模拟猪结肠发酵环境中有益菌属的比例和短链脂肪酸的水平[8],因此推测该组合可能有缓解UC 的作用。葡聚糖硫酸钠(Dextran Sulfate Sodium,DSS)诱导的结肠炎是国际公认并被广泛应用的实验性UC 动物模型,其病理改变和人体结肠炎临床症状及其相似。因此,本研究利用DSS 诱导的结肠炎小鼠探究植物乳杆菌L47+菊粉合生元对结肠炎的作用,为其将来应用于生产提供理论依据。
1 材料与方法
1.1 试验材料及预处理 32 只体重(39.79±0.23)g 的8 周龄雄性ICR 小鼠购自南京市江宁区青龙山动物繁殖场。菊粉的纯度≥90%,聚合度为32~34;DSS 的分子量为40 000。菊粉和DSS 均购自青岛源叶生物有限公司。植物乳杆菌L47+菊粉合生元制备:将实验室自行分离保存于-20℃的植物乳杆菌菌株接种于MRS 培养基中,37℃传代2 次后于6 000 r/min 离心15 min,收集菌体并重悬至含2%菊粉的无菌水中(109CFU/mL),用于后续小鼠灌胃。
1.2 试验设计 本试验在南京农业大学动物科技学院动物房进行,将32 只小鼠随机分为对照组、DSS 组、合生元组及合生元+DSS 组,每组8 只,饲喂基础饲料,自由饮水,适应期7 d 后开始正式试验。对照组和DSS组小鼠每日灌胃200 μL 生理盐水,合生元组与合生元+DSS 组小鼠每日灌胃200 μL 合生元溶液;第15 天开始在DSS 组与SD 组小鼠饮水中添加3% DSS(w/v),第21 天,小鼠禁食6 h 后断颈处死,采集血液、结肠组织以及结肠食糜等样品,用于指标测定和分析。
1.3 生长性能及组织器官测定
1.3.1 生长性能 每日16:00 对小鼠称重,记录给料量和剩料量,计算每日采食量。
1.3.2 结肠长度和重量 处死小鼠后,剪取从盲肠末端至肛门整段结肠肠段,测定长度并称重,做好记录。
1.3.3 脾脏重量 处死小鼠后,剪取脾脏,称重并记录。
1.4 小鼠结肠组织学形态评分 剪取小鼠结肠肠段约0.5 cm,用生理盐水清洗干净,于4%多聚甲醛中固定,72 h 内进行包埋以及石蜡切片[9]。对固定的结肠肠段进行常规HE 染色(武汉塞维尔公司),于正置显微镜下对结肠状态观察和评分,评分标准[10-11]如表1 所示。

表1 小鼠结肠形态组织学评分
1.5 小鼠结肠菌群的定量分析和代谢产物测定
1.5.1 结肠菌群的定量分析 使用实时荧光定量PCR 绝对定量结肠食糜微生物中总菌、乳酸杆菌和大肠杆菌的数量,所用微生物的引物序列如表2 所示(上海凌恩生物有限公司),反应条件和反应体系严格按照说明书操作。

表2 菌群荧光定量PCR 和TLR4 基因引物序列
1.5.2 微生物代谢产物SCFA 的测定 参照秦为琳[12]的方法使用气相色谱(Shimadzu GC-2014,日本)检测样品中短链脂肪酸(Short Chain Fatty Acid,SCFA)浓度。
1.6 小鼠结肠组织TLR4 及血清中炎症因子含量的测定
1.6.1 TLR4 基因表达的测定TLR4基因和持家基因引物序列如表2 所示,反应条件和反应体系严格按照公司提供的说明书进行。每个样本重复测定3 次,取CT 的平均值,根据公式2-ΔΔCT计算各基因的相对表达量。
1.6.2 血清炎症相关细胞因子的测定 采屠宰前眼眶静脉血,室温静置4 h,3000 r/min 离心15 min,取上层血清,分装至1.5 mL 离心管中,-20℃冰箱保存。严格按照试剂盒(南京奥青生物有限公司)说明书测定血清中IL-6、IL-8、IL-1β及TNF-α含量。
1.7 统计分析 数据以平均值± 标准误表示,采用SPSS 24.0 的单因素方差分析(One-Way ANOVA)比较差异显著性。采用GraphPad prism 8.0.2 软件作图。P<0.05 表示差异显著,P>0.05 表示差异不显著。
2 结果与分析
2.1 合生元对小鼠生长性能的影响 如图1 所示,与对照组相比,DSS 组小鼠体重和采食量均降低(P<0.05),体重下降率超过7%,采食量下降超过2 g/d;与DSS组相比,合生元+DSS 组小鼠的体重和采食量均升高(P<0.05)。

图1 合生元对小鼠生长性能的影响
如表3 所示,与对照组和合生元组相比,DSS 组、合生元+DSS 组小鼠结肠长度均缩短(P<0.05),而合生元+DSS 组小鼠结肠长度较DSS 组增加(P<0.05);结肠重量各组之间差异不显著;相较于对照组,DSS组小鼠脾脏平均重量增加了0.12 g(P<0.05),合生元组、合生元+DSS 组小鼠脾脏重量较DSS 组均下降(P<0.05)。

表3 合生元对小鼠结肠长度、结肠和脾脏重量的影响
2.2 合生元对小鼠结肠组织学形态的影响 由图2 可知,对照组与合生元组小鼠结肠上皮细胞绒毛发育较好,隐窝和腺体正常,未发生炎症细胞浸润;与对照组相比,DSS 组小鼠结肠黏膜上皮结构破坏严重,杯状细胞坏死,隐窝消失;与DSS 组相比,合生元+DSS 组小鼠结肠黏膜上皮结构的受损状况得到缓解,可见少量炎症细胞浸润,黏膜组织结构相对完整。

图2 合生元对结肠炎小鼠结肠黏膜组织形态的影响
如表4 所示,对照组与合生元组小鼠平均结肠组织学评分分别为0.2 和0.1,均未出现明显组织学损伤,DSS 组小鼠组织学评分升高到3.3(P<0.05),表明DSS 组小鼠结肠组织受到严重损伤;与DSS 组相比,合生元+DSS 组小鼠结肠组织学评分下降至2.1(P<0.05)。

表4 合生元对结肠炎小鼠结肠组织形态组织学评分的影响
2.3 合生元对小鼠结肠食糜菌群和代谢产物的影响 由表5 可见,各组小鼠结肠总菌数量无显著差异;与对照组相比,DSS 组小鼠结肠乳酸杆菌数量降低(P<0.05),大肠杆菌数量增加(P<0.05);与DSS 组相比,合生元+DSS 组小鼠结肠乳酸杆菌数量有所提升(P>0.05),大肠杆菌数量降低(P<0.05)。
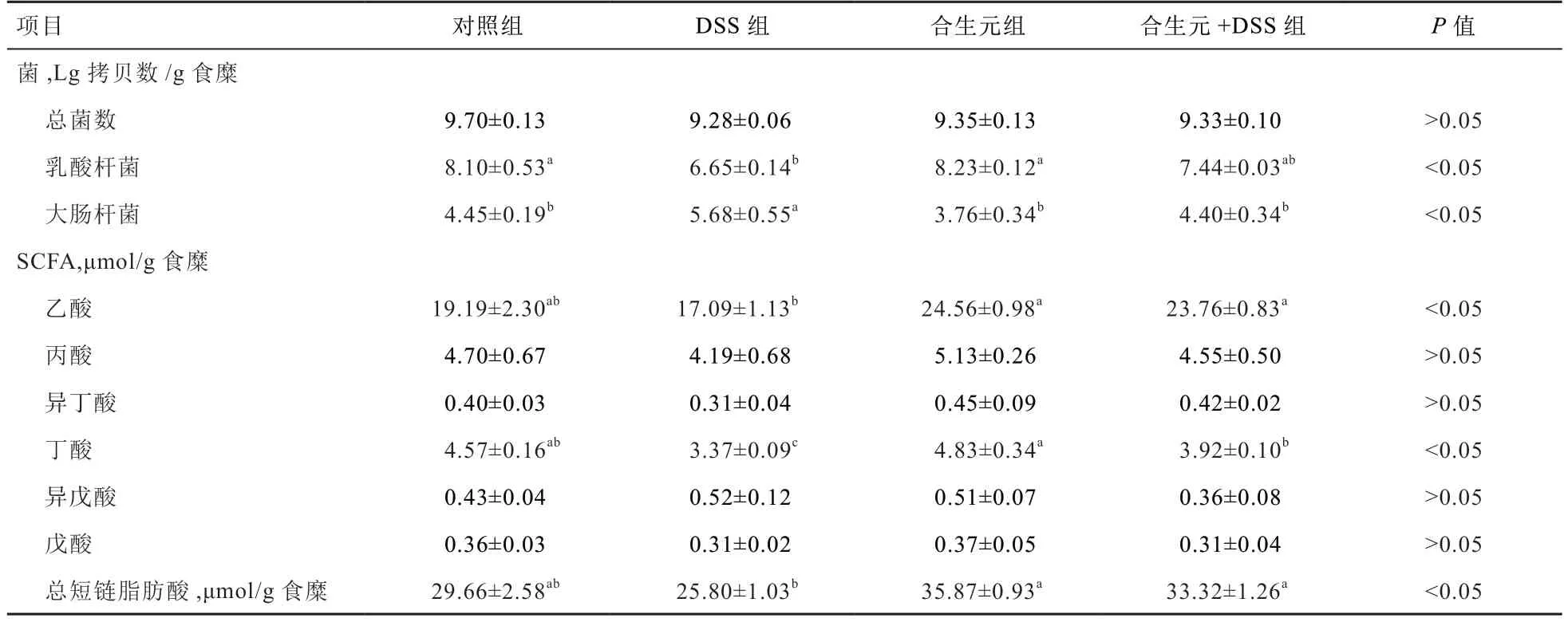
表5 合生元对小鼠结肠菌群和短链脂肪酸的影响
与对照组相比,DSS 组小鼠结肠食糜中丁酸以及总短链脂肪酸浓度下降(P<0.05);与DSS 组相比,合生元+DSS 组小鼠结肠食糜的乙酸、丁酸以及总短链脂肪酸浓度上升(P<0.05)。
2.3 合生元对小鼠结肠组织TLR4基因表达及血清炎症因子的影响 由表6 可知,经DSS 刺激后,DSS 组小鼠结肠组织中TLR4基因的相对表达量较对照组显著升高;与DSS 组相比,合生元+DSS 组小鼠结肠组织中TLR4基因的相对表达量显著下降。与对照组相比,DSS 组小鼠血清中IL-6、IL-8、IL-1β和TNF-α含量均显著增加;与DSS 组相比,合生元+DSS 组的IL-6、IL-8、IL-1β和TNF-α含量均显著下降。
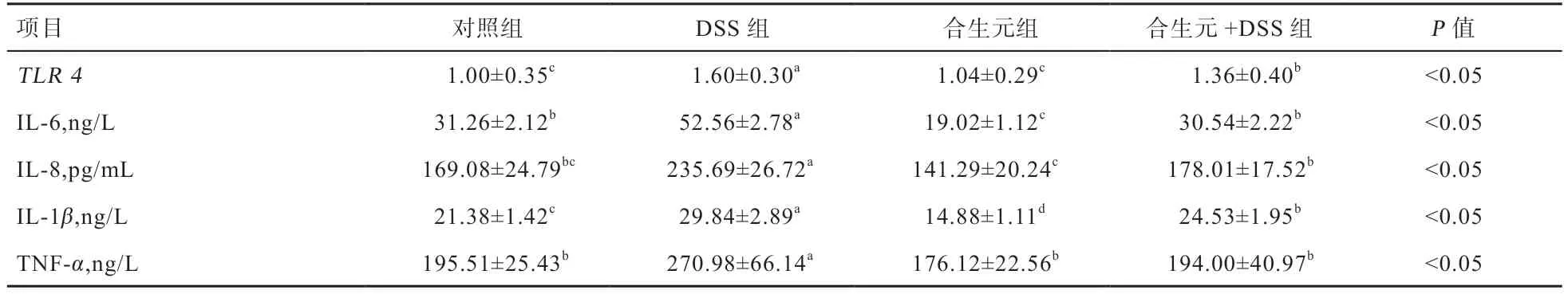
表6 合生元对小鼠结肠组织TLR4 基因表达量和血清炎症因子含量的影响
3 讨 论
Kim 等[17]指出,无论使用抗生素还是其他药物,对结肠炎小鼠的影响首先会反映在小鼠的体重、采食量上,因此本研究首先关注小鼠体重和采食量的变化。本研究结果显示,DSS 组小鼠体重下降率达7%,而合生元+DSS 组小鼠体重下降率为4.5%左右,且采食量较DSS 组提高近1 g/d,这表明植物乳杆菌L47+菊粉能够缓解DSS 所引起的体重与采食量降低。而且植物乳杆菌L47+菊粉能显著改善DSS 所导致的结肠缩短。贺庆芝等[18]研究发现,结肠长度与结肠炎严重程度呈负相关,这可能是因为结肠炎引起的结肠充血和病变而导致结肠缩短。相比于对照组,DSS 处理显著提高了脾脏重量。脾脏是机体重要的免疫器官,可能与DSS 激活机体免疫系统,从而导致脾脏功能活跃和其重量增加[19],而植物乳杆菌L47+菊粉则缓解了这一症状。此外,小鼠结肠组织切片结果显示,SD 组结肠组织学评分显著低于DSS 组,这表明植物乳杆菌L47+菊粉对DSS 诱导的小鼠结肠黏膜损伤具有保护作用。Yang 等[20]研究表明,植物乳杆菌能够显著改善Escherichia coli K88攻毒造成小肠绒毛高度缩短、隐窝深度增加等肠黏膜损伤的问题,这也本研究结果一致。
结肠炎可导致肠道菌群结构失调。本研究菌群定量结果显示,与对照组相比,DSS 组结肠乳酸杆菌数量显著降低,大肠杆菌数量显著升高;而合生元+DSS 组乳酸杆菌数量较DSS 组显著提高,大肠杆菌数量降低,说明植物乳杆菌L47+菊粉组合促进了有益菌的增殖,抑制了病原菌的生长。合生元可通过多种途径抑制肠道病原菌的增殖,其中包括促进乳酸菌增殖而产生大量乳酸降低pH 形成一个抑制病原菌如大肠杆菌等生长的酸性环境,从而保护动物肠道健康[21]。此外,Vinolo 等[22]研究发现结肠炎可引起肠道短链脂肪酸浓度下降。本研究结果显示,合生元+DSS 组乙酸、丁酸以及总短链脂肪酸浓度显著高于DSS 组,说明植物乳杆菌L47+菊粉能够调节肠道菌群结构,促进短链脂肪酸的生成。这可能与乳酸菌数量增加有关,因为乳酸菌除了产生乳酸还可以促进SCFAs 的产生,其中包括乳酸含量的增加为丁酸产生菌提供了底物来源,从而促进丁酸含量增加[23-24]。
肠内稳态受到Toll-like 受体(Toll-like Receptors,TLRs)的调控,它们在微生物病原和调节先天免疫系统中发挥着重要作用。其中TLR4 是研究最为广泛的受体之一,它主要通过识别大肠杆菌等革兰氏阴性菌外膜的结构成分LPS 而激活炎症信号通路,其中最主要的是以NF-kB 为中心的炎症信号通路[25]。被激活的NF-κB 调控一系列免疫炎症反应相关的基因转录,触发肠道炎症介质如IL-1、IL-2、IL-6、IL-8 以及TNF-α、IFN-γ、黏附分子蛋白等细胞因子,导致肠道黏膜组织炎症损伤[26]。研究表明,TLR4在正常人体肠道黏膜中少量表达,但在UC 患者或UC 模型小鼠的肠黏膜中其表达大幅提高[27]。本研究结果显示,相比于DSS 组,合生元+DSS 组TLR4 的mRNA 表达上调,血液促炎因子IL-6、IL-8、IL-1β和TNF-α水平降低,这表明植物乳杆菌L47+菊粉能减轻肠道黏膜的炎症反应,可能与植物乳杆菌L47+菊粉引起结肠短链脂肪酸浓度的改变有关。众多研究均表明短链脂肪酸具有抗炎作用。Tedelind 等[28]研究发现,短链脂肪酸可以抑制人结肠细胞系TLR4介导的NF-κB 激活,其抗炎作用为丁酸>丙酸>乙酸;Fukuda 等[29]也发现乙酸可缓解小鼠大肠杆菌攻毒所引起的肠道炎症。
综上所述,植物乳杆菌L47+菊粉可能是通过提高小鼠结肠乳酸杆菌数量及短链脂肪酸浓度,抑制大肠杆菌等病原菌的生长,降低TLR4基因的相对表达以及IL-6、IL-8、IL-1β和TNF-α等促炎因子的分泌,从而一定程度缓解小鼠结肠炎症,具有应用于生产实践的潜力。
