IGF-1 和IGF-2 基因在关岭牛不同组织中的表达分析
2021-08-15付开斌周志楠惠茂茂
付开斌,陈 祥*,吴 雨,周志楠,张 艳,惠茂茂
(1.贵州大学高原山地动物遗传育种与繁殖教育部重点实验室,贵州省动物遗传育种与繁殖重点实验室,贵州贵阳 550025;2.贵州大学动物科学学院,贵州贵阳 550025)
IGF(Insulin-Like Growth Factors)家族因其结构与胰岛素十分相似,故被人们称作“胰岛素样生长因子”。IGF 有3 种配体:IGF-1、IGF-2以及胰岛素[1]。IGF 通过基因间的相互作用,共同调节动物的生物学过程,也是动物胚胎正常发育以及出生后动物生长发育所必需的生长因子[2]。研究表明,IGF 信号系统是构成下丘脑-垂体-肝脏轴的主要调控部分,可以通过控制不同的生长因子及激素的分泌从而控制生物有机体的生长和发育[3]。IGF-1是一种多效性激素,可影响葡萄糖代谢、内环境稳定、免疫和神经系统[4]。此外,IGF-1能控制脂肪、背最长肌比重、体重,促进非组蛋白磷酸化和细胞的生长和分化[5]。在斑马鱼咽裂期,在其胚胎中注射IGF-1,可提高相关家族基因的表达量,这表明IGF-1在促进前侧结构的生长发育方面有作用[6]。同时,研究发现IGF-1基因还可作为生长发育的候选基因[7]。IGF-2被人们称为生长调节素A,在细胞增殖分化、有丝分裂以及程序性死亡等方面发挥重要作用,对生物个体的生长发育有重要影响[8]。有研究显示,IGF-2在机体中枢神经系统中表达量较高,说明IGF-2与大脑的生长及智力发育密切相关[9]。同时IGF-2还是胚胎和胎儿时期最重要的生长因子之一,IGF-2在胎儿时期的血液中浓度较高,出生后IGF-1的浓度迅速上升,推测IGF-2主要是调节胚胎时的生长,而IGF-1则主要调节出生后的生长发育[10]。另有研究发现IGF-2基因多态性对猪有重要的生理影响,它可以调节猪的瘦肉率、生长速度、背膘厚、心脏重量和背最长肌面积[11-13]。且IGF-2基因与肿瘤的发生有密切联系,在动物体内过表达会导致动物产生乳腺癌、前列腺癌和肝癌等多种疾病,在肿瘤病人的血中发现IGF-2及其结合蛋白异常增高[14]。IGF 家族在被研究者发现后,大多数动物IGFs 相继被克隆并测序验证,但IGF-1与IGF-2基因在牛不同组织中的表达谱却鲜有报道。
关岭牛作为贵州宝贵的畜禽遗传资源,具有许多独特的优势,其在数量性状、经济性状以及质量性状方面与其他黄牛相比,均呈现出显著优势,在地方畜禽动物资源保护与利用方面具有重要的研究意义和较大的经济价值。因此,本研究通过荧光定量PCR 检测IGF-1和IGF-2基因在关岭牛不同组织中的表达,构建关岭牛IGF-1基因和IGF-2基因组织表达图谱,以期为关岭牛的生长发育、良种选育等提供基础理论依据。
1 材料与方法
1.1 实验材料
1.1.1 实验动物 关岭牛来自贵州省关岭县,根据生长饲养记录,选取年龄为18 月龄、饲养条件相同、体重与体格相近的公牛3 头。屠宰后,迅速采集肺脏、心脏、脾脏、肾脏、肝脏及背最长肌组织样,对组织样进行处理并标记,放入液氮中冷冻保存。带回实验室后,立即转入-80℃冰箱保存备用。
1.1.2 仪器设备 PCR 扩增仪(C1000 TouchTM)、凝胶成像系统(Universal Hood II)及电泳仪(DYY-2C 型)均购自美国BIO-RAD 公司;超微量紫外分光光度计(µl trospec 2100 pro)购自安玛西亚中国有限公司;实时荧光定量PCR 仪(CFX96 Real-Time System)购自上海博讯实业有限公司医疗设备厂。
1.1.3 主要试剂 TRIzol、FirstStrand cDNA Synthesis、氯仿、异丙醇及2×Taq MasterMix 均购自贵州艾瑞特生物有限公司;八联管、荧光染料UitraSYBRMixture(With ROX)及DNA Marker 1000 均购自北京康为世纪生物科技有限公司。
1.2 实验方法
1.2.1 引物设计及合成 在NCBI 数据库中查找牛IGF-1基因(NM_001077828.1)和IGF-2基因(NM_001367627.1)mRNA 序列,通过Primer 5.0 软件设计IGF-1基因和IGF-2基因的荧光定量引物,以GAPDH基因作为qRTPCR内参基因,送生工生物(上海)股份有限公司进行合成。引物序列信息详见表1。

表1 荧光定量引物信息
1.2.2 总RNA 的提取与检测 使用TRIzol 法提取关岭牛肝脏、脾脏、心脏、肺脏、肾脏及背最长肌组织的总RNA,使用超微量分光光度计测定RNA 的浓度与纯度值,将检测结果为单峰且A260/A280 值在1.80~2.10 之间的RNA 置于-80℃冰箱保存备用。
1.2.3 cDNA 第一链合成 根据反转录试剂盒说明书,对所采集的关岭牛心脏、肝脏、脾脏、肺脏、肾脏及背最长肌6 种不同组织样品中的总RNA 进行反转录。反应体系为20 μL:RNA Template(ng/μL)9 μL,Oligo(dT)18Primer 1 μL,RI 1 μL,RT 1 μL,dNTP Mix 2 μL,Buffer 4 μL,Nuclease-free Water 1 μL,Random 1 μL。反应条件为42℃孵育60 min,70℃孵育5 min。结束后在超微量紫外分光光度计下进行浓度和纯度检测,将cDNA 产物置于-20℃冰箱保存。
1.2.4 实时荧光定量PCR 以GAPDH为内参基因,对所采集的关岭牛6 种不同组织的IGF-1基因和IGF-2基因mRNA 进行实时荧光定量PCR 检测。反应体系为10 μL:2×UltraSYBR Mixture 5 μL,Primer Sense(10 pmol/μL)0.5 μL,Primer Anti-sense(10 pmol/μL)0.5 μL,cDNA(ng/μL)1 μL,ddH2O 3 μL。反应条件为:95℃ 3 min,95℃ 15 s,60℃ 15 s,72℃ 1 min,循环39 次后进行溶解曲线分析,以每5 s 上升0.5℃的速率从65℃上升到95℃,实验的每个样品检测做3 个重复,取平均值。
1.2.5 数据处理及分析 采用2-ΔΔCt法分析IGF-1基因和IGF-2基因在关岭牛6 个不同组织中的相对表达量,使用SPSS 19.0 软件对2-ΔΔCt相对定量法所得数据进行分析,比较采用单因素方差分析,并使用LSD 法进行差异显著性检验,分别以P<0.05 和P<0.01 为差异显著和极显著的判断标准。
2 结果与分析
2.1IGF-1基因和IGF-2基因的PCR 扩增 通过反转录,以反转录产物cDNA 为模板,对IGF-1基因和IGF-2基因进行普通PCR 扩增,琼脂糖凝胶电泳检测扩增产物,结果见图1。由图1 可见,扩增产物条带清晰、明亮、透明,无杂带,且并未发现条带上有引物二聚体,特异性较好,与本实验所需要目的片段大小相符合,可进行下一步实验。
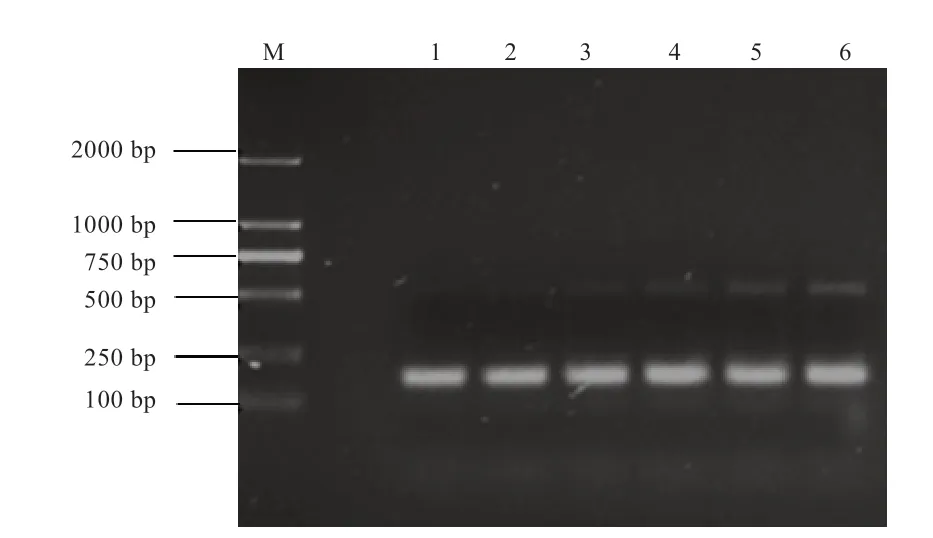
图1 IGF-1 基因和IGF-2 基因琼脂糖凝胶电泳检测结果
2.2IGF-1基因和IGF-2基因荧光定量PCR 特异性检测 由图2、3 可见,在关岭牛各组织中,IGF-1基因和IGF-2基因扩增曲线呈现完好的“S”形状,无非特异性扩增产物,产物单一,扩增曲线平滑且未出现特殊趋势;溶解曲线均呈单峰,峰值较好,且无其他引物二聚体杂峰出现,达到实验要求。荧光强度均来源于特异性扩增的产物,表明关岭牛IGF-1基因和IGF-2基因实时荧光定量qRT-PCR 扩增的结果合理,并具有较好的代表性,所得数据可用于实验结果分析。
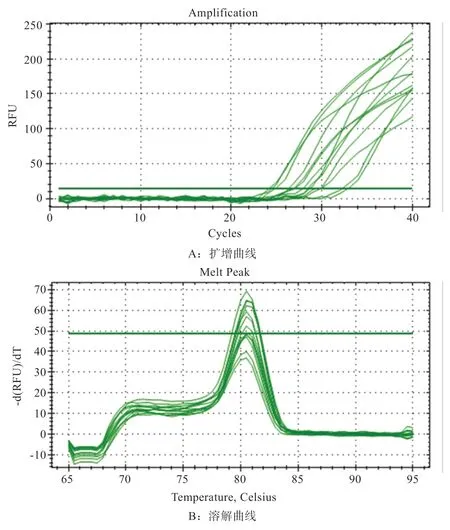
图2 IGF-1 基因在关岭牛不同组织的扩增曲线与溶解曲线
2.3IGF-1基因在关岭牛不同组织中的表达IGF-1基因在关岭牛6 个不同组织中均有表达,表达结果如图4所示。IGF-1基因表达趋势由高到低依次为:肺脏>肝脏>心脏>脾脏>肾脏>背最长肌;通过比较分析可知,IGF-1基因在肺脏中的表达量极显著高于所有组织,在肝脏中的表达量显著高于背最长肌,其余各组织间均未达到差异显著水平。

图3 IGF-2 基因在关岭牛不同组织的扩增曲线与溶解曲线
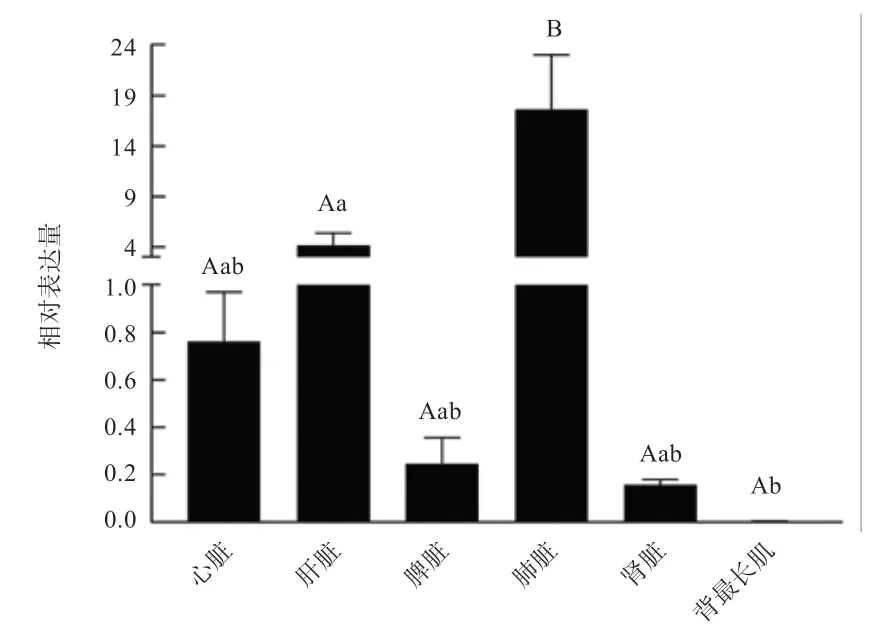
图4 IGF-1 基因在关岭牛6 个组织中的相对表达量
2.4IGF-2基因在关岭牛不同组织中的表达 如图5 所示,IGF-2基因在关岭牛6 个组织中均有表达,表达量由高到低依次为:肺脏>肝脏>肾脏>心脏>脾脏>背最长肌。组内分析得知,IGF-2基因在肺脏组织中的表达量极显著高于其他组织,在肾脏、肝脏表达量显著高于脾脏和背最长肌,其余各组织间均未达到差异显著水平。
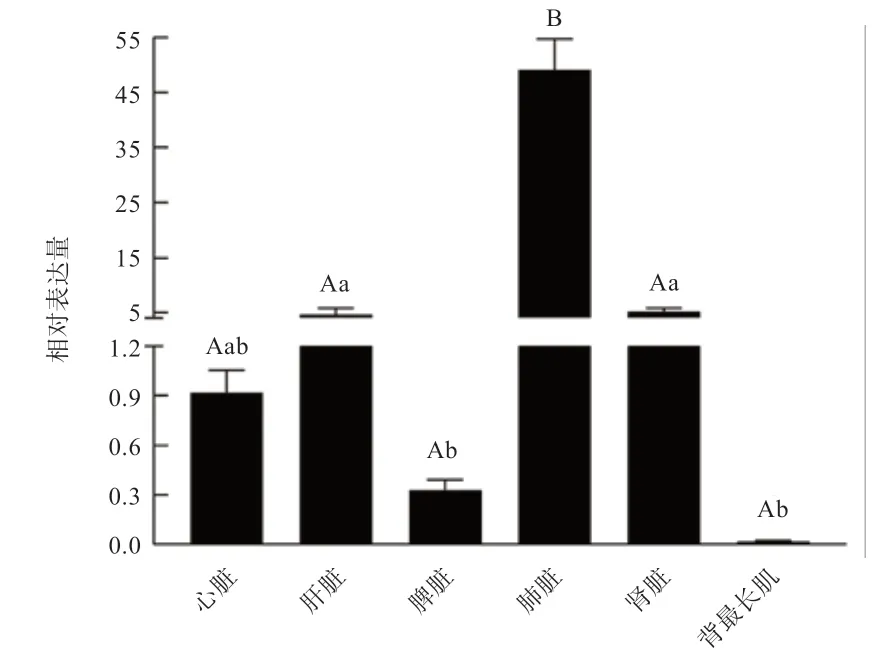
图5 IGF-2 基因在关岭牛6 个组织中的相对表达量
3 讨 论
IGF 是调节动物体细胞生长的重要激素之一[15]。IGF-1是动物机体内必不可少的重要调控因子,对动物机体的生长发育、生理代谢以及生产等具有重要作用,同时,IGF-1介导着动物生长激素的生长活性[16]。IGF-2基因的表达在动物的胚胎发育、脂肪沉积、骨骼与神经发育、细胞的增殖分裂以及调控转化等方面具有极其显著的作用[17-18]。
本实验以关岭牛为研究对象,采用qRT-PCR 方法,对关岭牛6 个组织IGF-1基因和IGF-2基因的表达水平进行了检测,发现IGF-1基因和IGF-2基因在关岭牛的心脏、肝脏、脾脏、肺脏、肾脏以及背最长肌中均有表达。实验结果与IGF-1基因mRNA 在蓝塘仔猪[19]、萨福克公羊[20]、努比亚黑山羊[21]、昆明犬[22]、藏绵羊[23]诸多组织中均有表达的研究结果一致;与IGF-2基因mRNA 在河川沙塘鳢[24]、西藏小型猪[25]、扬子鳄[26]、从江香猪[2]等均有表达的研究结果一致,说明IGF-1基因和IGF-2基因的表达具有广谱性。
生长激素/ 类胰岛素生长因子轴(GHR/IGF 轴)在调节动物机体生长发育和代谢方面具有极其重要的生理意义[24]。本研究发现,IGF-1基因和IGF-2基因均在关岭牛肺脏组织中表达量最高,这可能就与GHR/IGF轴的调节机制有关。朱晓锋[2]、李文杨[22]以及李丰耘[27]等研究表明,家畜组织器官中IGF-1基因高表达对动物机体的生长发育具有重要作用,可促进生长,直接影响动物的个体体型,这可能与IGF-1基因在动物不同组织中均有表达的结果密切相关,其具体调控机制有待进一步研究。在本实验中,IGF-1基因高表达于关岭牛的肺脏组织,这与IGF-1在大白猪[2,25]背最长肌中表达量最高的实验结果相反,推测可能是物种不同所致,其具体作用机理有待进一步研究;本实验结果又与IGF-1基因在萨福克公羊[21]、昆明犬[23]较高表达于肝脏的结果一致,说明肝脏是IGF-1合成的主要器官之一[28]。早在2016 年就有研究报道,IGF-2基因在肝脏细胞的表达对反映肝功能状态具有重要意义[29]。而马彦等[30]研究发现IGF-2基因过表达可促进肝癌细胞生长、迁移与侵袭,进而参与肝细胞癌发生。IGF-2基因在从江香猪[2]肺脏和肝脏中为高表达,与本实验研究结果一致,说明IGF-2基因在肺脏和肝脏的功能调控中有重要意义。
4 结 论
关岭牛IGF-1、IGF-2基因均于肺脏组织表达量最高,极显著高于其他5 个组织,在背最长肌组织中的表达量最低,说明IGF-1、IGF-2基因主要定位于肺脏组织;推测IGF-1、IGF-2基因对关岭牛的肺脏功能调控具有十分重要的生理意义。本研究结果为进一步发掘我国优质地方畜禽遗传资源、探究影响关岭牛生长发育的分子机制提供了参考。
