芪参汤对肝纤维化大鼠肝组织辅助性T细胞17/调节性T细胞平衡的影响
2021-08-14袁维王炳予杨磊袁星星
袁维,王炳予,杨磊,袁星星
芪参汤对肝纤维化大鼠肝组织辅助性T细胞17/调节性T细胞平衡的影响
袁维1,2,王炳予3,杨磊3,袁星星3
1.湖南中医药大学第一附属医院,湖南 长沙 410007; 2.湖南中医药大学中医学国内一流建设学科,湖南 长沙 410208; 3.黑龙江省中医药科学院南岗分院,黑龙江 哈尔滨 150001
观察芪参汤对肝纤维化大鼠肝组织辅助性T细胞17(Th17)/调节性T细胞(Treg)平衡的影响,探讨其抗肝纤维化作用机制。40只SD大鼠随机分为空白组、模型组、芪参汤组及秋水仙碱组,每组10只。采用四氯化碳腹腔注射法制备肝纤维化大鼠模型。造模期间芪参汤组及秋水仙碱组分别给予芪参汤(2 g/mL)及秋水仙碱混悬液(20 mg/L)灌胃,空白组、模型组予等体积生理盐水灌胃,1次/d,连续8周。全自动生化分析仪检测血清天冬氨酸氨基转移酶(AST)、丙氨酸氨基转移酶(ALT)及总胆红素(TBil)水平;ELISA检测肝组织白细胞介素(IL)-17A和IL-10含量;免疫组化检测肝组织转化生长因子-β1(TGF-β1)和α-平滑肌肌动蛋白(α-SMA)的表达;流式细胞术检测肝组织Th17和Treg比例;Western blot和RT-PCR分别检测肝组织维甲酸相关孤儿受体γt(ROR-γt)、叉头状转录因子p3(Foxp3)蛋白和mRNA表达。与空白组比较,模型组大鼠肝纤维化评分、胶原染色面积明显增加(<0.05),血清AST、ALT、TBil水平明显升高(<0.05),IL-17A含量明显增加、IL-10含量明显减少(<0.05),肝组织TGF-β1、α-SMA蛋白表达明显升高(<0.05),Th17比例增加、Treg比例减少,Th17/Treg比值明显增加(<0.05),肝组织ROR-γt蛋白和mRNA表达明显升高,Foxp3蛋白表达明显降低(<0.05);与模型组比较,芪参汤组和秋水仙碱组肝纤维化评分、胶原染色面积明显减少(<0.05),血清AST、ALT、TBil水平明显降低(<0.05),IL-17A含量明显减少,IL-10含量明显增加(<0.05),肝组织TGF-β1、α-SMA蛋白表达明显降低(<0.05),Th17比例减少,Treg比例增加,Th17/Treg比值明显降低(<0.05),肝组织ROR-γt蛋白和mRNA表达明显降低,Foxp3蛋白表达明显升高(<0.05)。芪参汤可抑制大鼠肝纤维化,其作用机制可能与减少胶原纤维增生、改善大鼠肝功能、降低炎症因子水平、恢复Th17/Treg平衡有关。
芪参汤;肝纤维化;辅助性T细胞17;调节性T细胞;大鼠
肝纤维化是各种慢性肝病如非酒精性脂肪性肝病、病毒性肝炎和血吸虫病等向终末期肝病发展的必经阶段,其共同病理表现为肝细胞外基质(即糖蛋白、胶原及蛋白多糖等)的异常分布与弥漫性过度沉积[1]。尽管不同致病因素下肝纤维化的发展和病理机制不同,且病理改变存在一定差异,但肝星状细胞(hepatic stellate cells,HSC)的活化及其向成纤维细胞和肌成纤维细胞的转化则是所有肝纤维化发展的中心环节。
HSC位于窦周间隙内,其活化受多种细胞因子和途径的调控。研究表明,Kupffer细胞、T淋巴细胞、自然杀伤细胞和B淋巴细胞等经典免疫细胞,以及肝窦内皮细胞和肝细胞等非经典免疫细胞能通过分泌不同细胞因子调控HSC的活化和细胞外基质的生成与降解[2]。辅助性T细胞17(Th17)与调节性T细胞(Treg)均来自同一前体细胞,且两者的平衡在维持内环境稳态中发挥重要作用[3-4]。有研究显示,肝纤维化小鼠中存在Th17/Treg失衡,且细胞实验结果显示,Treg能抑制Th17诱导的HSC活化[5-6]。因此,调控Th17/Treg平衡成为抑制HSC激活的重要途径。课题组前期研究表明,芪参汤能抑制HSC激活和调控细胞外基质的降解[7-9]。本研究通过流式细胞术检测肝纤维化大鼠肝组织中Th17、Treg的比例及转录因子维甲酸相关孤儿受体γt(ROR-γt)、叉头状转录因子p3(Foxp3)蛋白和mRNA的表达,进一步探讨芪参汤抑制肝纤维化的作用机制。
1 实验材料
1.1 动物
清洁级雄性SD大鼠40只,体质量240~260 g,购于北京维通利华实验动物技术有限公司,动物生产许可证号SCXK(京)2016-0011,动物使用许可证号SYXK(黑)2016-008。饲养于黑龙江省中医药科学院动物实验中心,温度22~24 ℃,相对湿度45%~50%,光/暗周期12 h,自由摄食饮水。实验过程严格遵循《实验动物管理与使用指南》有关规定[10]。
1.2 药物及制备
芪参汤(黄芪15 g,西洋参10 g,丹参10 g,山楂10 g,荷叶10 g,泽泻10 g,女贞子8 g,三七5 g,墨旱莲8 g,绞股蓝5 g,甘草3 g),黑龙江省中医药科学院制剂室制备,饮片经煎煮、过滤,浓缩至含原药材2 g/mL,置于-4 ℃冰箱保存备用。秋水仙碱,西双版纳药业有限公司,批号191121。
1.3 主要试剂与仪器
四氯化碳(CCl4),美国Sigma-Aldrich公司,货号488488;苏木素-伊红(HE)染液,南京建成生物工程研究所,货号D006-1-1;天狼猩红染色液,北京索莱宝科技有限公司,货号S8060;大鼠白细胞介素(IL)-17A、IL-10 ELISA试剂盒,江苏酶免实业有限公司,货号分别为MM-70049R2、MM-0195R2;转化生长因子-β1(TGF-β1)、α-平滑肌肌动蛋白(α-SMA)、ROR-γt、Foxp3、β-actin抗体,英国Abcam公司,货号分别为ab215715、ab7817、ab58670、ab215206、ab8227;IL-17A、CD4、CD25抗体,美国CST公司,货号分别为13838、96127、48127;Percoll淋巴细胞分离液,美国GE公司,货号17-0891-01;RNA提取试剂盒,美国Thermo Fisher公司,货号15596026;反转录试剂盒、SYBR Premix Ex Taq试剂盒,日本Takara公司,货号分别为639503、RR420。CX33光学显微镜,日本Olympus公司;Varioskan LUX多功能酶标仪、Attune NxT流式细胞仪、凝胶成像系统,美国Thermo Fisher公司;电泳仪、电泳槽,美国Bio-Rad公司;Cobas8000全自动生化仪,德国Roche公司。
2 实验方法
2.1 分组、造模及给药
40只SD大鼠随机分为空白组、模型组、芪参汤组及秋水仙碱组,每组10只。除空白组外,其余3组大鼠参照文献[11]方法腹腔注射20%CCl4(5 µL/g),每周2次,连续8周,空白组予等体积橄榄油溶液腹腔注射。造模期间,给药组参照人与动物等效剂量给予相应药物治疗,芪参汤组给予芪参汤药液(2 g/mL)灌胃,秋水仙碱组给予秋水仙碱混悬液(20 mg/L)灌胃,空白组和模型组给予等体积生理盐水。给药体积1 mL,1次/d,连续8周。末次给药后72 h,使用CO2窒息处死所有大鼠,腹主动脉取血后分离肝组织用于指标检测。
2.2 病理观察
取肝组织,4%多聚甲醛固定,石蜡包埋,切片(5 μm),分别采用HE染色及天狼猩红染色检测大鼠肝组织病理形态并进行肝纤维化评分,计算胶原染色面积。肝纤维化评分参照文献[12]标准:0分,无明显纤维化;1分,门脉区和中央静脉区可见少量纤维增生,无间隔形成;2分,门脉区和中央静脉区可见少量纤维增生及少量间隔形成;3分,大量胶原纤维增生及纤维间隔形成,可见少量假小叶形成;4分,大量胶原纤维增生并可见大量假小叶形成。
2.3 血清肝功能指标检测
将收集的外周血13 000 r/min离心10 min,收集上清液,采用全自动生化分析仪检测大鼠血清天冬氨酸氨基转移酶(AST)、丙氨酸氨基转移酶(ALT)及总胆红素(TBil)水平。
2.4 炎症因子检测
肝组织以预冷的PBS冲洗后剪碎,用玻璃匀浆器于冰浴中充分匀浆,4 ℃、13 000 r/min离心10 min,收集上清液。参照ELISA试剂盒说明书检测大鼠肝组织IL-17A和IL-10含量。
2.5 免疫组化检测
取石蜡切片,脱蜡至水,柠檬酸抗原修复液进行抗原修复;3%过氧化氢室温孵育15 min,PBS冲洗3次;甩干后加入稀释的α-SMA、TGF-β1一抗(1∶500),4 ℃孵育过夜;加入辣根过氧化物酶标记的二抗(1∶1 000),室温继续孵育40 min;PBS冲洗3次;甩干后加入新鲜配制的DAB染色液,室温孵育10 min;苏木素复染,梯度乙醇及二甲苯脱色、透明处理后,中性树胶封片,镜下观察,采用Image-Pro Plus 6.0计算阳性表达的积分光密度(IOD)。
2.6 流式细胞术检测
取适量肝组织剪碎,研磨后以200目不锈钢滤网过滤;用含10%血清的RPMI 1640培养液冲洗;4 ℃、500 r/min离心3 min,取上清液1 500 r/min离心10 min,弃上清;沉淀,于4 ℃用Percoll淋巴细胞分离液重悬,分离肝组织中淋巴细胞;PBS洗涤、重悬后,调整细胞密度为1×106个/mL;各组取0.5 mL细胞悬液至24孔板,加入稀释后的豆蔻酰佛波醇乙酯、离子霉素、布雷非德菌素A混合液进行诱导,37 ℃、5%CO2培养箱中继续培养6 h;2 000 r/min离心5 min,弃上清。Th17染色:加入FITC标记的CD4抗体,4 ℃、避光孵育30 min,PBS洗涤,加入Cytofix/ Cytoperm固定、破膜,洗涤,加入PE标记的IL-17A抗体进行细胞内染色,避光孵育30 min。Treg染色:加入FITC标记的CD4抗体和PE-Cy7标记的CD25抗体,4 ℃、避光孵育30 min,PBS洗涤后,加入Cytofix/Cytoperm固定、破膜,洗涤,加入PE标记的Foxp3抗体进行细胞内染色,避光孵育30 min。细胞洗涤后重悬,上机检测,并采用CXP分析软件计算Th17、Treg比例。
2.7 Western blot检测
取适量肝组织剪碎,加裂解液冰上裂解,离心;取上清液,以BCA法测定总蛋白浓度;加入15 μL蛋白样品进行电泳,转膜至PVDF膜,5%脱脂牛奶封闭2 h;分别加入稀释后的ROR-γt、Foxp3和β-actin一抗(1∶1 000),4 ℃孵育过夜;TBST洗膜5次,加入HRP标记二抗,室温继续孵育1 h;TBST洗膜5次;滴加ECL显影液,凝胶成像系统分析,计算目的蛋白条带的相对表达量。
2.8 RT-PCR检测
取适量肝组织剪碎,冰上裂解,Trizol法提取肝组织总RNA,参照Takara反转录试剂盒说明书进行反转录合成cDNA;将cDNA稀释后作为模板,按照SYBR Premix Ex Taq试剂盒说明书将各试剂混匀后上机检测。PCR引物序列见表1。反应条件:95 ℃预变性10 min,95 ℃变性10 s,60 ℃退火60 s,循环40次,终末60 ℃补延伸10 min。以GAPDH为内参,采用2-ΔΔCt法计算mRNA相对表达量。
表1 各基因PCR引物序列
基因名称基因序列(5’~3’)产物长度/bp ROR-γt上游:CTGGGCATGTCCCGAGATG119 下游:GGTCACCAGTTCTGGGGAG Foxp3上游:CACCTATGCCACCCTTATCCG124 下游:AGATGGTAACCAAATGAGCGTAC GAPDH上游:TGACCTCAACTACATGGTCTACA 85 下游:GTTCCGGCTCTTACCCTTC
3 统计学方法
4 结果
4.1 芪参汤对肝纤维化大鼠肝组织病理形态的影响
实验过程中模型组大鼠死亡3只,秋水仙碱组及芪参汤组各死亡1只。空白组大鼠肝组织中肝小叶结构清晰,肝索排列整齐,汇管区的动脉、静脉、中央静脉和胆管结构正常,有极少量胶原,肝窦和汇管区可见少量间质细胞。与空白组比较,模型组大鼠肝细胞排列紊乱,可见大量炎性细胞浸润和肝细胞坏死并有假小叶形成,汇管区与中央静脉区可见大量胶原沉积,肝纤维化评分明显增加,差异均有统计学意义(<0.05)。与模型组比较,芪参汤组和秋水仙碱组大鼠肝组织未见假小叶形成,肝细胞坏死和炎性细胞数量明显减少,肝小叶结构破坏和纤维化程度明显减轻,胶原染色面积、肝纤维化评分减少,差异有统计学意义(<0.05)。见图1、表2。

图1 各组大鼠肝组织形态(×400)

表2 各组大鼠肝纤维化评分及胶原染色面积比较(±s)
注:与空白组比较,*<0.05;与模型组比较,#<0.05
4.2 芪参汤对肝纤维化大鼠血清肝功能指标的影响
与空白组比较,模型组大鼠血清AST、ALT和TBil水平显著升高(<0.05);与模型组比较,芪参汤组及秋水仙碱组大鼠血清AST、ALT及TBil水平显著降低(<0.05)。见表3。

表3 各组大鼠血清AST、ALT、TBil水平比较(±s)
注:与空白组比较,*<0.05;与模型组比较,#<0.05
4.3 芪参汤对肝纤维化大鼠肝组织白细胞介素-17A、白细胞介素-10含量的影响
与空白组比较,模型组大鼠肝组织IL-17A含量显著增加,IL-10含量显著减少(<0.05);与模型组比较,芪参汤组和秋水仙碱组大鼠肝组织IL-17A含量显著减少,IL-10含量显著增加(<0.05)。见表4。

表4 各组大鼠肝组织IL-17A、IL-10含量比较(±s,pg/mL)
注:与空白组比较,*<0.05;与模型组比较,#<0.05
4.4 芪参汤对肝纤维化大鼠肝组织转化生长因子-β1、α-平滑肌肌动蛋白表达的影响
TGF-β1和α-SMA阳性结果表现为细胞浆的棕黄色细颗粒状染色。与空白组比较,模型组大鼠肝组织TGF-β1、α-SMA蛋白表达显著升高(<0.05);与模型组比较,芪参汤组和秋水仙碱组大鼠肝组织TGF-β1、α-SMA蛋白表达显著降低(<0.05)。见表5、图2。
4.5 芪参汤对肝纤维化大鼠肝组织辅助性T细胞17、调节性T细胞水平的影响
与空白组比较,模型组大鼠肝组织Th17比例和Th17/Treg比值显著增加,Treg比例显著减少(<0.05);与模型组比较,芪参汤组和秋水仙碱组大鼠肝组织Th17比例和Th17/Treg比值显著降低,Treg比例显著增加(<0.05)。见图3、表6。
4.6 芪参汤对肝纤维化大鼠肝组织维甲酸相关孤儿受体γt、叉头状转录因子p3蛋白表达的影响
与空白组比较,模型组大鼠肝组织ROR-γt蛋白表达显著升高,Foxp3蛋白表达显著降低(<0.05);与模型组比较,芪参汤组和秋水仙碱组大鼠肝组织ROR-γt蛋白表达显著降低,Foxp3蛋白表达显著升高(<0.05)。见图4、表7。

表5 各组大鼠肝组织TGF-β1、α-SMA蛋白表达比较(±s,IOD)
注:与空白组比较,*<0.05;与模型组比较,#<0.05
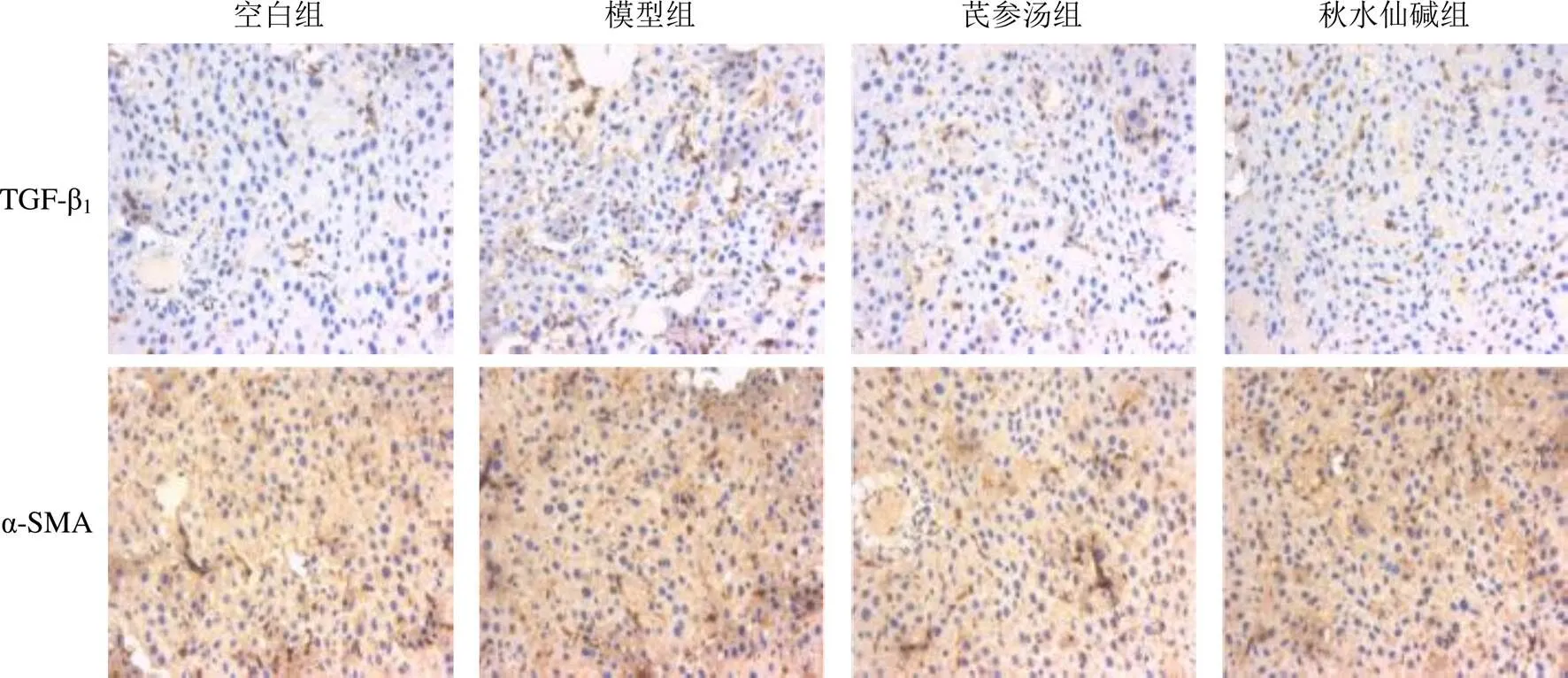
图2 各组大鼠肝组织TGF-β1、α-SMA阳性表达(免疫组化染色,×400)

图3 各组大鼠肝组织Th17、Treg检测流式细胞图

表6 各组大鼠肝组织Th17、Treg比例及Th17/Treg比值比较(±s)
注:与空白组比较,*<0.05;与模型组比较,#<0.05

注:A.空白组;B.模型组;C.芪参汤组;D.秋水仙碱组

表7 各组大鼠肝组织ROR-γt、Foxp3蛋白表达比较(±s)
注:与空白组比较,*<0.05;与模型组比较,#<0.05
4.7 芪参汤对肝纤维化大鼠肝组织维甲酸相关孤儿受体γt、叉头状转录因子p3 mRNA表达的影响
与空白组比较,模型组大鼠肝组织ROR-γt mRNA表达显著升高(<0.05);与模型组比较,芪参汤组和秋水仙碱组大鼠肝组织ROR-γt mRNA表达显著降低(<0.05)。各组Foxp3 mRNA表达无明显变化(>0.05)。见表8。

表8 各组大鼠肝组织ROR-γt、Foxp3 mRNA表达比较(±s)
注:与空白组比较,*<0.05;与模型组比较,#<0.05
5 讨论
Th17是近年来发现的一种新型CD4+T细胞亚群,在多种免疫系统疾病、感染性疾病和肿瘤的发病过程中发挥重要作用。Th17主要通过分泌特征性炎症因子如IL-17A、IL-21和IL-22等参与自身免疫性肝病、病毒性肝炎和非酒精性脂肪性肝病的发病[13]。黄小丽等[14]研究发现,在CCl4诱导的肝纤维化小鼠模型中,Th17比例和IL-17含量明显增加,且与α-SMA的表达呈显著正相关。同时,Tan等[15]研究表明,IL-17能提高HSC中TGF-β、IL-6、胶原蛋白和α-SMA的表达,表明IL-17具有促进肝纤维化的作用。作为RORs家族成员之一,ROR-γt特征性表达于CD4+CD8+T淋巴细胞,是Th17分化的关键转录因子[16-17]。ROR-γt可激活IL-17基因,促使其他因子结合至IL-17的启动子上,进而上调CD4+T淋巴细胞中IL-17的转录水平[18]。本研究结果显示,芪参汤能显著改善肝纤维化大鼠肝组织病理形态和肝功能水平。同时,芪参汤能显著抑制肝组织ROR-γt mRNA和蛋白的表达,从而抑制Th0向Th17分化。TGF-β1主要来源于HSC和肝实质细胞,是目前已知最强的促肝纤维化细胞因子,参与肝纤维化的关键关节[19]。α-SMA是HSC活化的标志,通过参与合成Ⅰ型胶原、Ⅲ型胶原和纤维连接蛋白等细胞外基质,促进肝纤维化的发生[20]。本研究结果显示,芪参汤能显著抑制大鼠肝组织TGF-β1和α-SMA蛋白的表达。
Treg是一类具有抑制效应的T细胞亚群,主要通过分泌IL-10及IL-35等细胞因子抑制树突状细胞、T细胞、B细胞、单核/巨噬细胞和自然杀伤细胞的联系、免疫活性和增殖水平,进而介导机体对外源性和内源性抗原的免疫耐受和维持自身免疫平衡[21]。研究表明,当Treg与脂多糖诱导的HSC共培养时,IL-10的表达水平显著上调,而IL-10被证实具有抑制HSC活化和拮抗肝纤维化进程的作用[22]。进一步提示Treg可能通过上调肝组织IL-10的表达,抑制炎症反应和HSC活化,从而发挥抑制肝纤维化的作用。Foxp3是Treg重要的转录因子,同时也是CD25+Treg的标志分子。研究表明,Foxp3功能缺陷可导致Treg功能异常,同时,Foxp3能通过与ROR-γt结合而减少Th17分化[23]。本研究结果表明,芪参汤能显著上调大鼠肝组织Treg比例和Foxp3蛋白表达,降低肝组织Th17/Treg比值。由于Foxp3基因在诱导表达过程中受一系列生理信号和蛋白修饰严格调控,如miR-17能靶向辅助调节因子引起Foxp3稳定性减弱,从而降低Treg的免疫抑制功能[24-25]。本研究中肝组织Foxp3 mRNA表达无显著差异,因此推测芪参汤可能通过促进Foxp3蛋白修饰而增加Foxp3稳定性。
芪参汤是黑龙江省中医药科学院脾胃病科张雅丽教授治疗肝纤维化的经验方,具有益气养阴、活血化瘀、祛痰通络功效。方中黄芪为补气之要药,具有温补脾虚、利尿祛湿作用;西洋参味苦、微甘,性凉,具有补气养阴、清热生津功效。两者共为君药。研究表明,黄芪中微量元素硒可提高谷胱甘肽过氧化物酶活性,降低转氨酶并保护肝细胞膜[26]。丹参味苦,性微温,具有活血化瘀功效;山楂酸、甘,性微温,具有行气散瘀、消食健胃功效;荷叶味苦,性平,具有升阳健脾、消食化湿功效;泽泻味甘,性寒,能利水渗湿、降脂化浊。以上四味共为臣药。研究表明,荷叶中主要活性成分荷叶碱能抑制SREBP信号通路激活,进而发挥对非酒精性脂肪性肝病小鼠肝组织损伤的保护作用[27]。佐以墨旱莲、女贞子补肾养肝,绞股蓝、三七祛湿化痰、化瘀通络。动物实验表明,绞股蓝总皂苷可抑制线粒体通路介导的肝细胞凋亡,发挥抗大鼠肝纤维化的作用[28-29]。再以甘草补气健脾,调和诸药。本方既可治脾气虚弱、肝肾阴虚之本,又除瘀、湿、痰、食之标,以扶正为本,标本兼治。
综上所述,芪参汤可减少大鼠肝组织胶原纤维增生,改善大鼠肝功能,降低炎症水平,恢复肝组织Th17/Treg平衡,发挥抗肝纤维化的作用。
[1] 周光德,赵景民.不同病因致肝纤维化/肝硬化的病理特点[J].临床肝胆病杂志,2016,32(6):1086-1091.
[2] 张伟,贾继东.肝纤维化的发病机制及治疗新靶点[J].临床肝胆病杂志,2017,33(3):409-412.
[3] 李伟平,吴巍,何卫美,等.Treg/Th17对小鼠非酒精性脂肪性肝炎的影响研究[J].浙江医学,2018,40(14):1536-1539,1654.
[4] 张佳乐,陈真.Th17/Treg失衡在肝纤维化中的研究进展[J].安徽医药,2015,19(7):1225-1228.
[5] GU L, DENG W S, SUN X F, et al. Rapamycin ameliorates CCl4-induced liver fibrosis in mice through reciprocal regulation of the Th17/Treg cell balance[J]. Mol Med Rep,2016,14(2):1153-1161.
[6] SUN X F, GU L, DENG W S, et al. Impaired balance of T helper 17/T regulatory cells in carbon tetrachloride-induced liver fibrosis in mice[J]. World J Gastroenterol,2014,20(8):2062-2070.
[7] 毛旭,袁星星,杨磊,等.芪参汤通过细胞自噬对肝窦内皮细胞去分化的影响[J].海南医学院学报,2020,26(16):1222-1227.
[8] 李硕熙,王炳予,杨磊,等.芪参汤通过PI3K/Akt/mTOR信号通路抗肝纤维化的机制研究[J].海南医学院学报,2020,26(12):905-909,914.
[9] 袁星星,郭蕾,王炳予,等.芪参二莲汤对肝纤维化大鼠血清基质金属蛋白酶-1及其抑制剂-1水平的影响[J].中国中医药信息杂志,2017, 24(5):52-56.
[10] 贺争鸣.实验动物管理与使用指南[M].北京:科学出版社,2016:142- 150.
[11] 魏晓光,郭辉,陈永珍,等.腹腔注射四氯化碳建立大鼠肝纤维化模型[J].实验室研究与探索,2015,34(11):34-37.
[12] 胡烨,张国.肝纤维化诊断及其严重程度评估[J].实用肝脏病杂志, 2017,20(1):13-16.
[13] 薛芝敏,姚冬梅.Th17细胞与肝脏疾病关系的研究进展[J].世界华人消化杂志,2013,21(13):1185-1190.
[14] 黄小丽,郭晓云,姜海行,等.Th17及Th1细胞在四氯化碳致肝纤维化小鼠模型中的表达及关系[J].世界华人消化杂志,2014,22(13):1826- 1833.
[15] TAN Z, QIAN X, JIANG R, et al. IL-17A plays a critical role in the pathogenesis of liver fibrosis through hepatic stellate cell activation[J]. J Immunol,2013,191(4):1835-1844.
[16] 张伟,涂敏芳,邓焕华.转录因子ROR-γt与Th17介导的中性粒细胞性哮喘[J].中国免疫学杂志,2018,34(9):1366-1371.
[17] SINGH A K, KHARE P, OBAID A, et al. SUMOylation of ROR-γt inhibits IL-17 expression and inflammation via HDAC2[J]. Nat Commun,2018,9(1):4515.
[18] CASTRO G, LIU X, NGO K, et al. RORγt and RORα signature genes in human Th17 cells[J]. PLoS One,2017,12(8):e0181868.
[19] 王乐,丁腾,龚伟玲,等.调控TGF-β1/Smads信号通路抗肝纤维化的中药有效成分研究进展[J].中国中药杂志,2019,44(4):666-674.
[20] 原冬伟,刘秋瑾,刘宏睿,等.α-SMA与TGF-β1在大鼠肝纤维化中的表达及相互关系[J].黑龙江八一农垦大学学报,2017,29(5):33-36,98.
[21] 王十锦,张蓓,王丽,等.大鼠肝损伤模型中Th17/Treg失衡的研究[J].免疫学杂志,2014,30(2):133-138.
[22] 黄月红,陈运新,张莉娟,等.尾静脉注射大鼠IL-10真核表达质粒对肝纤维化的拮抗作用及对星状细胞活化的影响[J].细胞与分子免疫学杂志,2013,29(11):1163-1165,1173.
[23] 杨爽,倪兵.Treg细胞中关键转录因子Foxp3相互作用蛋白的鉴定与分析[J].免疫学杂志,2015,31(4):283-287,292.
[24] YANG H Y, BARBI J, WU C Y, et al. MicroRNA-17 modulates regulatory T cell function by targeting co-regulators of the Foxp3 transcription factor[J]. Immunity,2016,45(1):83-93.
[25] 赵启航,梁瑞,李丹,等.Foxp3+调节性T细胞分化发育及其功能稳定性研究进展[J].南京医科大学学报(自然科学版),2017,37(1):1-9,80.
[26] 代鲜敏,黄思,孙旸,等.黄芪对非酒精性脂肪肝的影响及潜在机制[J].中华中医药学刊,2021,39(3):222-225.
[27] 何冰,高雁鸿,孙华,等.荷叶碱对非酒精性脂肪肝模型小鼠肝组织中SREBP信号通路的影响[J].天津中医药大学学报,2020,39(3):320-323.
[28] 陈亮,彭景华,冯琴,等.绞股蓝总皂苷对四氯化碳诱导的大鼠肝纤维化肝细胞凋亡的影响[J].中华中医药杂志,2015,30(1):211-215.
[29] 冯琴,李雪梅,彭景华,等.绞股蓝总皂苷对二甲基亚硝胺诱导的大鼠肝纤维化的防治作用[J].中国中药杂志,2012,37(4):505-508.
Effects ofDecoction on Th17/Treg Cell Balance in Rats with Liver Fibrosis
YUAN Wei1,2, WANG Bingyu3, YANG Lei3, YUAN Xingxing3
To investigate the effects ofDecoction on Th17/Treg balance in liver tissue of rats with liver fibrosis; To explore its anti-liver fibrosis mechanism.Totally 40 SD rats were randomly divided into control group, model group,Decoction group and colchicine group, with 10 rats in each group. Liver fibrosis model was established by carbon tetrachloride intraperitoneal injection. During the modeling period,Decoction group (2 g/mL) and colchicine group (20 mg/L) were given corresponding drug intragastric treatment, while the control group and model group were given equal volume of normal saline, once a day for 8 weeks. The serum AST, ALT, and TBil levels were detecteed by autormatic biochemical analyzer. The contents of IL-17A and IL-10 in liver tissue were detected by ELISA. The protein and mRNA expressions of TGF-β1and α-SMA protein in liver tissue were detected by immunohistochemistry. The proportions of Th17 and Treg cells of liver were detected by flow cytometry. The protein and mRNA expressions of ROR-γt and Foxp3 in liver tissue were detected by Western blot and RT-PCR.Compared with the control group, rat liver fibrosis score and collagen staining area significantly increased (<0.05); serum AST, ALT, TBil levels significantly increased (<0.05), IL-17A content significantly increased, and IL-10 content was significantly reduced (<0.05); TGF-β1and α-SMA protein expression in liver tissue significantly increased (<0.05); Th17 ratio increased, Treg ratio decreased, Th17/Treg ratio increased significantly (<0.05); ROR-γt protein and mRNA expression in liver tissue significantly increased, and the Foxp3 protein expression significantly decreased (<0.05). Compared with the model group, the liver fibrosis score and collagen staining area ofDecoction group and colchicine group were significantly reduced (<0.05); the serum AST, ALT, and TBil levels were significantly reduced (<0.05); the IL-17A content significant decreased, and IL-10 content significantly increased (<0.05); expressions of TGF-β1and α-SMA protein in liver tissue were significantly reduced (<0.05); Th17 ratio decreased, Treg ratio increased, and Th17/Treg ratio decreased significantly (<0.05); the expression of ROR-γt protein and mRNA in liver tissue was significantly reduced, and the expression of Foxp3 protein significantly increased (<0.05).Decoction can inhibit liver fibrosis in rats, and its mechanism of action may be related to reducing collagen fiber proliferation, improving rat liver function, reducing inflammatory factor levels, and restoring Th17/Treg balance.
Decoction; liver fibrosis; Th17; Treg; rats
R285.5
A
1005-5304(2021)08-0066-07
10.19879/j.cnki.1005-5304.202012333

国家自然科学基金青年基金(81904182);湖南省自然科学基金(2020JJ5441);湖南省卫生计生委科研计划(20200752);黑龙江省中医药科研项目(ZHY18-029、ZHY19-061、ZHY19-062、ZHY2020-041);黑龙江省自然科学基金联合引导项目(LH2019H095)
袁星星,E-mail:jackieaqi@163.com
(收稿日期:2020-12-19)
(修回日期:2021-01-10;编辑:华强)
