基于16S rDNA技术分析化瘀温胆汤对糖耐量受损大鼠肠道菌群的影响
2021-08-14田苗周迎春孙丹李卫忠樊德慧韩宇博刘莉张福利
田苗,周迎春,孙丹,李卫忠,樊德慧,韩宇博,刘莉,张福利
基于16S rDNA技术分析化瘀温胆汤对糖耐量受损大鼠肠道菌群的影响
田苗1,周迎春1,孙丹2,李卫忠1,樊德慧1,韩宇博2,刘莉2,张福利1
1.黑龙江中医药大学,黑龙江 哈尔滨 150040; 2.黑龙江中药大学附属第一医院,黑龙江 哈尔滨 150040
基于16S rDNA技术分析糖耐量受损(IGT)大鼠肠道菌群结构特征,初步探讨化瘀温胆汤可能的干预机制。70只雄性SD大鼠中随机抽取10只作为空白组,其余60只予高脂高糖饲料喂养21周构建IGT大鼠模型,抽取30只IGT模型大鼠随机分为模型组、化瘀温胆汤组和二甲双胍组,每组10只。化瘀温胆汤组给予中药水煎剂灌胃,二甲双胍组给予二甲双胍悬浊液灌胃,空白组及模型组给予生理盐水灌胃。药物干预4周后测定大鼠空腹血糖(FPG)及灌胃葡萄糖溶液后2 h血糖(2 h PG),采集结肠内粪便,利用16S rDNA技术,基于OTU聚类结果,分析样本菌群的多样性和丰度,同时分析各样本在门、属水平的物种组成。基于OTU的韦恩图结果显示,有445个OTU为4组共有,4组间相似性较高,其中空白组和模型组相似性最低。α多样性分析显示,与空白组比较,模型组α多样性指数下降,化瘀温胆汤组、二甲双胍组α多样性指数显著升高。菌群均匀度和菌群丰度从高到低依次为空白组、化瘀温胆汤组、二甲双胍组、模型组。物种相对丰度结果显示,门水平各样本以厚壁菌门(Firmicutes)为优势菌,Saccharibacteria在空白组数量最多,模型组数量最少,广古菌门(Euryarchaeota)在空白组数量最多,模型组该门几乎为零;属水平各样本以乳酸菌属()数量最多,在空白组数量最少,模型组数量最多。群落结构差异性分析显示,组间两两比较,肠道菌群分布具有明显差异性。IGT大鼠肠道菌群稳态失衡,菌群多样性及丰度在一定程度上降低,化瘀温胆汤可能通过提高肠道菌群多样性和相对丰度影响IGT大鼠肠道菌群稳态。
化瘀温胆汤;糖耐量受损;肠道菌群;16S rDNA技术;大鼠
糖耐量受损(impaired glucose tolerance,IGT)是介于正常状态与糖尿病之间的机体代谢异常阶段,属糖尿病前期。随着生活方式改变,糖尿病及糖尿病前期发病率逐年增加[1]。国际糖尿病联合会保守估计,至2045年全球20~79岁人群将有5.48亿人患有IGT[2]。IGT不仅增加糖尿病的发病风险,同时还增加心血管疾病的发病率和病死率[1]。因此,积极筛查并干预IGT,对降低糖尿病发病率、减少各种并发症所导致的危害具有重要意义。肠道菌群作为染色体之外的第二基因组,其结构、代谢及功能失调是代谢性疾病发生发展的重要原因。近期研究发现,肠道菌群参与脂质和碳水化合物的代谢及激素水平的调节,影响机体的新陈代谢[3]。肠道菌群与宿主相互作用,可通过影响宿主的胰岛素分泌及胰岛素敏感性,使机体产生慢性炎症和胰岛素抵抗,诱发IGT、肥胖、糖尿病、代谢综合征等,而上述疾病又可加重肠道菌群紊乱[4-5]。此外,肠道菌群失调被认为是促进2型糖尿病(T2DM)胰岛素抵抗快速进展的因素,占全世界所有糖尿病病例的90%[6-7]。因此,对肠道菌群失调进行早期干预,可能是今后防治糖尿病等代谢性疾病的新方向。
化瘀温胆汤治疗IGT、糖尿病、代谢综合征等糖脂紊乱性疾病临床疗效显著[8-9]。前期研究显示,化瘀温胆汤可有效改善IGT大鼠血糖、血脂、胰岛素抵抗相关指标,调节糖脂代谢紊乱,延缓疾病的发展[10-11]。基于肠道菌群与糖脂代谢的相关性,本实验通过16S rDNA技术手段研究IGT大鼠肠道菌群物种组成及其多样性的差异,以明确化瘀温胆汤是否可能通过影响肠道菌群达到防治IGT的目的。
1 实验材料
1.1 动物
70只SPF级雄性SD大鼠,体质量(180±20)g,黑龙江中医药大学实验动物中心提供,动物生产许可证号SCXK(黑)2015006,动物使用许可证号SYXK(黑)2015007。饲养于温度20~25 ℃,相对湿度50%~70%环境,自由摄食饮水。
1.2 药物及制备
化瘀温胆汤(法半夏、枳实、竹茹各10 g,陈皮、酒白芍、葛根各15 g,茯苓、黄芩、三七各7.5 g,生姜、甘草、大枣各5 g),上述饮片均购于黑龙江中医药大学附属第一医院草药局,并由黑龙江中医药大学药学院生药学教研室鉴定符合药典规定。化瘀温胆汤按照前期研究进行制备[12],并制成浓度为含原药材1.25 g/mL,置于4 ℃冰箱保存。盐酸二甲双胍片,购于中美上海施贵宝制药有限公司,批号20150824,加无菌蒸馏水将其(500 mg)研磨至粉末状溶解,制成5 mg/mL盐酸二甲双胍悬浊液。
1.3 主要试剂与仪器
QIAamp DNA Stool Mini Kit(Qiagen,货号51504),QIAquick Spin Handbook(Qiagen,货号28304),DL2000 DNA Marker(Takara,货号3427A),10×Loading Buffer(Takara,货号9157),DNA Polymerase mix(Takara,货号RR001Q),GelRed(Biotium,货号41001-T)。ACCU-CHEK微量血糖仪(德国罗氏),SORVALL ST8/8R型低温离心机(美国Thermo),SC-320D型4 ℃冰箱(海尔公司),E-Centrifuge-6型小型掌上离心机(WEALTEC),Tissue lyser-24型全自动样品快速研磨仪(上海净信科技),IMS-50型制冰机(雪科公司),Select Cycler ⅡPCR仪(美国SBP)。
2 实验方法
2.1 造模
适应性喂养1周后,将SD大鼠随机分为空白组10只和造模组60只。造模组予高脂高糖饲料(猪油15%,蛋黄粉15%,蔗糖15%,食盐1.5%,啮齿类动物普通饲料53.5%),空白组予啮齿类动物普通饲料。参照前期研究[13],于21周末测定空腹血糖(FPG)和腹腔注射葡萄糖后2 h血糖(2 h PG)并进行模型筛选,以FPG<5.6 mmol/L,7.8 mmol/L≤2 h PG≤11.1 mmol/L作为IGT大鼠造模成功的参考标准[14-15]。
2.2 分组及给药
抽取30只成模大鼠,随机分为模型组、化瘀温胆汤组和二甲双胍组,每组10只。化瘀温胆汤组予化瘀温胆汤水煎剂1.25 g/mL灌胃(按人与动物体表面积折算等效剂量,相当于临床剂量1.875 g/kg),二甲双胍组给予盐酸二甲双胍悬浊液5 mg/mL灌胃,给药体积均为2 mL/100 g,空白组及模型组予等体积生理盐水灌胃,持续干预4周。
2.3 标本采集
25周末测定大鼠FPG及2 h PG后,利用异氟烷进行麻醉,大鼠沿胸骨剪开,暴露心脏,进行心脏采血,静置1 h,3 000 r/min离心15 min,收集血清,-20 ℃保存。心脏取血后,剪开大鼠盲肠约2 cm,取结肠0.2~0.4 g粪便放入已经灭菌的冻存管中,置于-80 ℃冰箱保存。
2.4 指标检测
2.4.1 空腹血糖及2 h血糖测定
干预结束(25周)前1日禁食水12 h,于次日8时剪尾尖取血,使用微量血糖仪测FPG;随后予大鼠50%葡萄糖溶液2 g/kg灌胃,2 h后用微量血糖仪检测大鼠2 h PG。
2.4.2 高通量测序检测肠道菌群
利用随机数字表法每组取6只大鼠结肠内粪便,进行肠道菌群的高通量测序分析。
2.4.3 粪便DNA提取
按照QIAamp粪便DNA小提试剂盒说明书对粪便样本进行DNA提取,所得核酸浓度皆满足扩增要求。
2.4.4 PCR扩增及PCR产物纯化
以提取到的DNA(30~50 ng)为模板,PCR扩增16S rDNA基因V3~V4区(上游引物:5’-TCCTACGGGAGGCAGCAGT-3’;下游引物:5’-GGACTACCAGGGTATCTAATCCTGTT-3’)。扩增反应条件:95 ℃,10 s;(95 ℃,5 s;58 ℃,10 s;72 ℃,15 s)×35次循环;4 ℃,+∞。使用1%琼脂糖凝胶对PCR产物进行电泳检测。根据QIAquick试剂盒说明书对所得PCR产物进行纯化,用于后续检测。
2.4.5 高通量测序
使用Agilent2100生物分析仪及Qubit2.0 Fluorometer构建文库并对文库进行浓度和质量检测。DNA文库混合后,利用Illumina MiSeq进行双端测序,MiSeq读取序列信息,并将得到的正反向reads进行两两组装连接,经序列质量过滤,最终得到的序列用于OTU分析,使用VSEARCH(1.9.6)进行序列聚类(序列相似性设为97%),然后用RDP classifier贝叶斯算法对OTU的代表性序列进行物种分类学分析并统计群落组成。基于OTU的分析结果,分析大鼠肠道菌群相似性,α多样性,门、属水平物种分布情况,以及通过Anosim分析各组肠道菌群群落结构差异。
3 统计学方法
4 结果
4.1 化瘀温胆汤对模型大鼠血糖的影响
与空白组比较,模型组大鼠FPG、2 h PG明显升高(<0.01);与模型组比较,化瘀温胆汤组和二甲双胍组大鼠FPG、2 h PG明显下降(<0.05,<0.01)。结果见表1。
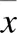
表1 各组大鼠FPG、2 h PG比较(±s,mmol/L)
注:与空白组比较,##<0.01;与模型组比较,*<0.05,**<0.01
4.2 化瘀温胆汤对模型大鼠肠道菌群相似度的影响
将优化后有效序列提取unique序列,进行OTU聚类,将所有优化后序列与OTU代表序列进行比对,与OTU代表序列相似性≥97%序列为同一OTU,24个大鼠粪便样本共获得OTU 649个,每个样本OTU个数分布见图1。韦恩图用于分析多个样本/分组共有和特有的OTU,见图2。24个大鼠粪便样本共获得OTU 649个,其中4组共有OTU 445个,表明4组间OTU代表序列相似性较高,与化瘀温胆汤组、二甲双胍组比较,空白组与模型组OTU相似性最低。
4.3 化瘀温胆汤对模型大鼠肠道菌群多样性的影响
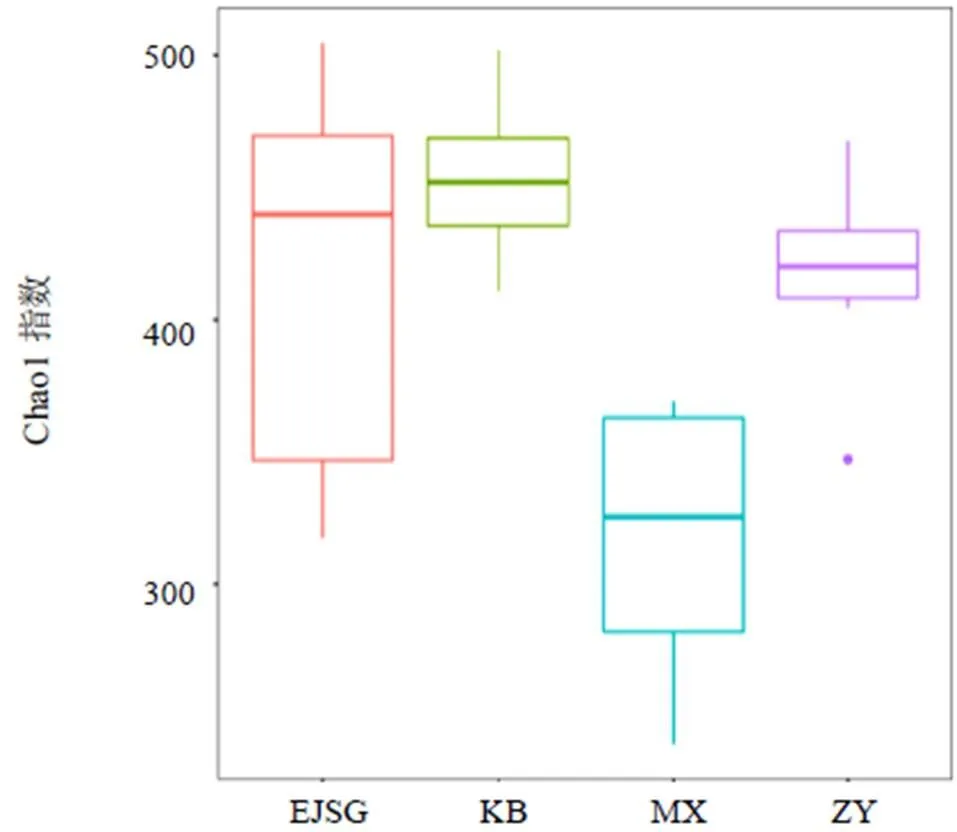
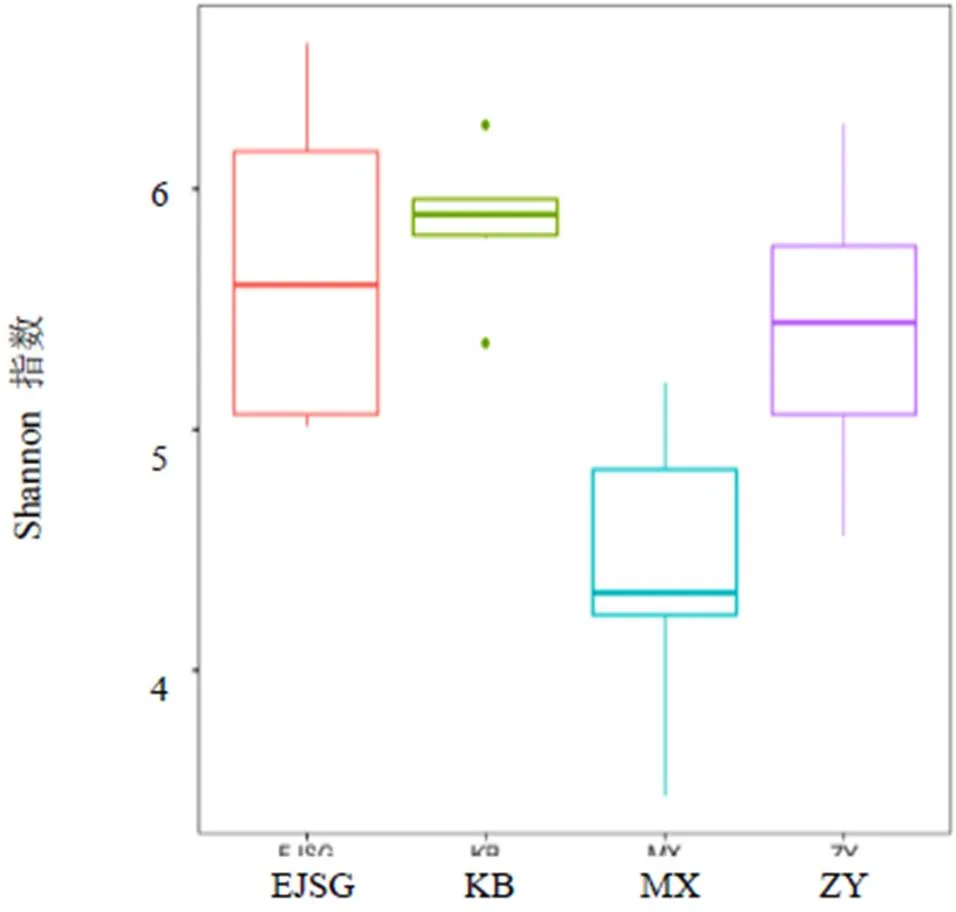
α多样性可反映微生物群落中物种数目,通过ACE、Chao1计算菌群丰度,Shannon、Simpson计算菌群多样性。ACE则用来计算群落中含有OTU数目的指数。Chao1是用来计算样本中所含OTU数目的指数。Shannon常用于反映α多样性,用来估算样本中微生物多样性,Simpson常用于定量描述一个区域的生物多样性。对随机抽到的有效序列数进行OTU的分析,并计算其各α多样性指数。
与空白组比较,模型组大鼠肠道菌群α多样性指数明显下降(<0.01);与模型组比较,化瘀温胆汤组、二甲双胍组大鼠肠道菌群α多样性指数显著升高(<0.01)。见表2。以Chao1指数和Shannon指数为例,组间差异分析箱线图见图3、图4。
4.4 化瘀温胆汤对模型大鼠肠道菌群结构组成的影响
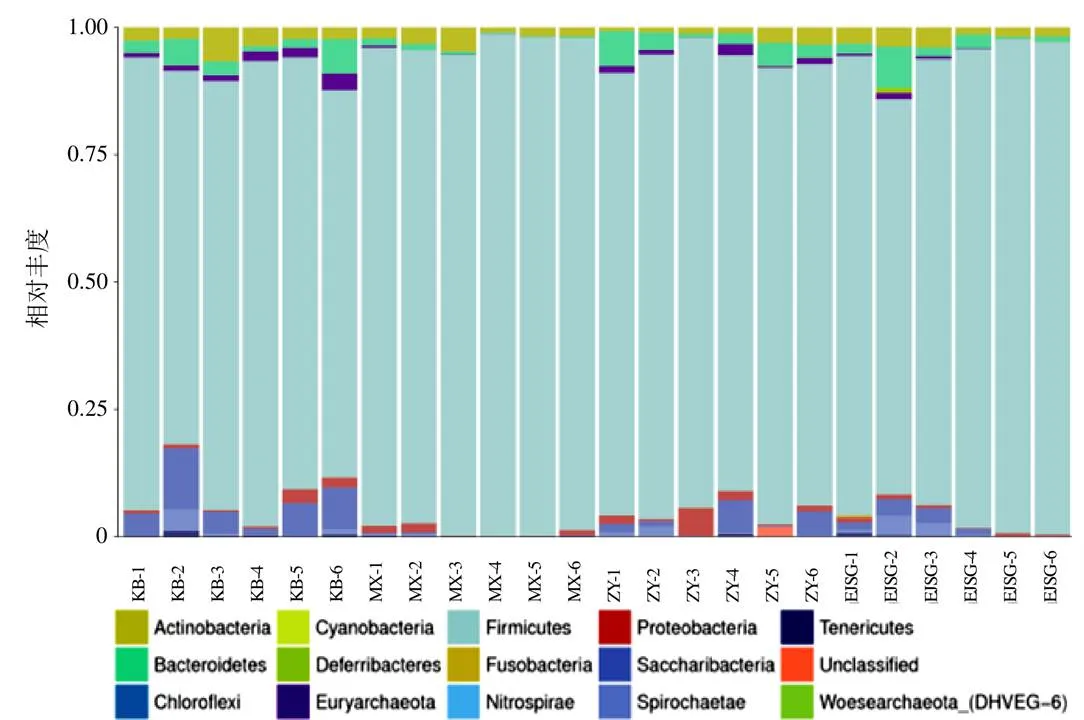
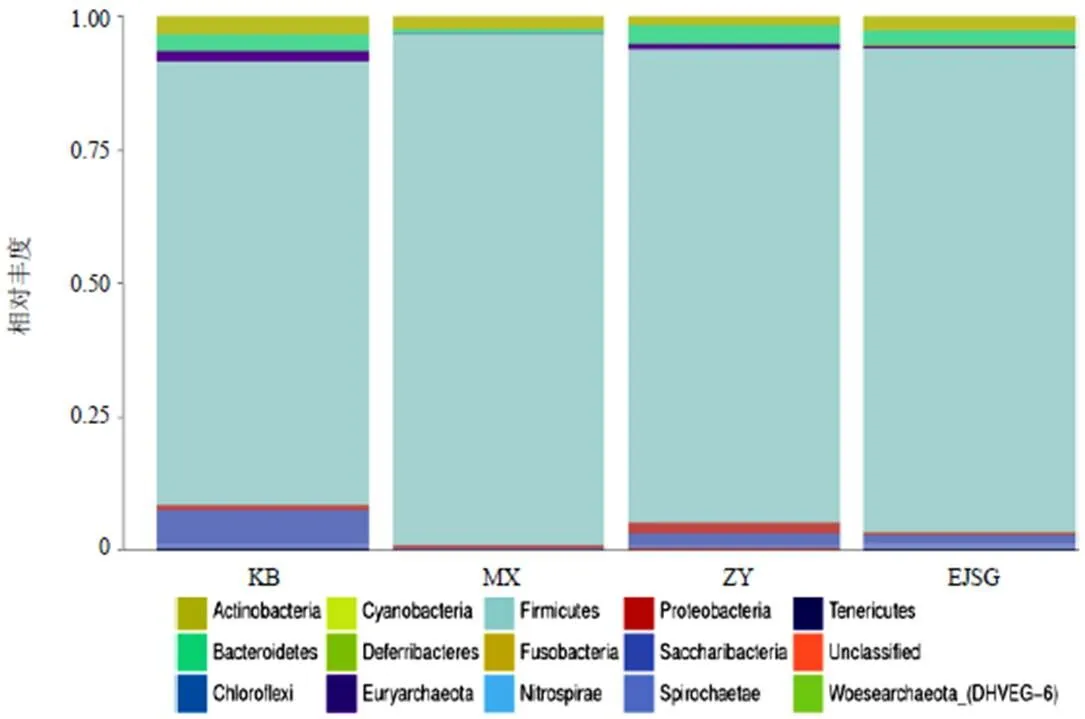
门水平各样本中厚壁菌门(Firmicutes)数量最多,为优势菌,Saccharibacteria、脱铁杆菌门(Deferribacteres)、梭杆菌门(Fusobacteria)次之,见图5。组间比较Saccharibacteria在空白组数量最多,模型组数量最少;广古菌门(Euryarchaeota)在空白组数量最多,模型组该门几乎为零,见图6。
注:KB-1~KB-6.空白组;MX-1~MX-6.模型组;ZY-1~ZY-6.化瘀温胆汤组;EJSG-1~EJSG-6.二甲双胍组
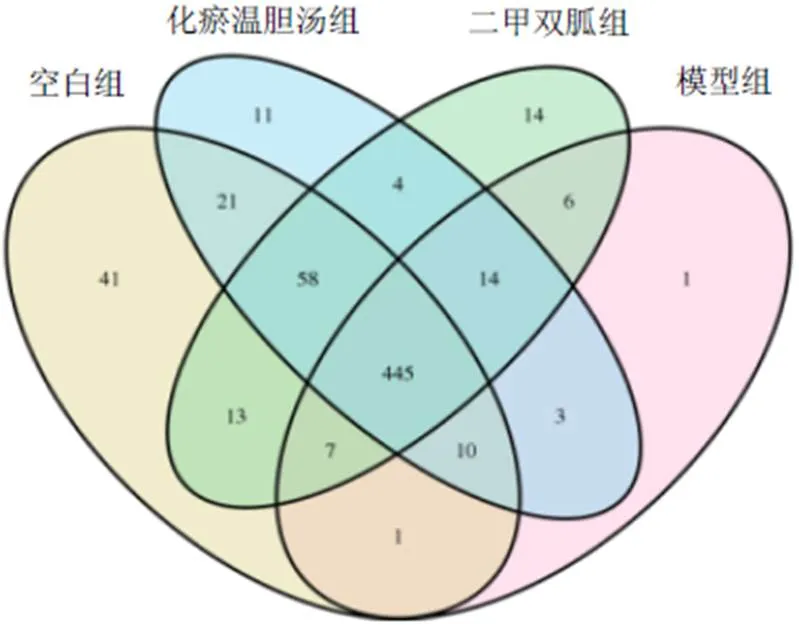
图2 各组大鼠OTU分布韦恩图
表2 各组大鼠肠道菌群α多样性指数比较(±s)
注:与空白组比较,##<0.01;与模型组比较,**<0.01
注:KB.空白组;MX.模型组;ZY.化瘀温胆汤组;EJSG.二甲双胍组
注:KB.空白组;MX.模型组;ZY.化瘀温胆汤组;EJSG.二甲双胍组
注:KB-1~KB-6.空白组;MX-1~MX-6.模型组;ZY-1~ZY-6.化瘀温胆汤组;EJSG-1~EJSG-6.二甲双胍组
注:KB.空白组;MX.模型组;ZY.化瘀温胆汤组;EJSG.二甲双胍组
属水平各样本中乳酸菌属()数量最多,未分类(Unclassified)、布劳特氏菌属()、次之,见图7。在空白组数量最少,模型组数量最多,见图8。
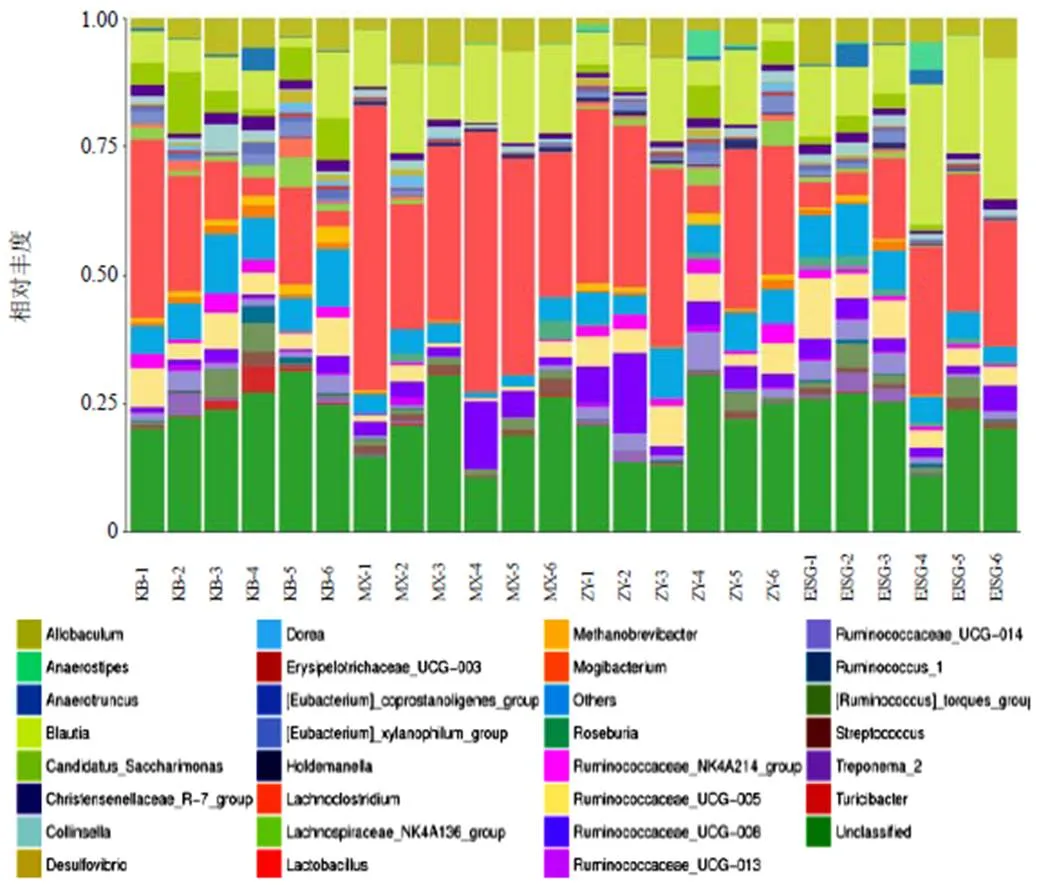
注:KB-1~KB-6.空白组;MX-1~MX-6.模型组;ZY-1~ZY-6.化瘀温胆汤组;EJSG-1~EJSG-6.二甲双胍组
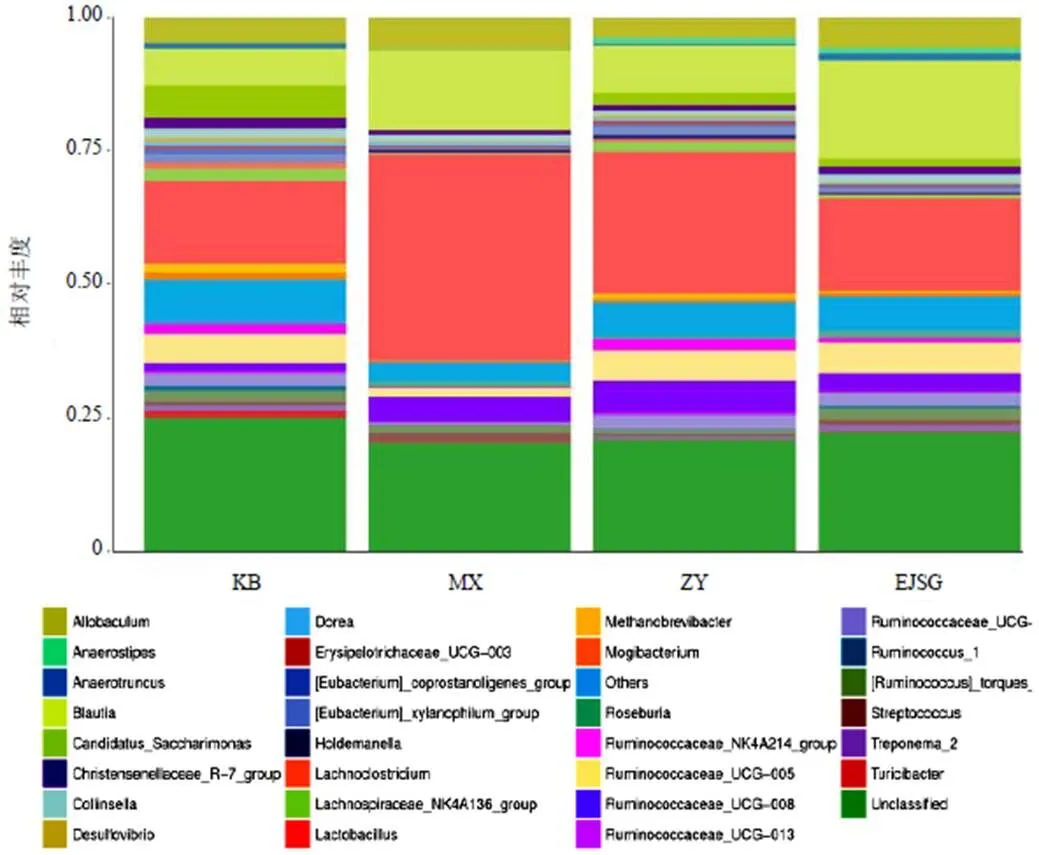
注:KB.空白组;MX.模型组;ZY.化瘀温胆汤组;EJSG.二甲双胍组
4.5 肠道菌群群落结构差异分析结果
Anosim组间差异分析通过对样本间距离矩阵的分析,得到值和值。4组两两比较,肠道菌群群落结构差异有统计学意义(<0.05)。见表3。
表3 各组大鼠肠道菌群群落结构Anosim分析
分组因子R值P值 空白组vs二甲双胍组0.5240.002 空白组vs模型组0.8130.005 空白组vs化瘀温胆汤组0.3190.019 模型组vs二甲双胍组0.2720.039 模型组vs化瘀温胆汤组0.4500.011 化瘀温胆汤组vs二甲双胍组0.4070.009
注:值范围[-1,1],值接近0表示组间和组内无明显差异,值接近1表示组间差异大于组内差异;值表示统计分析可信度
5 讨论
IGT是正常糖耐量转化为糖尿病的过渡阶段,以餐后血糖升高为主要临床表现,是糖尿病发生的必经阶段,具有可逆性。因此,有效改善IGT符合中医治未病思想。根据临床表现,IGT可归属于中医学“脾瘅”“消渴”等范畴,其病机主要包含阴虚、脾虚、痰瘀互结等[16-17]。课题组认为其发病与现代人久坐少动、不节饮食、喜食膏粱厚味、偏嗜烟酒及忧思烦劳过度有关。上述因素均可直接或间接损伤脾主运化和主升清功能,导致脾虚不运,痰湿瘀热内蕴于三焦,阻碍机体气化,成为IGT主要病理基础,而“脾不散精,三焦失运为本,痰湿瘀热为标”为其主要病机。化瘀温胆汤以法半夏为君药,和胃降逆、祛痰化浊;竹茹甘寒,与法半夏配伍,既清热化痰,又降逆除烦;生姜、大枣培土和中,茯苓健脾渗湿,三者可清生痰之源;枳实破气消痰,陈皮燥湿理气化痰,二者可理气化痰、行气降逆;黄芩清热,葛根生津,二药合用可清热燥湿;酒白芍养血敛阴;三七可活血化瘀;甘草益气和中,调和诸药。全方共奏祛痰渗湿、清热生津、活血化瘀之功。
有研究显示,肠道菌群参与中药成分生物转化,中药成分对其具有调节作用,提示肠道菌群可作为治疗疾病的潜在靶点[18-19]。中医认为,肠道菌群紊乱是脾主运化功能失司、脾不散精的病理表现。任欣等[20]研究显示,小米膳食干预12周可显著提高IGT患者肠道菌群多样性和厚壁菌门/拟杆菌门比值及柔嫩梭菌属的相对丰度,调节肠道菌群稳态,推测饮食干预可通过改变IGT患者肠道菌群的组成和相对丰度改善机体血糖代谢。本研究基于IGT“脾虚不运、脾不散精”的病机特点,采用16S rDNA技术分析IGT大鼠肠道菌群结构特征,并初步探讨化瘀温胆汤的可能干预机制。研究发现,IGT大鼠肠道菌群多样性及丰度均降低,化瘀温胆汤可能通过提高肠道菌群的多样性和丰度,影响IGT模型大鼠的肠道菌群稳态,进而发挥其调节糖脂代谢的作用。
IGT大鼠肠道菌群结构组成柱状图显示,门水平各样本大鼠肠道菌群以Firmicutes为优势菌。Firmicutes作为人体肠道菌群最主要的优势菌,占总菌群的50%~60%,其与T2DM关系紧密。研究显示,增加肠道内Firmicutes的比例,如增加普拉氏梭杆菌,可增加肠道内丁酸菌的数量,进而改善机体的胰岛素抵抗[21]。属水平以在模型组数量最多,空白组数量最少,这与T2DM患者[22]、大鼠[16]肠道菌群中丰度增高的结论一致。此外,研究还发现梭菌纲(Clostridia)在模型组数量最少,空白组数量最多,这也与郭丽璇等[23]研究T2DM患者肠道菌群中Clostridia菌群丰度降低一致。在此基础上,本研究Anosim组间差异分析结果显示,模型组与空白组比较,肠道菌群群落结构差异显著,提示IGT大鼠肠道菌群菌落组成较空白组大鼠发生显著变化。
肠道菌群菌落的多样性和丰度是反映肠道菌群组成的重要指标。本研究采用ACE、Chao1、Shannon及Simpson指数反映群落的丰度和多样性,发现与空白组比较,IGT大鼠肠道菌群在丰度和多样性上差异显著,表明IGT大鼠肠道菌群表征发生改变,其肠道菌群菌落的丰度和多样性均减少,与临床IGT和糖尿病患者肠道菌群特点分析结果一致[24]。此外,本研究OTU韦恩图结果显示,空白组有41个OTU未在模型组中发现,而模型组中1个OTU未在空白组中发现,表明空白组与模型组菌群组成差异较大,提示IGT大鼠肠道菌群发生了变化。肠道菌群菌落丰度降低及多样性减少,易导致肠道微生态紊乱,成为代谢性疾病等众多疾病发生的潜在诱因[25]。二甲双胍作为阳性药物对照,不仅是糖尿病一线治疗药物,而且具有调节肠道菌群的作用[26]。与模型组比较,二甲双胍组和化瘀温胆汤组α多样性指数显著升高,而二者之间在肠道菌群丰度及多样性方面则无显著差异,提示两组药物均可能影响IGT大鼠的肠道菌群稳态,验证了二甲双胍可改善肠道菌群紊乱,同时提示化瘀温胆汤可能通过增加肠道菌群菌落的多样性和丰富度影响IGT大鼠的肠道微生态。
综上,本研究采用16S rDNA技术观察IGT大鼠肠道菌群的变化及化瘀温胆汤的可能干预机制,发现IGT大鼠肠道菌群稳态失衡,菌群群落多样性及丰度在一定程度上降低,化瘀温胆汤可能通过提高肠道菌群群落多样性和相对丰度影响IGT大鼠肠道菌群稳态,为化瘀温胆汤治疗IGT提供依据,但尚需扩大样本量和丰富研究手段进一步验证。
[1] COSENTINO F, GRANT P J, ABOYANS V, et al. 2019 ESC guidelines on diabetes, pre-diabetes, and cardiovascular diseases developed in collaboration with the EASD[J]. Eur Heart J,2020,41(2):255-323.
[2] SAEEDI P, PETERSOHN I, SALPEA P, et al. Global and regional diabetes prevalence estimates for 2019 and projections for 2030 and 2045:results from the International Diabetes Federation Diabetes Atlas, 9th edition[J]. Diabetes Res Clin Pract,2019,157:107843.
[3] SINGER-ENGLAR T, BARLOW G, MATHUR R. Obesity, diabetes, and the gut microbiome:an updated review[J]. Expert Rev Gastroenterol Hepatol,2019,13(1):3-15.
[4] NADERPOOR N, MOUSA A, GOMEZ-ARANGO L F, et al. Faecal microbiota are related to insulin sensitivity and secretion in overweight or obese adults[J]. J Clin Med,2019,8(4):452.
[5] 刘嘉钰,王艳东.肠道菌群在代谢疾病中作用的研究进展[J].中国慢性病预防与控制,2020,28(8):627-631.
[6] SHARMA S, TRIPATHI P. Gut microbiome and type 2 diabetes:Where we are and where to go?[J]. J Nutr Biochem,2019,63:101-108.
[7] GOROWSKA-KOWOLIK K, CHOBOT A. The role of gut micorbiome in obesity and diabetes[J]. World J Pediatr,2019,15(4):332-340.
[8] 马伯艳,张吉芳,张福利.化瘀温胆汤治疗代谢综合征48例疗效观察[J].中华中医药学刊,2012,30(1):72-74.
[9] 黎彦麟,刘璐佳,田苗,等.从三焦气化理论探讨张福利教授治疗糖耐量减低的经验[J].中国医药导报,2020,17(7):139-142.
[10] 张福利,曹昧,马伯艳,等.化瘀温胆汤对代谢综合征大鼠血脂、血压及脂肪细胞因子的干预作用[J].中医药信息,2011,28(6):58-60.
[11] 韩裕璧.化瘀温胆汤对糖耐量低减大鼠胰岛素抵抗及AMPK信号通路的影响[D].哈尔滨:黑龙江中医药大学,2017.
[12] 田苗,韩宇博,张福利,等.化瘀温胆汤对糖耐量低减大鼠肝脏核因子E2相关因子2、血红素加氧酶1 mRNA及蛋白表达影响[J].辽宁中医药大学学报,2021,23(4):32-36.
[13] 田苗,马伯艳,张贺,等.化瘀温胆汤对糖耐量低减大鼠肝细胞线粒体SOD及MDA水平的影响[J].中医药学报,2018,46(2):33-35.
[14] 中华医学会内分泌学分会.中国成人2型糖尿病预防的专家共识[J].中华内分泌代谢杂志,2014,30(4):277-283.
[15] American Diabetes Association. Standards of medical care in diabetes-2016[J]. Diabetes Care,2016,39(Suppl 1):S13-S22.
[16] 王宝华.糖耐量低减(IGT)的中医研究进展[J].北京中医,2004, 23(5):299-301.
[17] 唐奇志.中西药干预糖耐量低减的研究现状及展望[J].中华中医药学刊,2007,25(10):2079-2082.
[18] 张存艳,袁明昊,魏蔼玲,等.基于肠道菌群治疗疾病的中医药研究现状[J].中药材,2020,43(10):2596-2601.
[19] 王文晓,乐世俊,刘娟,等.基于肠道菌群的中药改善胰岛素抵抗的作用机制研究进展[J].中草药,2020,51(1):216-228.
[20] 任欣,沈群.小米膳食干预对糖耐量受损患者肠道菌群的影响[J]. 中国粮油学报,2020,35(12):37-43.
[21] 任梦琴,杨坤.肠道微生物——2型糖尿病的新型预防和治疗策略[J].中国临床研究,2018,31(7):984-988.
[22] SEDIGHI M, RAZAVI S, NAVAB-MOGHADAM F, et al. Comparison of gut microbiota in adult patients with type 2 diabetes and healthy individuals[J]. Microb Pathog,2017,111:362-369.
[23] 郭丽璇,胡琼英,熊大迁.肠道菌群调控2型糖尿病发生发展的研究进展[J].实用医学杂志,2020,36(9):1142-1147.
[24] 杜含光,陈霞波,顾颖杰,等.基于16S rRNA基因测序技术分析痰证糖耐量减低患者的肠道菌群特点[J].浙江中医杂志,2020,55(11):784-786.
[25] 杜珊,周月,陈斌.中医药与肠道微生态相关性研究进展[J].中国实验方剂学杂志,2019,25(18):182-188.
[26] FORETZ M, GUIGAS B, VIOLLET B. Understanding the glucoregulatory mechanisms of metformin in type 2 diabetes mellitus[J]. Nat Rev Endocrinol,2019,15(10):569-589.
Effects ofDecoction on Intestinal Flora of IGT Rats Based on 16S rDNA
TIAN Miao1, ZHOU Yingchun1, SUN Dan2, LI Weizhong1, FAN Dehui1, HAN Yubo2, LIU Li2, ZHANG Fuli1
To analyze the structural characteristics of intestinal flora in rats with impaired glucose tolerance (IGT) based on 16S rDNA technology; To preliminarily explore the possible intervention mechanism ofDecoction.Ten of 70 male SD rats were randomly selected as blank group, and the remaining 60 rats were fed with high fat and high sugar diet for 21 weeks to induce IGT rat model. 30 IGT model rats were randomly divided into model group,Decoction group and metformin group, with 10 rats in each group.Decoction group was given the TCM decoction for gavage; the metformin group was given the metformin suspension for gavage; the blank group and the model group were given normal saline for gavage. After 4 weeks of drug intervention, FPG and 2 h PG were measured, and feces in the colon were collected. Using 16S rDNA technology, based on OTU clustering results, the diversity and abundance of each group of samples were analyzed, and the species composition of each sample at the phylum and genus level was analyzed.The results of Venn diagram based on OTU showed that there were 445 OTUs shared by the four groups, and the similarity among the four groups was high, and the similarity between the blank group and the model group was the lowest. The alpha diversity analysis showed that compared with the blank group, the alpha diversity index of the model group decreased, while the alpha diversity index ofDecoction group and metformin group increased significantly. The homogeneity and abundance of the microbiome from high to low were the blank group,Decoction group, metformin group, and model group. The relative abundance results of species showed that, at the phylum level, Firmicutes was the dominant bacteria in each sample; Saccharibacteria had the largest number in the blank group and the least number in the model group; Euryarchaeota had the largest number in the blank group and almost zero in the model group. At the genus level, the number ofin each sample was the most. The number ofin the blank group was the least, and the number ofin the model group was the most. The analysis of structural differences between the groups showed that comparing the four groups of samples in pairs, the distribution of intestinal flora was obviously different.The homeostasis of intestinal flora in IGT rats is unbalanced, and the diversity and abundance of intestinal flora has decreased to a certain extent.Decoction may affect the intestinal flora homeostasis of IGT rats by increasing the diversity and relative abundance of gut microbiome.
Decoction; impaired glucose tolerance; intestinal flora; 16S rDNA technology; rats
R285.5
A
1005-5304(2021)08-0059-07
10.19879/j.cnki.1005-5304.202101419

黑龙江省自然科学基金联合引导项目(LH2020H080);黑龙江省博士后资助经费项目(LBH-Z19212);黑龙江中医药大学校科研基金项目(201818)
张福利,E-mail:fuli7505@163.com
(收稿日期:2021-01-23)
(修回日期:2021-03-04;编辑:华强)
